内蒙古汉族Stevens⁃Johnson综合征/中毒性表皮坏死松解症患者致敏药物及HLA基因筛查
2020-10-24李欣韩建文
李欣 韩建文
内蒙古医科大学附属医院皮肤科,呼和浩特010010
Stevens ⁃ Johnson 综合征(Stevens ⁃ Johnson syndrome,SJS)/中毒性表皮坏死松解症(toxic epidermal necrolysis,TEN)是罕见的严重急性皮肤黏膜迟发型超敏反应,几乎都与药物有关,主要特征为周身出现泛发性红斑、大疱、黏膜受累、表皮剥脱,伴高热及全身中毒症状,有致命风险。人类白细胞抗原(human leukocyte antigen,HLA)是人体复杂的基因复合体,呈现高度多态性,它在细胞间识别、抗原加工处理、免疫应答调节等方面发挥重要作用。药疹的发生具有一定的遗传学发病基础,基因突变改变了药物的代谢途径,HLA分子将加工的抗原提呈给T细胞上表达的受体使之活化,启动免疫应答。2004 年,Chung 等[1]发现,汉族人HLA⁃B*1502基因阳性与卡马西平诱发SJS强相关,推测存在该等位基因的患者服用卡马西平后极大可能发生SJS。本文回顾68 例药物致SJS/TEN 患者,探讨致敏药物及HLA⁃B*5801、HLA⁃B*1502、HLA⁃A*3101致病基因的携带情况。
对象与方法
一、对象
2015年1月至2019年11月在内蒙古医科大学附属医院皮肤科住院的68例汉族SJS/TEN患者,均经3位皮肤科医师确诊。诊断标准:①皮损呈典型/不典型的靶形损害或烫伤样外观,表皮、黏膜坏死脱落;②皮损面积小于体表面积10%者判定为SJS型,10%~30%者判定为SJS与TEN重叠型,>30%者判定为TEN型;③内脏损害严重。本研究经内蒙古医科大学伦理委员会及内蒙古医科大学附属医院医学伦理委员会批准(批号:YKD2016076、S.2019017),所有受试者均签署知情同意书。
二、方法
1. 提取外周血DNA:使用抗凝管收集受试者全血3 ml,分离白细胞,使用全血DNA 提取试剂盒(广州美基生物科技有限公司)提取DNA,验证DNA 纯度和浓度后,调节DNA 浓度至30 mg/L,于-20 ℃保存。
2. 引物设计及扩增:根据生物学信息库查询HLA⁃B*5801、HLA⁃B*1502、HLA⁃A*3101基因相关信息,设计PCR 引物(北京睿博兴科生物技术有限公司),经预实验验证使用分型引物序列(表1)。按照一步法荧光定量PCR试剂盒(江苏康为世纪生物科技有限公司,货号:CW0742S)说明书,采用SLAN96P 型荧光定量PCR 仪(上海宏石医疗科技有限公司)扩增。
3.琼脂糖凝胶电泳和基因型判读:30 μl PCR产物加样至1%琼脂糖凝胶上电泳,观察结果并拍照。HLA⁃B*5801、HLA⁃B*1502、HLA⁃A*3101基因的2 对(374 bp、319 bp)、3 对(125 bp、375 bp 和568 bp)、1对(480 bp)引物的PCR产物都存在时判定为阳性;若多对特异性引物中的1 对或1 对以上未扩增出目的片段,判定该基因型阴性。
4.致敏药物分析:收集患者的临床资料,参照基因分型,分析致敏药物。患者系单一用药或能明确致敏药物者称致敏药物,并列2种及以上者称可疑致敏药物。
三、统计学方法
使用SPSS21.0软件,多组间比较采用单因素方差分析,组间两两比较采用LSD⁃t检验,P<0.05为差异有统计学意义。

等位基因HLA⁃B*5801 HLA⁃B*1502 HLA⁃B*3101内参引物序号S1 S2 S1 S2 S3 S1 APC基因CTR正向引物(5′→3′)ACCGAGAGAACCTGCGGAT AACATGAAGGCCTCCGCG CGCGAGTCCGAGGATGGC GGAGTATTGGGACCGGAAC ACCGGAACACACAGATCTC GATAGAGCAGGAGAGGCCT ATGATGTTGACCTTTCCAGGG反向引物(5′→3′)GCCATACATCCTCTGGATGA GAGGAGGCGCCCGTCG GCAGGTTCCGCAGGCTCT GCCATACATCCTCTGGATGA GAGCCACTCCACGCACAG GCGCAGGTCCTCGTTCAA TTCTGTAACTTTTCATCAGTTGC产物长度(bp)374 319 125 375 568 480 250
结果
一、一般资料
68 例SJS/TEN 患者,男36 例,女32 例,年龄(46.06 ± 19.97)岁(3 ~84 岁)。SJS、SJS/TEN、TEN组年龄差异有统计学意义(F = 4.20,P = 0.019),TEN 组年龄高于SJS 组(LSD⁃t=2.08,P=0.042)和SJS⁃TEN重叠型组(LSD⁃t=2.87,P=0.005)。60岁以上患者17 例,3 组患者年龄差异有统计学意义(F = 3.80,P = 0.048),TEN 组高于SJS 组(LSD⁃t =2.56,P=0.022),而TEN 组和SJS⁃TEN 重叠组间差异无统计学意义(LSD⁃t = 0.55,P = 0.591)。见表2。
二、SJS/TEN 患者HLA⁃B*5801、HLA⁃B*1502、HLA⁃A*3101基因型携带情况及致敏药物
68 例SJS/TEN 患者中携带HLA⁃B*5801、HLA⁃B*1502、HLA⁃A*3101 等位基因者分别为5 例、14 例、1 例,合计20 例。14 例HLA⁃B*1502 基因型阳性患者中10例为SJS⁃TEN重叠型。见表3。
4 例致敏药物为别嘌醇,HLA⁃B*5801 基因均阳性;5 例为卡马西平,HLA⁃B*1502 基因均阳性;5 例拉莫三嗪,其中4例HLA⁃B*1502基因阳性。仅1 例HLA⁃A*3101 阳性的患者,其可疑致敏药物为中药活血针剂,具体药名、成分陈述不清。48 例3 型等位基因均阴性,其致敏/可疑致敏药物涉及6 类,分别为抗菌药物、中药制剂、解热镇痛类药物、平喘药物、抗癫痫药物、抗结核药物。见表4。
讨论
目前认为,SJS 和TEN 是引起表皮松解的严重药物不良反应的两个终点。我科2015年全年收治汉族SJS/TEN 患者9 例,约占我科年入院患者的7.5‰,而2019 年度截至11 月时已收治23 例,约占20.5‰,SJS/TEN 患者占比有上升趋势。本研究中TEN 型患者年龄高于SJS 型和SJS⁃TEN 重叠型;在60 岁以上患者中,TEN 型患者年龄亦高于SJS 型,提示老年患者更容易发展为TEN型。
SJS/TEN 发生的确切机制尚不明确,主要观点有:①SJS/TEN 患者对特定药物及中间代谢产物的解毒能力受损,此类产物富集与机体组织形成抗原抗体复合物导致免疫反应;②细胞毒性T淋巴细胞和自然杀伤细胞激活多种细胞毒性信号的释放,导致细胞免疫失调;③遗传基因易感性,如HLA⁃B*5801、HLA⁃B*1502、HLA⁃A*3101 等[2]。本文68 例患者致敏/可疑致敏药物涉及八大类,广泛筛查以上3组等位基因在患者中的分布情况后显示,检出5 例HLA⁃B*5801 基因型阳性,4 例为别嘌醇致敏者。2005 年,Hung 等[3]发现,该药致SJS/TEN 患者中HLA⁃B*5801等位基因频率明显升高。2017年,尚鹏超等[4]纳入228例汉族人别嘌醇致重症药疹的Meta 分析,结果显示,别嘌醇致SJS/TEN 与携带HLA⁃B*5801等位基因具有明确相关性。本文携带HLA⁃B*5801 基因型患者中,别嘌醇致SJS/TEN 敏感性100%,敏感性98.33%,结合既往文献结果,当患者使用包括别嘌醇在内的多种药物时,可以通过检测HLA⁃B*5801 等位基因协助区分致敏药物。本文中另1例HLA⁃B*5801基因型阳性患者的致敏药物为去痛片,为非别嘌醇致敏,因此该等位基因是否会增加其他药物致敏的可能,还需大样本研究。
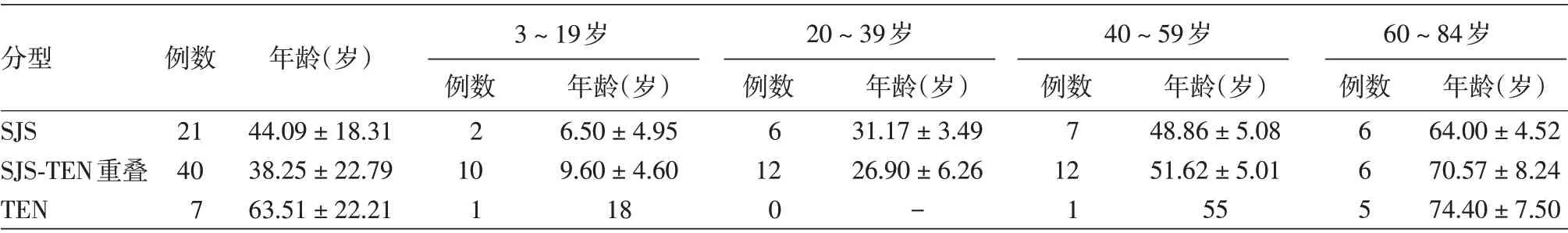
分型SJS SJS⁃TEN重叠TEN例数21 40 7年龄(岁)44.09±18.31 38.25±22.79 63.51±22.21 3 ~19岁20 ~39岁40 ~59岁例数2 10 1年龄(岁)6.50±4.95 9.60±4.60 18例数6 12 0年龄(岁)31.17±3.49 26.90±6.26-例数7 12 1年龄(岁)48.86±5.08 51.62±5.01 55 60 ~84岁例数665年龄(岁)64.00±4.52 70.57±8.24 74.40±7.50

分型例数HLA⁃A*3101阳性SJS SJS⁃TEN重叠TEN合计21 40 7 68 HLA⁃B*5801阳性3(14.29)1(2.50)1 5(7.35)阴性18(85.71)39(97.50)6 63(92.65)HLA⁃B*1502阳性3(14.29)10(25.00)1 14(20.59)阴性18(85.71)30(75.00)6 54(79.41)001 1(1.47)阴性21(100.00)40(100.00)6 57(98.53)

药物抑尿酸生成药物别嘌呤醇抗癫痫药卡马西平拉莫三嗪抗菌药物头孢菌素阿莫西林解热镇痛药去痛片复方氨酚烷胺片中蒙药制剂双黄连治脱发蒙药(成分不清)中药活血针剂(成分不清)抗肿瘤药物吡柔比星其他药物合计(频次)例数HLA⁃B*5801阳性(5例)HLA⁃B*1502阳性(14例)HLA⁃A*3101阳性(1例)3项全阴(48例)455 054 001 11 12 4000010000005 3(1+1a+1b)8(3+5c)11(6+5c)1a01b 0 3(2+1c)141121 34 81 1a1010 00103 4 17(12+3a+2b)0000000001001 58(30+28c)
据Chung等[1]报道,HLA⁃B*1502基因型与卡马西平诱导SJS/TEN强相关,并且该基因型在我国较为常见。本研究68 例SJS/TEN 患者中,14 例为HLA⁃B*1502 基因型携带者,其中10 例为SJS⁃TEN重叠型。从致敏药物来看,14 例的致敏药物分别为卡马西平5 例、拉莫三嗪4 例、其他药物5 例。HLA⁃B*1502基因型阴性患者中无卡马西平致敏患者,有1例拉莫三嗪致敏者。卡马西平与拉莫三嗪同属于芳香族抗癫痫药物,早期对前者研究众多,近年高阳等[5]关于中国南方汉族癫痫患者HLA⁃B*1502 基因型与拉莫三嗪致SJS/TEN 关联性的Meta分析也发现,二者之间存在显著相关性(OR =4.44)。因此建议该基因作为临床应用卡马西平和拉莫三嗪前的筛查指标之一。但仍有1 例拉莫三嗪致SJS/TEN 的HLA⁃B*1502、HLA⁃A*3101基因型均阴性,可能存在其他拉莫三嗪致敏的易感位点,例如HLA⁃B*1511[6]、HLA⁃B*1521[7]、HLA⁃A*2404[8]等已知或未知少见基因型。值得注意的是,本文14例HLA⁃B*1502基因型阳性的SJS/TEN患者中有5 例的致敏药物/可疑致敏药物并非卡马西平或拉莫三嗪,而是抗菌药物、解热镇痛类药物、抗肿瘤药物、中药制剂,其中的3 例为头孢菌素类引起的患者。临床中致敏药物多为患者或家属的主观回顾,不能排除同时服用可能含有上述成分的药物,或是这些患者服用卡马西平或拉莫三嗪等也会发生SJS/TEN,抑或HLA⁃B*1502 基因型阳性可能也会增加头孢菌素、阿莫西林或其他药物的过敏概率,但这些猜测尚无法证实。本文中共有11例头孢菌素引起的SJS/TEN,8例HLA⁃B*1502等位基因显示阴性。
2011 年,McCormack 等[9]建议欧洲及日本血统人群服用卡马西平前筛查HLA⁃A*3101等位基因,以防发生SJS。但本文68例患者中,仅1例HLA⁃A*3101 等位基因阳性,且其可疑致敏药物并不明确。这一结果提示,内蒙古汉族人群的HLA⁃A*3101 基因携带率低,对于卡马西平用药前筛查HLA⁃B*1502 等位基因价值可能大于HLA⁃A*3101等位基因。
本研究中SJS/TEN 患者致敏及可疑致敏药物共涉及八大类28种,出现的频次由高到低分别为,抗菌药物、中药制剂、解热镇痛药、抗癫痫药物、平喘药物、抑制尿酸合成药物。近1/3 患者非单一用药,其中抗菌药物、解热镇痛药物、中药制剂多在疾病中联合使用,患者致敏后难以鉴别。
综上,本研究发现,长期居住在内蒙古的汉族SJS/TEN 患者,别嘌醇致敏与HLA⁃B*5801 密切相关,卡马西平、拉莫三嗪与HLA⁃B*1502 可能密切相关,但HLA⁃B*1502 阳性在其他药物致敏患者中比例也较高,HLA⁃A*3101 基因型在SJS/TEN 患者中阳性比例低。因此建议在使用高致敏风险药物如别嘌醇、卡马西平、拉莫三嗪等前尽可能检测易感基因,对于药疹的预防具有重要价值。但遗憾的是,SJS/TEN 发病率低,可研究病例总数少,具体到不同型别或不同致敏药物分组中病例数更少,今后还需继续积累并增加HLA的其他易感基因分型检测,以便得到更可靠的结果。
利益冲突所有作者均声明不存在利益冲突
