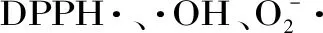浏阳豆豉发酵过程中抗氧化成分及活性变化研究
2020-10-23蒋立文廖卢艳
陈 怡,刘 洋,蒋立文,李 跑,廖卢艳
(1.湖南农业大学食品科学技术学院,湖南长沙 410128;2.食品科学与生物技术湖南省重点实验室,湖南长沙 410128)
豆豉是一类历史悠久的发酵豆制品,拥有独特的风味和较高的食用、药用价值[1],深受消费者喜爱。本实验研究的浏阳豆豉是以泥豆或小黑豆为原料,经过自然制曲、洗曲、堆积发酵、晒干而成的典型的曲霉型淡豆豉,曾在马王堆女尸墓中被挖掘,也因其独特的风味广受人们喜爱,是湘菜中不可或缺的一种调味料。属于淡豆豉的浏阳豆豉一直作为药用原料在药品中使用[2],李时珍的《本草纲目》记载到自梁代以来,淡豆豉就一直在医学上广泛应用,有开胃增食、消食化滞、发汗解表等功效[3]。
近年来,随着国家大健康产业需要,人们逐渐开始重视食品的营养价值和保健功能,而氧化应激则被认为是造成许多慢性疾病如心血管疾病、糖尿病等的重要原因[4]。大豆及其制品含有多种天然抗氧化成分,如VE、VC、异黄酮等[5],表现出良好的抗氧化活性,其中大豆异黄酮是大豆及其制品中研究最多的抗氧化物质,是一种生物类黄酮。研究表明,大豆异黄酮共有12种,分别为占大豆异黄酮总含量97%~98%的结合型糖苷和占2%~3%的游离型苷元两大类,游离型苷元主要以大豆素(daidzein)、大豆黄素(glycitein)、染料木素(genistein)为主,糖苷型则以大豆苷(daidzin)、大豆黄苷(glycitin)、染料木苷(genistin)为主[6]。试验证明,人体利用大豆异黄酮苷元的速度远高于糖苷型,且苷元型大豆异黄酮无论在抗氧化、抗脂质过氧化等方面均比糖苷型高[7]。大豆及普通大豆食品中的异黄酮主要是以糖苷形式存在,而在发酵过程中,大豆中的糖苷在微生物的作用下转化为活性更高的异黄酮苷元,因此,发酵豆制品往往较大豆及其制品具有更强的生物活性[8]。现阶段,对浏阳豆豉较多的研究集中在发酵阶段中气味物质[9]的变化以及微生物多样性分析[10]两个方面,但关于发酵过程中抗氧化活性变化的规律缺乏探索。
1 材料与方法
1.1 材料与仪器
浏阳豆豉样品 均采自与湖南梁嘉食品有限公司;1,1-二苯基-2-三硝基苯肼(1,1-diphenyl-2-picrylhydrazyl,DPPH) 梯希爱(上海)化成工业发展有限公司;芦丁(rutin)、没食子酸(gallic acid)、大豆苷(daidzin)、大豆黄苷(glycitin)、染料木苷(genistin)、大豆素(daidzein)、大豆黄素(glycitein)、染料木素(genistein) 标准品(纯度≥98%),成都曼思特生物科技有限公司;福林酚 合肥博美生物科技有限公司;乙腈、二甲基亚砜(色谱纯) 天津市光复科技发展有限公司;其余试剂 均为国产分析纯。
AUY220微量分析天平 岛津公司;Agilent 1100 servies高效液相色谱仪 安捷伦;LGJ-10真空冷冻干燥机 北京松源华兴科技发展有限公司;Thermo Scientific Multiskan FC全波长酶标仪 上海旦鼎国际贸易有限公司;H-2050R高速冷冻离心机 美国贝克曼公司;KQ3200E超声波振荡器 上海五相仪器仪表有限公司;KHW-S-4电热恒温水浴锅 天津市泰斯特仪器有限公司;0.45 μm针孔式滤膜 天津科亿隆实验设备有限公司。
1.2 实验方法
1.2.1 样品处理 样品取自梁嘉浏阳豆豉有限公司同批次豆豉产品不同发酵阶段的浏阳曲霉型豆豉(如图1所示)样品10个(L0、L1、L3、L5、L7、L9、L12F、L12S、L14、L20),共有10个,其中前发酵包括L0、L1、L3、L5、L7、L9共6个样品,L12F、L12S分别为洗霉前后两个样,L12S~L20为渥堆发酵时期。样品采用专用无菌袋包装后-80 ℃保存,样品均取好后,各样经真空冷冻干燥后粉碎,过80目筛,置于-20 ℃冰箱中保存备用。
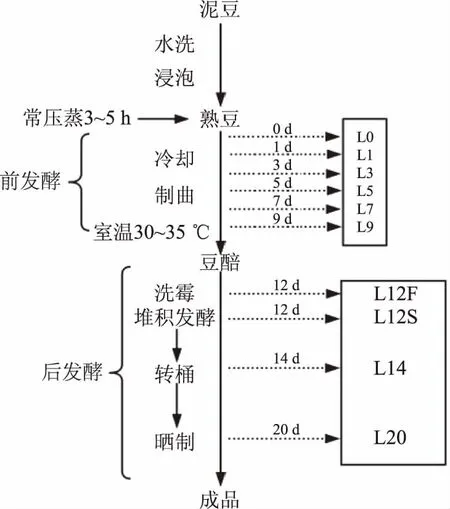
图1 浏阳豆豉制作过程以及取样情况
1.2.2 大豆异黄酮含量的测定
1.2.2.1 样品处理 参考国标GB/T 23788-2009 保健食品中大豆异黄酮的测定方法[11],精确称取且记录浏阳豆豉样品粉末0.400~0.500 g,加入80%甲醇溶液溶解后,倒入50 mL容量瓶中并加至接近刻度线,超声(常温,20 kHz,20 min)后定容。摇匀后8000 r/min离心15 min。取上层清液过0.45 μm针孔式滤膜备用。
1.2.2.2 色谱条件 Agilent C18色谱柱(250 mm×4.6 mm×5 μm);流动相A乙腈与流动相B磷酸水溶液(pH=3.0)梯度洗脱详情见表1;流速1.0 mL/min;波长260 nm;进样量10 μL;柱温30 ℃。
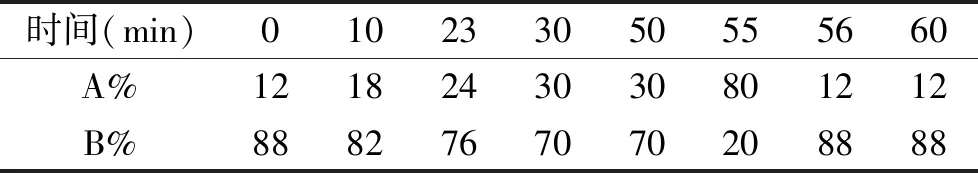
表1 梯度洗脱参数
1.2.2.3 标准曲线的绘制 配制6种400 mg/L单标准品溶液,分别配制成8.0、16.0、24.0、32.0、40.0 mg/mL 5种不同浓度的混合标准溶液。
1.2.3 总黄酮含量的测定 样品前处理:按照1∶30物料比(W/V))加入80%乙醇超声(常温,20 kHz,30 min),记录样品重量精确至0.001 g;采用硝酸钠-硝酸铝比色法[12],实验步骤:加入0.40 mL NaNO2摇匀6 min,加入0.40 mL Al(NO3)3摇匀,放置6 min,再加入4 mL NaOH,用80%乙醇定容至10 mL,摇匀,15 min后510 nm下测定吸光值;标曲绘制:80%乙醇溶解40 mg芦丁,定容至100 mL。吸取0.6、1.2、1.8、2.4、3.0 mL芦丁溶液,按照实验步骤反应后测定吸光值,绘制标准曲线。
1.2.4 总多酚含量的测定 采用Folin-酚比色法进行测定[13]。标准曲线绘制:称取没食子酸25 mg溶解于100 mL蒸馏水中。分别取0.1、0.2、0.3、0.4、0.5 mL于5支比色管中,分别加入体积分数为10%的Folin-酚试剂2.5 mL和7.5 g/mL Na2CO3溶液2 mL,加水定容至10 mL。在45 ℃水浴中反应15 min,波长765 nm处测定其吸光度。样品的测定:取提取液1 mL,按上述步骤操作,试验重复3次,取平均值。
1.2.5 DPPH自由基清除率的测定 以1∶10的比例用80%的乙醇溶解,并超声提取30 min,8000 r/min,离心15 min,取上清液备用。分别取三支试管,依次标记为1、2、3,分别作为测试、对照、空白管。1、2号试管中各加入2 mL提取液,1、3号试管中分别放入1.5 mL 2 mmol/L DPPH,最后2、3号管分别加入中加入1.5 mL和1 mL的无水乙醇,反应30 min[14]。以上操作做三组平行,计算平均值。计算公式如下:
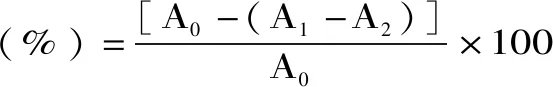
式中:A1为1.5 mL DPPH·溶液+1 mL样品液的吸光度;A2为1 mL样品液+1.5 mL无水乙醇的吸光度;A0为1.5 mL DPPH·溶液+1 mL无水乙醇的吸光度。
1.2.6 羟自由基(·OH)清除率的测定 取3支试管,第1支加入0.2 mL的10 mmol/L水杨酸-乙醇溶液、0.2 mL,10 mmol/L硫酸亚铁溶液、0.2 mL样液、0.2 mL蒸馏水和0.2 mL,3%过氧化氢,摇匀37 ℃,1 h,于550 nm处测定吸光值。第2支试管中以0.2 mL的80%乙醇代替样液,第3支中以0.2 mL蒸馏水代替过氧化氢,其余与第1支试管相同。计算公式如下:
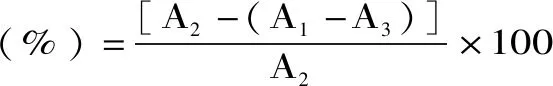
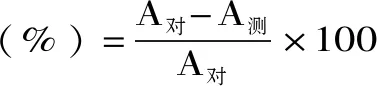
1.2.8 总抗氧化能力测定 按照南京建成生物工程研究所总抗氧化能力(T-AOC)试剂盒进行测定。
1.3 数据处理
试验平行测定3次,采用Excel 2003、Origin 9.0、SPSS软件对其数据进行数理统计分析与相关性分析。
2 结果与分析
2.1 浏阳豆豉发酵过程中大豆异黄酮含量的变化
图2是各标品的出峰时间以及标准曲线,大豆苷(14.586 min)标准曲线为:y=39269x-10463,R2=0.9997;大豆黄苷(15.653 min)标准曲线为:y=37741x-10470,R2=0.9995;染料木苷(20.811 min)标准曲线为:y=54862x-31384,R2=0.999;大豆素(31.261 min)标准曲线为:y=62736x-33920,R2=0.9983;大豆黄素(32.747 min):y=50738x-26673,R2=0.999;染料木素(40.908 min):y=83819x-87887,R2=0.9966。
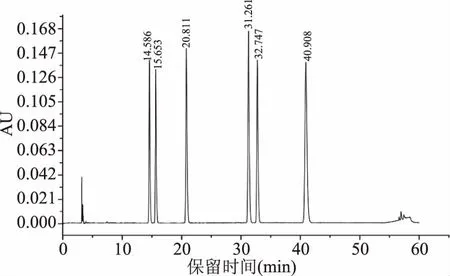
图2 标准样品色谱图
未发酵大豆中的大豆异黄酮主要为糖苷型的大豆苷、大豆黄苷、染料木苷,在发酵过程中,由于微生物能够分泌β-葡萄糖苷酶,作用于异黄酮糖苷,使其完全水解为异黄酮苷元[15],三者被依次转化为大豆素、大豆黄素、染料木素。研究表明,游离的苷元比糖苷更有广泛的生物活性[16-18]。同时,研究发现异黄酮A环上酚羟基越多则抗氧化作用越强[19],且7-位氧苷的形成对其抗氧化活性十分不利[20],因而苷元具有更强的抗氧化活性。此外,由于苷元型大豆异黄酮分子量明显低于糖苷型大豆异黄酮,如大豆素分子量为254.23,大豆苷的分子量为416.38,同等摩尔质量下的大豆素质量较大豆苷高38.94%,因此发酵过程中糖苷型异黄酮到苷元型异黄酮的转化可能是导致浏阳豆豉总黄酮含量(w/w)降低(图3)的重要原因。
根据表2可知豆豉发酵过程中其大豆异黄酮的变化情况。在原料熟豆(L0)中异黄酮的总量最高,为(2696.05±7.25) mg/kg,但此时糖苷型大豆异黄酮占总量的85.75%。在豆豉发酵前期(L0~L12F),糖苷型大豆异黄酮总量从(2312.56±2.53) mg/kg降低至(598.53±0.59) mg/kg,而苷元型大豆异黄酮含量则上升至(866.52±5.10) mg/kg,二者分别占总量的40.08%和59.14%,说明糖苷型大豆异黄酮有明显向苷元型异黄酮转化的趋势,这与索化夷等[21]对永川豆豉发酵过程中大豆异黄酮变化趋势一致。在洗霉后(L12S),除大豆黄苷以外,其它各个组分都有下降现象,其中大豆苷和染料木素分别是糖苷型和苷元型大豆异黄酮中在洗霉前后下降幅度最大的组分,较洗霉前各下降了89.31%、45.55%。在后发酵渥堆期间(L12S~L20)糖苷型异黄酮含量持续下降,而苷元型大豆异黄酮快速增加,至发酵最后一天(L20)各占异黄酮总量的18.58%和81.41%。Zhi等[22]对大量文献进行总结得出,产β-葡萄糖苷酶的微生物主要包括细菌、放线菌、酵母、丝状真菌等;石聪等[10]对浏阳豆豉微生物研究表明在后发酵阶段酵母菌以及细菌大量生成,说明在后发酵期间菌群的种类大幅度变化造成β-葡萄糖苷酶的增加可能是导致在此期间苷元型大豆异黄酮迅速增加的原因之一。
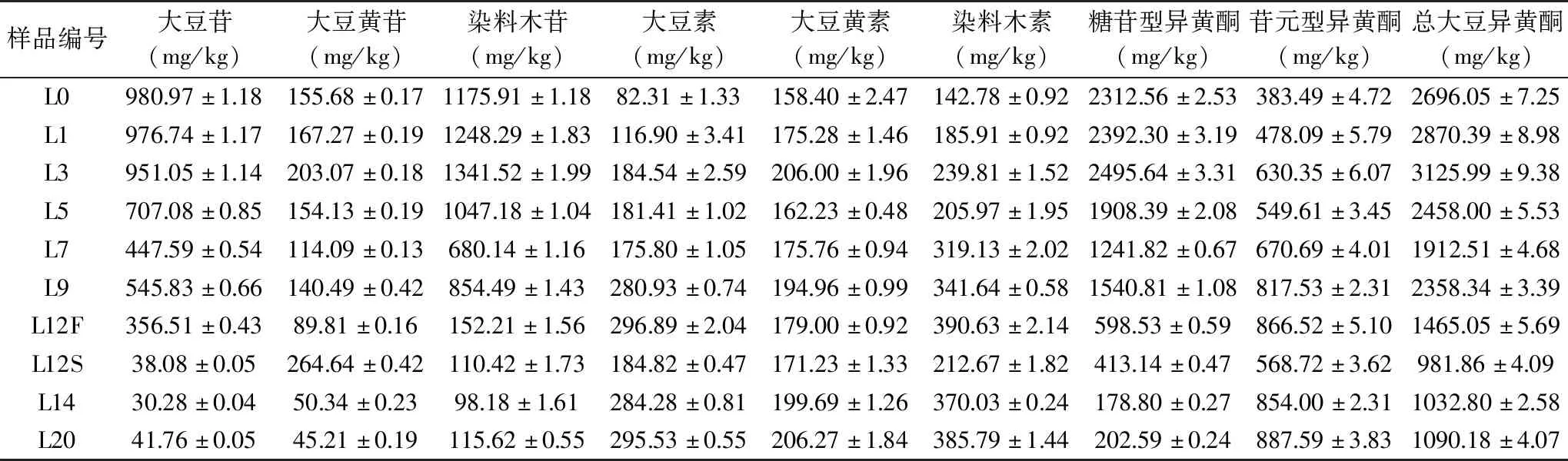
表2 浏阳豆豉发酵过程中大豆异黄酮的变化
2.2 浏阳豆豉发酵过程中总多酚、总黄酮含量变化
按照1.2.3、1.2.4小节中所表述的方法进行标准曲线的绘制,得出芦丁标准曲线为:y=0.029x+0.0187,R2=0.9909;没食子酸标准曲线为:y=0.2553x+0.0024,R2=0.9812。
由于多酚与黄酮大量存在于大豆中,是重要的抗氧化活性成分,这类化合物具有抗动脉硬化、降低胆固醇、抗氧化等作用[23]。其含量的高低与抗氧化能力密切相关,通过测定黄酮、多酚的含量变化情况,可以探究豆豉发酵过程中抗氧化能力的变化的原因。具体变化情况见图3。
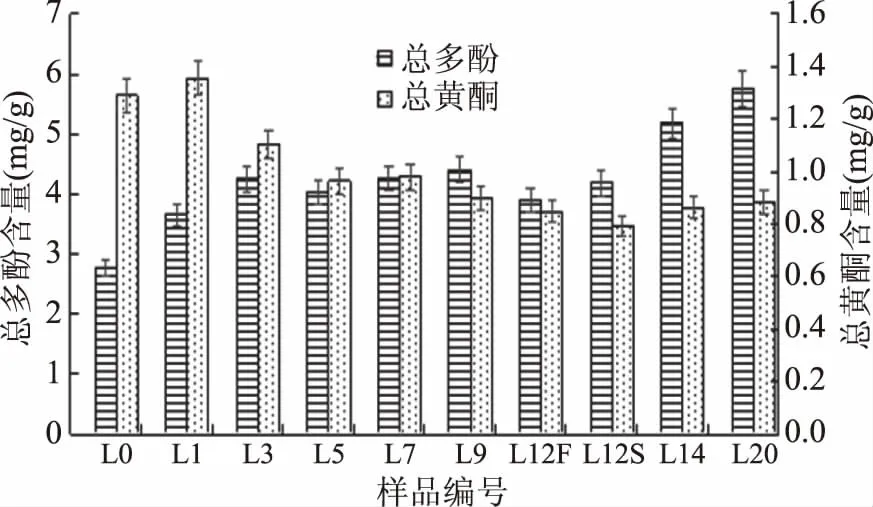
图3 浏阳豆豉发酵过程中总多酚和总黄酮含量的变化
由图3可知,未经发酵的泥豆也具有较高含量的多酚与黄酮,多酚含量在发酵前期(L0~L7)从(2.78±0.14) mg/g迅速增加至(4.26±0.21) mg/g,而在发酵中期(L7~L12F)总多酚含量变化较小,洗曲(L12S)后多酚含量明显下降,这可能是由于洗曲导致部分水溶性多酚流失导致的[24]。发酵后期(渥堆),多酚的含量迅速增加,到第20 d时其含量为(5.76±0.21) mg/g,是未发酵时的2.07倍。此外,王露[25]筛选出的节杆菌和芽孢菌发酵番石榴叶时可引起可溶性多酚的大量释放。而石聪等[10]分析不同阶段的浏阳豆豉中微生物的丰度发现洗霉前后微生物群差异较大,前发酵时期真菌为优势菌,而后发酵期间酵母菌和芽孢杆菌等细菌开始大量繁殖,这可能是导致发酵中后期多酚含量增速提升的原因。
大豆中的黄酮包括多种物质,如花色苷、黄酮等。发酵过程中,除L1有小幅度增加外,总黄酮含量呈明显的下降趋势,且发酵早期下降速度较快,L5较未发酵大豆下降了25.25%,而发酵后期(L12S~L20)出现缓慢上升的趋势,从0.790 mg/g增加至0.881 mg/g,但无明显差异。前期快速下降原因可能部分不稳定的黄酮类化合物分解,接下来微生物大量繁殖,大豆异黄酮次级代谢产物开始生成,维持总黄酮含量的平衡,同时微生物产生的β-葡萄糖苷酶将大豆异黄酮中的糖苷型异黄酮转为苷元型[26-27],由于后者具有更强的抗氧化活性,导致豆豉抗氧化活性的增强。
2.3 浏阳豆豉发酵过程中抗氧化活性的变化
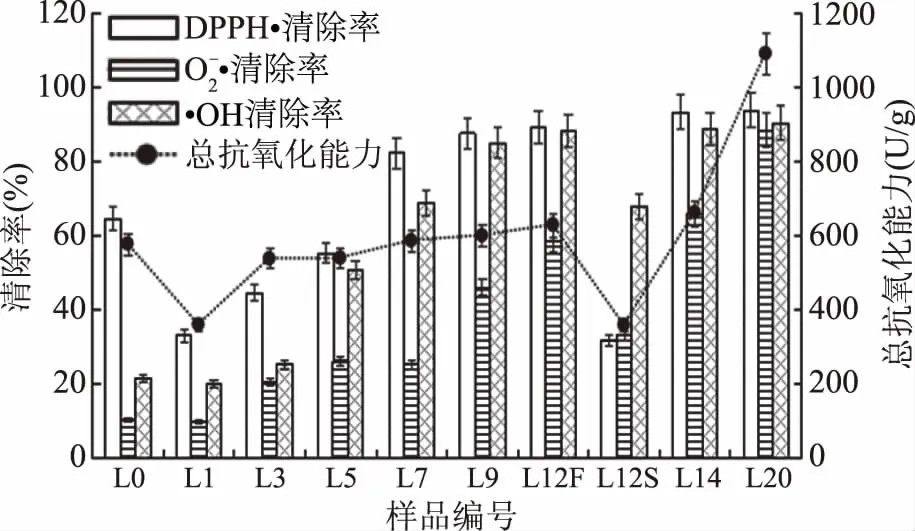
图4 浏阳豆豉发酵过程中三种自由基清除率和总抗氧化能力的变化

2.4 抗氧化活性与多酚、大豆异黄酮的相关性分析
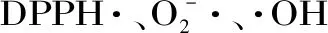
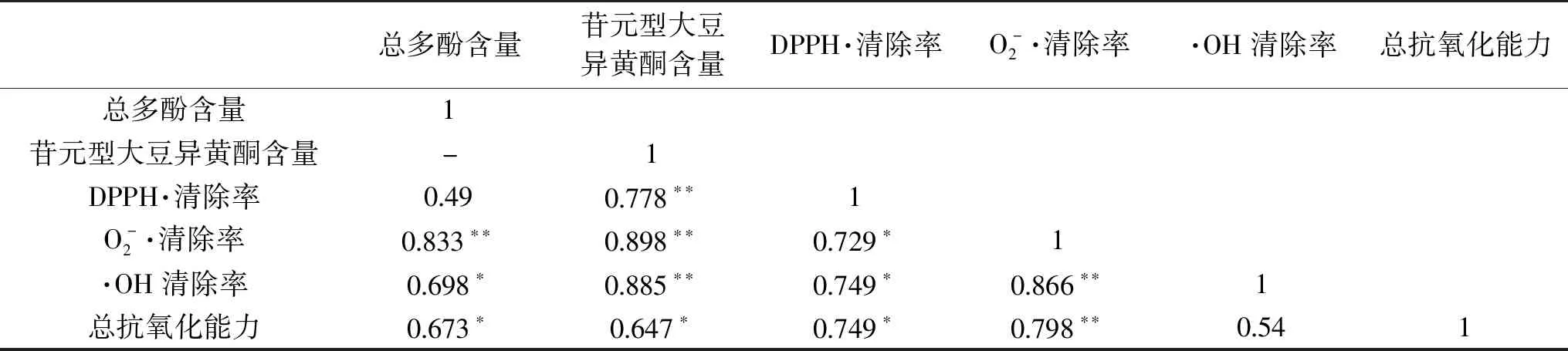
表3 总多酚、苷元型大豆异黄酮含量与自由基清除率和总抗氧化能力的相关性分析
3 结论