牦牛酸奶中一株具有抗氧化活性乳酸菌的分离及鉴定
2020-10-23杨运南高彦华
李 潇,谢 亮,+,杨运南,高彦华,2,*
(1.西南民族大学生命科学与技术学院,四川成都 610041;2.青藏高原动物遗传资源保护与利用教育部重点实验室,四川成都 610041)
牦牛奶及其发酵产物是青藏高原地区牧民主要食品来源和经济来源[1]。发酵牦牛酸奶的营养价值较高,与常规酸奶制品相比,牦牛酸奶的乳脂和总蛋白含量提高了两倍,维生素与矿物质等养分含量也显著增加[2]。牦牛发酵乳中微生物菌群组成比较复杂,优势菌群主要为乳酸菌(Lactic acidic bacteria,LAB),主要有乳酸杆菌属、乳球菌属、链球菌属、双歧杆菌属、明串珠菌属、片球菌属、肠球菌属、魏斯氏菌属等组成[3],此外还有酵母菌[4]。
畜禽生产过程中,由于环境温度、断奶、疾病等体内外因素,导致动物机体产生活性氧自由基,高水平的氧自由基导致氧化应激,造成肠道损伤和细胞死亡[5-8]。也有研究表明,牦牛酸奶来源的乳酸菌具有抗氧化作用与清除氧自由基能力[9-11]。因此,发酵牦牛酸奶是乳酸菌的资源宝库,从中筛选出具备较高抗氧化活性的乳酸菌生产抗氧化微生态制剂,对于缓解动物肠道氧化应激,提高动物免疫抗病力具有重要意义。
本研究从传统发酵牦牛酸奶中分离出了一株新的乳酸菌X1,经生理生化反应及16S rDNA鉴定,确定其为屎肠球菌。屎肠球菌作为一种乳酸菌,是饲料用安全菌种之一,在饲料中添加屎肠球菌能改善肉鸡抗氧化应激能力[12],提高肉鸡日增重和饲料转化率[13],缓解肠道菌群失调及机体的氧化应激损伤[14],提高仔猪免疫和抗氧化功能等作用[15]。通过比较屎肠球菌X1与其他来源的屎肠球菌的体外抗氧化特性,为牦牛酸奶来源的屎肠球菌开发以及为新型抗氧化微生态制剂提供基础数据。
1 材料与方法
1.1 材料与仪器
牦牛酸奶样品(n=3) 四川省康定县新都桥镇采集;参考菌株屎肠球菌G2 西南民族大学生命科学与技术学院罗璠副教授馈赠;TIANamp Bacteria DNA Kit细菌基因组DNA提取试剂盒、Loading buffer、DNA Ladder 北京天根生化科技有限公司;pEASY-T1 Cloning Kit、Easy Taq polymerase、Trans1-T1 Phage Resistant Chemically Competent Cell 北京全式金生物技术有限公司;革兰氏染色试剂盒 北京索莱宝生物科技有限公司;SanPrep柱式质粒DNA小量抽提试剂盒、BBI Life Sciences 4S green Plus Nucleic Acid Stain核酸荧光染料 上海生工生物工程有限公司;亮绿、1-二苯基-2苦基肼/DPPH 源叶生物技术有限公司;总抗氧化能力(T-AOC)试剂盒 南京建成生物工程研究所;M17培养基、MPC培养基、BCP培养基、产酸培养基和乳酸菌糖醇发酵鉴定试纸条(HBIG11) 青岛海博生物技术有限公司。
Biospec-nano微量核酸浓度检测仪 日本岛津公司;S1000 PCR 扩增仪 BIORAD公司;JY-SPCT型水平电泳槽 北京君意东方电泳设备有限公司;SYNGENE 凝胶成像系统 Gene Company Limited公司;SW-CJ医用型洁净工作台 苏州安泰空气技术有限公司;318C型酶标仪 上海沛欧分析仪器有限公司;JY98-ⅢN型超声波细胞粉碎机 宁波新芝生物科技股份有限公司。
1.2 实验方法
1.2.1 总菌与乳酸菌的菌落计数 采用平板计数法对牦牛酸奶样品进行总菌与乳酸菌的菌落计数[9]。取酸奶样品1 mL,测定其pH,然后加入9 mL无菌生理盐水,制备成1∶10的酸奶稀释液。再取100 μL加入900 μL无菌生理盐水,进行梯度稀释。选取105~107的稀释梯度,吸取100 μL均匀涂布于MPC琼脂表面,待表面吸收干后,于37 ℃培养48 h,对总菌数量进行计数。选取104~106的稀释梯度,吸取100 μL均匀涂布于BCP琼脂表面,待表面吸收干后,放在厌氧袋中,在37 ℃倒置培养18~24 h,对乳酸菌总数进行计数。
1.2.2 乳酸菌的分离与形态学鉴定 取酸奶样品1 mL,加入9 mL无菌生理盐水,制备成1∶10的酸奶稀释液。再取100 μL加入900 μL无菌生理盐水,进行梯度稀释。取不同梯度稀释液100 μL加入M17(加入2.5%的CaCO3)培养基中,用三角棒涂布均匀,放在厌氧袋中,37 ℃倒置培养24 h。仔细观察菌落,挑取白菌落形态规则、大小适中、有透明溶钙圈的单菌落。在M17液体培养基中富集,吸取10 μL进行革兰氏染色,然后在M17固体培养基上划线培养(37 ℃,24 h)。制备菌液涂片,利用100倍油镜观察菌体形态。
1.2.3 乳酸菌的产酸试验与生化反应鉴定 挑取乳酸菌单菌落接种于产酸培养基中,37 ℃,200 r/min,厌氧培养48 h,测量菌液pH。采用文献[10]的方法对菌液进行过氧化氢酶实验。采用乳酸菌生化鉴定试剂盒,37 ℃培养24~48 h,按产品说明判断各种生化反应的结果类型,对菌株进行初步鉴定。
1.2.4 乳酸菌16S rDNA的分子鉴定 挑取M17固体培养基上纯化培养的单菌落,接种于5 mL M17液体培养基,37 ℃,厌氧培养24 h,采用TIANamp Bacteria DNA Kit细菌基因组DNA提取试剂盒提取细菌基因组DNA。采用细菌通用引物27F(5′-AGAGTTTGATCMTGGCTCAG-3′)和1492R(5′-TACGGYTACCTTGTTACGACTT-3′)对菌株的16S rDNA 进行PCR扩增。本实验应用的RCR体系(50 μL)包括:细菌基因组DNA 2 μL,27F引物(10 μmoL/L)1 μL,1492R引物(10 μmoL/L)1 μL,10×Easy Taq Buffer 5 μL,Easy Taq polymerase 1 μL,2.5 mmol/L dNTPs 4 μL,ddH2O 36 μL,总体积50 μL。PCR的反应条件为:94 ℃预变性2 min;94 ℃变性30 s,51 ℃退火30 s,72 ℃延伸30 s,从变性到延伸30个循环;72 ℃延伸5 min,4 ℃保存。采用2%琼脂糖凝胶电泳检测PCR产物。参考试剂盒说明书,将PCR产物连接至pEASY-T1载体,转化大肠杆菌Trans1-T1感受态细胞。挑选阳性重组子,37 ℃,200 r/min培养16~18 h后,提取质粒,送交生工生物工程(上海)股份有限公司进行测序。将测序结果用NCBI在线BLAST软件与GenBank中已知的细菌16S rDNA基因序列进行同源性比较,选择近缘菌株的16S rDNA基因序列,用MEGA X软件构建系统发育树。
1.2.5 乳酸菌的抗氧化活性测定 挑取分离鉴定出的乳酸菌单菌落于5 mL M17液体培养基中,37 ℃,厌氧培养24 h。8000×g离心20 min,收集培养上清液,转移至新离心管中。将上述步骤离心的菌体沉淀用PBS缓冲液(pH7.4,5 mL)重悬,4 ℃,8000×g离心20 min,取沉淀,重复操作3次。之后将菌体重悬于等体积 PBS缓冲液中,50 Hz冰浴超声波破碎细胞10 min,之后4 ℃,8000×g,离心30 min,收集上清液即为菌体裂解液。离心后的菌体沉淀经PBS缓冲液(pH7.4,5 mL)洗涤,4 ℃,8000×g离心20 min,重复3次。用等体积的PBS缓冲液使菌体重悬,制备为菌体PBS重悬液。
乳酸菌总抗氧化能力根据总抗氧化能力(T-AOC)检测试剂盒的说明书进行。DPPH自由基清除率和羟自由基清除率的测定方法参考文献[11]。DPPH自由基清除率的测定:取0.5 mL样品,加入浓度为0.2 mmol/L的DPPH无水乙醇溶液1 mL,混匀用锡箔纸包裹试剂管在室温下避光反应30 min,并在10000×g离心1 min,取上清液在517 nm波长处测定吸光度。空白组以等体积无水乙醇代替DPPH溶液,对照组以等体积蒸馏水代替样品溶液。DPPH自由基清除率计算见式(1);
式(1)
式中:A0为对照组吸光度;Ai为样品组吸光度;Aj为空白组吸光度。
羟自由基清除率的测定:取邻菲啰啉(0.75 mmol/L)1 mL于试管中,依次加入PBS(pH7.4)2 mL,蒸馏水1 mL,充分混匀后,加入FeSO4溶液(2.5 mmol/L)1 mL,混匀加H2O2(质量分数为0.12%)l mL,在37 ℃水浴1.5 h后,在536 nm波长处测定其吸光度Ap;用1 mL蒸馏水代替1 mL H2O2测定其吸光度Ab;用1 mL样品代替1 mL的蒸馏水测定其吸光度As。羟自由基清除率计算见式(2)
式(2)
1.3 数据统计与分析
测定结果均表示为3次平行实验的平均值±标准偏差(SEM)。试验结果采用SPSS 20.0的一般线性模型进行两因素方差分析,采用Duncan’s方法进行组间的多重比较,差异显著性水平设置为0.05。
2 结果与分析
2.1 牦牛酸奶样品的pH和乳酸菌菌落计数结果
牦牛酸奶样品的pH及主要菌落数量结果见表1。由菌落计数的结果可知,在本实验的牦牛酸奶样品中,乳酸菌占总菌的比例为14.02%。

表1 牦牛酸奶样品的pH与乳酸菌菌落计数结果
2.2 乳酸菌的形态学鉴定结果
图1为分离得到乳酸菌X1的形态及革兰氏染色结果。由图1可知,从加钙的M17培养基中分离出1株能够产生溶钙圈的乳酸菌X1,挑单菌落于M17液体培养基中过夜培养并制备涂片,在100倍油镜下观察发现,菌株X1呈现球菌形态,一般为单个菌体散在或多个菌体聚集(图1a),革兰氏染色为蓝紫色,是革兰氏阳性菌(图1b)。在M17琼脂培养基上培养18~24 h,X1能够形成较大的圆形菌落,直径约1~2 mm,表面突起且光滑(图1c)。
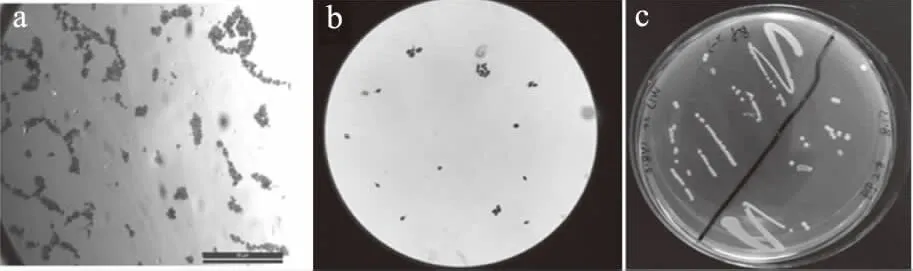
图1 乳酸菌X1菌落的形态
2.3 乳酸菌的产酸试验与生化反应试验结果
表2为乳酸菌X1的产酸试验与生化反应试验结果。由表2可知,产酸试验后乳酸菌培养液的pH为4.24,呈现弱酸性,说明菌株X1具备产酸特性。而过氧化氢酶反应结果为阴性,也进一步说明菌株X1为乳酸菌。通过生化反应试剂盒对乳酸菌X1与参考菌株G2做了11种底物的生化反应鉴定,结果发现乳酸菌X1对七叶苷、纤维二糖、麦芽糖、甘露醇、水杨苷、棉子糖和乳糖共7种底物反应为阳性。对照《常见细菌系统鉴定手册》,菌株X1表现为屎肠球菌生化反应特征,并且与参考菌株屎肠球菌G2的生化反应结果一致,提示菌株X1可能是一种屎肠球菌。
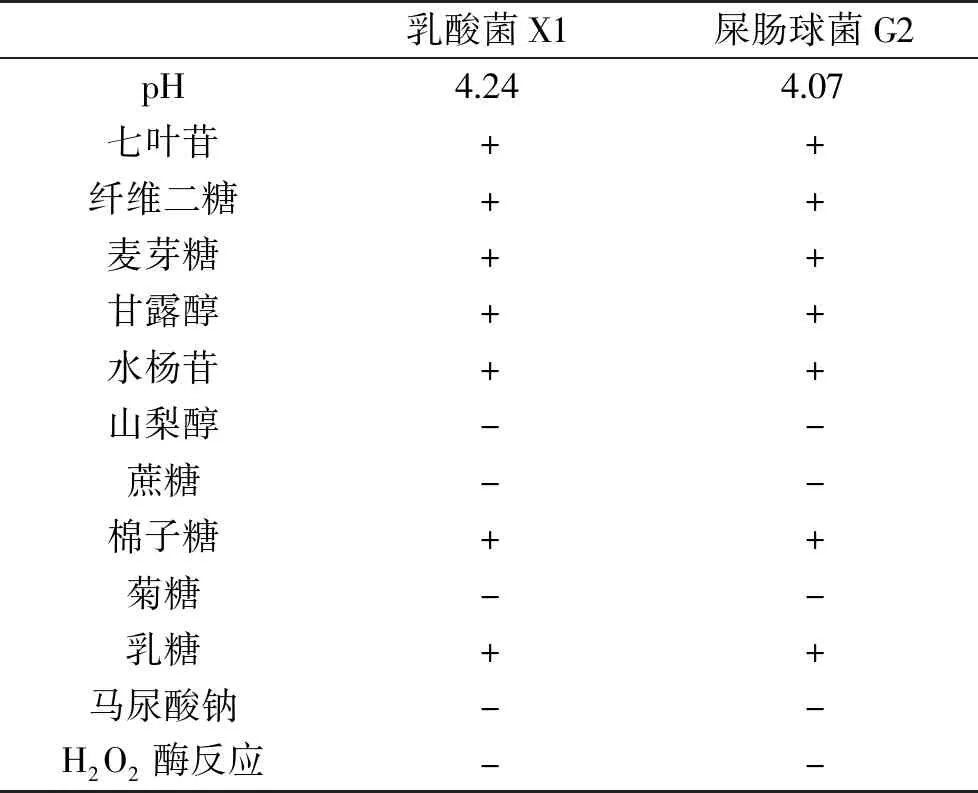
表2 产酸试验与生化反应试验结果
2.4 乳酸菌的16S rDNA的分子鉴定结果
乳酸菌X1的PCR扩增结果见图2。由图2可知,利用细菌通用引物对乳酸菌X1的16S rDNA基因进行PCR扩增,获得片段大小约1500 bp的单一、清晰条带。经克隆测序得到长度为1524 bp的X1菌株16S rDNA序列。经BLAST比对,目的条带与屎肠球菌DSM 20477(NR_114742.1)、屎肠球菌LMG11423(NR_042054.1)、海氏肠球菌ATCC 9790(NR_075022.1)以及杜氏肠球菌98D(NR_036922.1)的同源性均达到了99%。
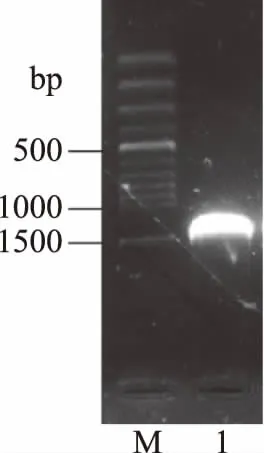
图2 16S rDNA扩增片段的2%琼脂糖凝胶电泳结果
利用MEGAX软件构建系统发育树,结果见图3,由系统发育树可知,乳酸菌X1与屎肠球菌DSM20477同属一个分支,亲缘关系最近,与形态学及生化反应鉴定结果一致,由此可以确定将菌株X1归属于屎肠球菌,命名为屎肠球菌X1(EnterococcusfaeciumX1)。
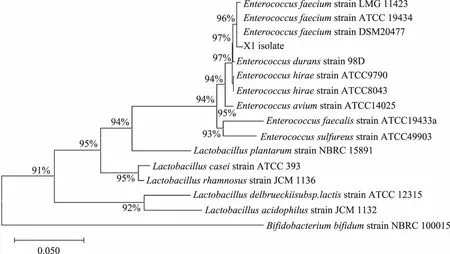
图3 乳酸菌X1基于16S rDNA的系统发育树
2.5 乳酸菌的抗氧化活性测定结果
2.5.1 乳酸菌总抗氧化能力 乳酸菌总抗氧化能力测定结果见图4。由图4可知,不同组分之间总抗氧化能力差异明显,菌株和菌液组分之间存在互作效应(P=0.024)。乳酸菌X1和参考菌株G2各自的培养上清液的总抗氧化能力均显著高于对应的菌体裂解液和重悬液(P<0.05),两种菌株的上清液总抗氧化能力都大于0.8 mmol/L(菌株X1为0.86 mmol/L,菌株G2为0.85 mmol/L)。菌株X1与G2相比,菌体裂解液的总抗氧化能力差异显著(P<0.05)。
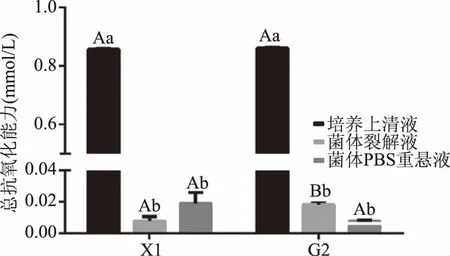
图4 总抗氧化能力的测定结果
2.5.2 DPPH自由基清除能力 乳酸菌X1对DPPH自由基清除能力的测定结果见图5。由图5可知,不同组分之间对DPPH自由基的清除能力差异显著(P<0.05),菌株和菌液组分之间存在互作效应(P=0.001)。菌株X1和参考菌株G2培养基上清液对DPPH自由基清除率最强,均高于60%,两种菌株培养上清液的DPPH自由基清除率均显著高于其对应的菌体裂解液和菌体PBS重悬液(P<0.05),说明乳酸菌X1的抗氧化组分主要存在于菌体培养液中。此外,菌体PBS悬液的DPPH自由基清除率显著高于菌体裂解液(P<0.05),菌体裂解液对DPPH自由基的清除率最低,均低于20%。菌株X1与G2相比,培养上清液与菌体PBS重悬液对DPPH自由基清除能力存在显著差异(P<0.05)。
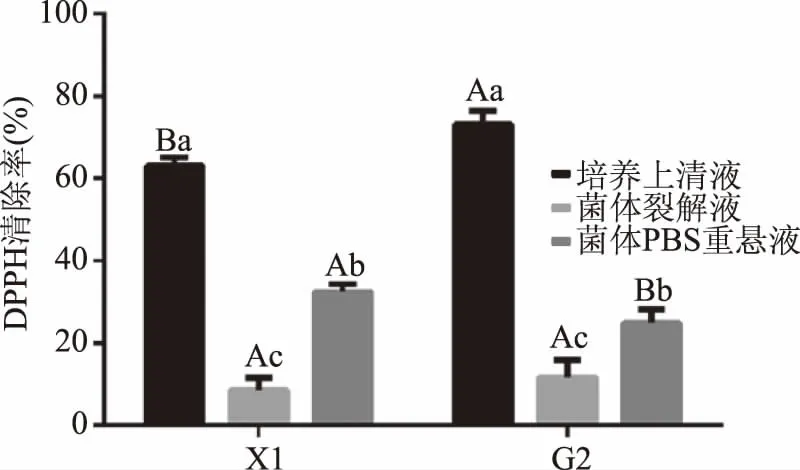
图5 DPPH自由基清除率的测定结果
2.5.3 羟自由基清除能力 乳酸菌X1对羟自由基清除能力的测定结果见图6。由图6可知,不同组分之间对羟自由基的清除能力差异明显,菌株和菌液组分之间存在互作效应(P=0.004)。菌株X1和参考菌株G2的菌体PBS重悬液对羟自由基清除率最强,均大于95%。菌株X1和G2的菌体PBS重悬液对羟自由基的清除率均显著高于培养上清液与菌体裂解液(P<0.05)。菌株X1与参考菌株G2的菌体裂解液羟自由基的清除率存在显著差异(P<0.05)。
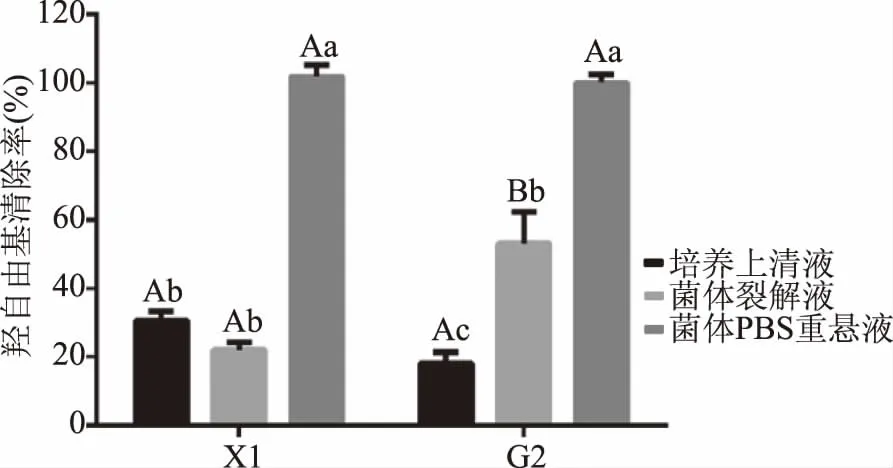
图6 羟自由基清除率的测定结果
3 讨论与结论
中国约有1300万头牦牛,约占世界牦牛总数的94%,牦牛数量、牦牛奶及其奶制品产量均居世界首位[16]。传统发酵牦牛酸奶是乳酸菌的良好来源,如西藏地区牦牛发酵酸奶中乳酸菌活菌数量为6.76~9.37 lg CFU/mL,大部分样品乳酸活菌数在108CFU/mL以上[17],甘肃和四川地区传统发酵牦牛奶制品乳酸菌活菌数变化范围在4.00~9.15 lg CFU/mL,大多数样品乳酸菌数在6.00 lg CFU/mL以上[18]。本研究分析了来自于四川甘孜州的发酵牦牛酸奶样品,发现乳酸菌数量在1.81×108~2.65×108CFU/mL,与西藏地区牦牛酸奶中乳酸菌含量接近,也高于国家卫生标准GB 16321-2003中判定标准(酸奶中的乳酸菌数≥1×106CFU/mL)。此外,很多报道证实牦牛发酵酸奶中的乳酸菌种类丰富,如吴均[10]从发酵酸牦牛乳中筛选出2株坚忍肠球菌和1株干酪乳杆菌,陈明等[11]从牦牛酸奶中筛选出1株植物乳杆菌XM5,张俊等[19]从牦牛酸奶中筛选出了副干酪乳杆菌优势菌株等,上述研究结果说明牦牛酸奶中具有丰富的可供利用的乳酸菌资源。
屎肠球菌是一类获得我国农业部、欧盟和联合国粮农组织批准使用的饲料添加剂,可以作为一种安全的微生态制剂应用于畜禽饲料,且在一定程度上能够替代饲用抗生素的使用[20-22]。在畜禽日粮中添加屎肠球菌,可以增强动物对不良环境的抵抗力,缓解养殖过程中发生的氧化应激。如丁爽等[23]研究发现饲料中添加屎肠球菌能显著提高28日龄断奶仔猪血清中IgG水平,杨志远等[24]研究也说明屎肠球菌对维持仔猪肠道菌落平衡、促进养分吸收、增强抗病能力等起着重要作用。此外,冯宝宝等[25]的研究还发现屎肠球菌可以有效调节脂代谢和能量代谢,增强机体的抗氧化性能,胡真真等[26]研究表明屎肠球菌具有改善肉鸡小肠绒毛发育及活性,提高肉鸡生长性能的作用。因此,探索牦牛酸奶来源屎肠球菌的体外抗氧化功能,将其开发为一种天然安全的微生态制剂,在畜禽养殖业中具有广泛的应用前景。
抗氧化的一个重要机理是清除自由基。动物体内的自由基是机体正常的代谢产物,正常情况下处于不断产生与清除的动态平衡中,但如果自由基的数量过多,会破坏细胞结构,引起脂质过氧化,造成氧化应激[27]。常用于评价抗氧化性能的指标有乳酸菌总抗氧化能力、超氧阴离子自由基清除能力、DPPH自由基清除能力、羟自由基的清除能力等[28],本实验采用平板培养法,在含有2.5% CaCO3的M17培养基上分离出一株乳酸菌,通过16S rDNA分子鉴定以及乳酸菌生化鉴定,确定菌株X1为屎肠球菌。通过测定乳酸菌总抗氧化能力、DPPH自由基清除能力、羟自由基清除能力,对屎肠球菌X1进行抗氧化活性评价,结果发现屎肠球菌X1的培养上清液、菌体裂解液、菌体PBS重悬液的总抗氧化能力、对DPPH自由基和羟自由基的清除率存在差异。屎肠球菌X1培养上清液对DPPH自由基的清除率达到63.07%,高于吴贝等[29]研究的华中农业大学屎肠球菌HDRsEf1(56.5%)。屎肠球菌X1菌体裂解液对DPPH自由基的清除率相对较低(8.61%),但高于巩蕾等[30]研究的屎肠球菌JT1菌体裂解液对DPPH自由基的清除率(8.281%),并且与HDRsEf1菌株菌体裂解液对DPPH自由基无清除作用相比,屎肠球菌X1的菌体和培养上清都具有一定的利用价值。屎肠球菌X1菌悬液对DPPH自由基的清除率处于培养上清液与菌体裂解液之间,但其对羟自由基的清除率大于90%,与吴贝等研究的华中农业大学屎肠球菌HDRsEf1专利菌株相当(94.9%),高于巩蕾等研究的屎肠球菌JT1菌悬液对DPPH自由基的清除率(23.873%)。菌悬液对羟自由基的清除率较高可能原因为,菌体重悬液中的活细胞会持续分泌抗氧化物质,或其细胞膜上附着一些因子会增强对羟自由基的消除能力。综合来看,屎肠球菌X1的抗氧化物质主要存在于菌体培养上清液即其菌体胞外代谢产物中,与王曦等的研究结果类似[31],可能与特定乳酸菌菌株不同的组分具有相对独立的抗氧化机制有关[32],菌株X1的具体抗氧化活性成分及其抗氧化机理还未知,有待于进一步深入研究讨论。
综上所述,本研究揭示了发酵牦牛酸奶来源的屎肠球菌X1具有较好的抗氧化活性,其乳酸菌总抗氧化活性以及DPPH自由基清除活性物质主要存在于菌体培养液上清中,这为进一步将其开发为抗氧化微生态制剂,并在畜禽生产中应用提供了理论基础。
