益生菌对2型糖尿病小鼠的调节作用
2020-10-23吕优优张峻雪易华西刘同杰公丕民冯丽荣冷友斌张兰威
白 璐,张 喆,梁 曦,吕优优,周 慧,张峻雪,易华西,刘同杰,公丕民,冯丽荣,冷友斌,*,张兰威,*
(1.中国海洋大学食品科学与工程学院,山东青岛 266000;2.中国飞鹤有限公司,北京 100015)
糖尿病是一种常见的内分泌代谢性疾病,其中2型糖尿病占糖尿病病例的90%~95%[1]。此外,2型糖尿病还会引发许多并发症,例如糖尿病肾病、心血管疾病、动脉硬化和高血压等,甚至引起死亡。目前,全球成年人群中2型糖尿病的患病率已达到8.3%。人口老龄化以及饮食结构变化加剧糖尿病人数量增加,在我国每年有130万人死于糖尿病及其并发症[2]。
越来越多的证据表明,2型糖尿病的病因除了肥胖、遗传、胰岛素自身功能不全外,还与宿主的肠道菌群密切相关[3]。与正常人群相比,2型糖尿病患者表现出中度微生物菌群失调现象[4],拟杆菌丰度下降,机会致病菌丰度增加,引起葡萄糖糖耐量、血糖等指标的改变,加快2型糖尿病的进程[5]。因此,保持体内微生物平衡,有利于机体保持正常的代谢、维持良好的免疫功能预防疾病的发生发展[6]。乳杆菌和双歧杆菌、丁酸芽孢杆菌等是肠道微生物内一类具有活性的特殊的益生菌群[7],研究发现补充这些有益菌,可增加肠道内有益菌、减少有害菌、改变肠道微生物结构,从而展示出预防和治疗糖尿病潜力[8],益生菌可以通过增加粘蛋白水平改善肠道屏障功能[9]、增加抗炎症因子调节免疫炎症反应[10],通过降低胆固醇水平改善胰岛素抵抗,通过减轻氧化应激水平减轻组织损伤[11]等途径改善糖尿病。然而,不同菌株作用效果有差异,菌株间相互作用效果也不同,菌株如何发挥益生作用及其作用靶点等相关机制都有待于进一步揭示。
本文首先以α-葡萄糖苷酶活性、疏水性和自聚性为指标,从34株益生菌中筛选出具有潜在降糖功效和黏附能力的菌株;通过高脂饮食结合链脲佐菌素(streptozocin,STZ)构建2型糖尿病小鼠模型,研究膳食补充益生菌对抗糖尿病的作用效果。
1 材料与方法
1.1 材料与仪器
供试益生菌 中国海洋大学功能性乳品与益生菌工程实验室保藏的34株益生菌[12];鼠李糖乳杆菌LGG(ATCC 53103) ATCC公司;SPF级C57BL/6J雄性6周龄小鼠 济南朋悦实验动物有限公司,许可证号为SCXK(鲁)20140007;STZ 西格玛奥德里奇贸易有限公司;α-葡萄糖苷酶(50 U/mg prot)、对硝基苯基-α-D-吡喃葡萄糖苷(PNPG) 上海源叶生物科技有限公司;阿卡波糖 拜尔医药保健有限公司;葡萄糖试剂盒(京食药监械(准)字2014第2401130号) 中生北控生物科技股份有限公司;糖化血红蛋白试剂盒(A056-1-1)、胰岛素ELISA试剂盒(H203)、肿瘤坏死因子-αELISA试剂盒(H052)、白介素-6 ELISA试剂盒(H007) 南京建成生物工程研究所;碳酸钠、二甲苯、乙醚、柠檬酸钠、葡萄糖 国药集团化学试剂有限公司;Man Rogosa Sharp(MRS)培养基 青岛海博生物技术有限公司;普通饲料、高脂饲料 均由本实验室自制,普通饲料脂肪含量10%,高脂饲料脂肪含量40%;二乙基丁酸 上海阿拉丁生化科技股份有限公司;乙酸、丁酸、丙酸标准品 德国Dr.Ehrensorfer标准品公司。
LRH-250生化培养箱 上海一恒仪器有限公司;Multiskan FC酶标仪 赛默飞世尔科技公司;TG20KR-D高速冷冻离心机 长沙东旺实验仪器有限公司;YP202N电子天平 上海精科仪器有限公司;DK-98-ⅡA恒温水浴锅 天津市泰斯特仪器有限公司;GC6890气相色谱仪 安捷伦科技有限公司;GA-3血糖仪 三诺生物传感有限公司。
1.2 实验方法
1.2.1 实验菌株 实验菌株接种于MRS培养基,于37 ℃培养18 h,离心(8000 r/min,10 min,4 ℃)收集菌体,并用PBS(pH7.4)缓冲液洗涤3次,最终重悬于PBS(pH7.4)中,调节菌液浓度为1×109CFU/mL。其中鼠李糖乳杆菌LGG为商业菌株,已证实其在体内具有降糖作用[13],本研究以其作为阳性对照菌株。
1.2.2 降糖益生菌的体外筛选
1.2.2.1 益生菌对α-葡萄糖苷酶抑制率的测定 通过α-葡萄糖苷酶抑制率进行益生菌降糖功能筛选。按王芬等[14]方法测定益生菌对α-葡萄糖苷酶的抑制率。α-葡萄糖苷酶(50 μL,0.1 U/mL)与25 μL益生菌菌悬液(在0.1 mmol/L的PBS(pH6.8)中配制),并在37 ℃下孵育10 min。再加入0.1 mmol/L的PBS中配制的PNPG(25 μL,20 mmol/L)以引发反应,并将混合物在37 ℃下水浴20 min,最后加入Na2CO3(100 μL,20 mmol/L)终止反应,OD405 nm下测定反应吸光值。鼠李糖乳杆菌LGG为阳性对照组,按式(1)进行计算。
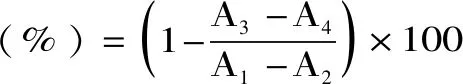
式(1)
式中:A1为只含有酶的吸光度;A2为PBS吸光度;A3为含有酶和样品的吸光度;A4为只含有样品的吸光度。
1.2.2.2 益生菌疏水性、自聚性测定 通过疏水性能和自聚性能对具有良好α-葡萄糖苷酶抑制率的菌株进行自身特性评价。鼠李糖乳杆菌LGG为阳性对照组。根据Amany等[15]MATH法测定菌株的表面疏水性。将培养好的菌株离心(4000 r/min,5 min,4 ℃)收集菌体,用PBS(pH7.4)缓冲液洗涤2次。将收集好的菌体重悬于PBS(pH7.4)中,OD400 nm下调节菌悬液吸光度至0.4左右,记为A0。取3 mL菌液与1 mL二甲苯混合,将混合液涡旋30 s后室温静置30 min,在OD600 nm下测定混合溶液中水相的吸光值,记录为Ax。按式(2)计算菌株的表面疏水性。

式(2)
根据Ruth等[16]的方法进行自聚性测定。将过夜培养的菌株离心(4000 r/min,5 min,4 ℃)并收集菌体沉淀物。将沉淀物用PBS(pH7.4)缓冲液洗涤两次并重悬,记录OD600 nm下的吸光值为At0。取菌液4 mL涡旋10 s后在室温下静置3 h。3 h后,将0.1 mL的上层悬浮液加至3.9 mL的PBS(pH7.4)中,在OD600 nm下测定吸光度,记录吸光值为At1。按式(3)计算菌株自聚性。
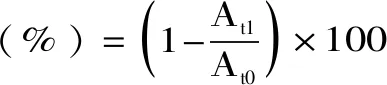
式(3)
1.2.3 体内探究降糖益生菌的效果及作用机制
1.2.3.1 实验动物造模及分组设计 60只雄性C57BL/6J小鼠,采用Manaer等[17]的方法建立2型糖尿病小鼠模型。在整个实验过程中,小鼠饲养于((22±2) ℃,湿度55%±5%,12 h光照/暗循环)的笼子里。所有小鼠适应性喂养一周后,实验设计为:正常组(N):普通饲料喂养小鼠,在第5周的第1 d,正常组小鼠用0.1 mmol/L柠檬酸盐缓冲液(pH4.4)进行腹腔注射。糖尿病组(DM)、阿卡波糖药物治疗组(Acarbose)、LGG治疗组(菌株LGG)、J5治疗组(菌株J5)和K11治疗组(菌株K11)小鼠前4周以高脂饲料喂养,并在第5周的第1 d,按照100 mg/kg·bw的剂量腹腔注射STZ(冰上避光,现配现用,溶解于0.1 mmol/L pH4.2的柠檬酸盐缓冲液中)。在STZ注射的7 d后,测量所有小鼠血糖,小鼠空腹血糖≥7.0 mmol/L或餐后血糖≥11.1 mmol/L认定糖尿病造模成功[18]。从第6~13周开始,小鼠接受普通饲料。从第6周开始至实验结束,所有小鼠每天灌胃一次,阿卡波糖药物治疗组(Acarbose)灌胃100 mg/kg·bw阿卡波糖溶液;益生菌组灌胃10 mL/kg·bw浓度为1×109CFU/mL的菌液;N组与DM组灌胃10 mL/kg·bw的PBS缓冲液(pH7.4)。
1.2.3.2 小鼠血清及组织的处理 第13周(实验结束时),小鼠禁食不禁水12 h后,腹腔注射100 mg/kg·bw的氯胺酮麻醉后,眼球取血,然后脱臼处死。血液在4 ℃下3000 r/min条件下离心10 min,然后用小量程移液枪小心吸取上层液体即为血清,储存在-80 ℃备用。在实验的第13周(实验结束时),收集小鼠粪便,冰上放置,然后迅速转移至-80 ℃冷冻保藏备用。
1.2.3.3 小鼠血糖、口服葡萄糖耐量的测定 小鼠尾尖取血,利用血糖仪每周测定所有小鼠空腹血糖值和餐后2 h血糖值。在实验结束前(第13周),小鼠禁食12 h,测定小鼠灌胃葡萄糖溶液(2 g/kg·bw)后0、30、60、90和120 min的血糖变化[19]。根据血糖值绘制曲线,软件计算葡萄糖曲线下面积(AUCglucose)。
1.2.3.4 指标检测 用ELISA法按照试剂盒说明书检测小鼠血清中糖化血红蛋白、血清胰岛素、肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)、白细胞介素-6(interleukin-6,IL-6)胰高血糖素样肽-1(glucagon-like peptide-1,GLP-1),并通过酶标仪测定其含量。并按照式(4)计算胰岛素抵抗指标HOMA-IR水平。
式(4)
1.2.3.5 短链脂肪酸的分析 参照Tao等[20]所述方法进行样品前处理。称取0.1 g粪便并加入1200 μL超纯水。搅碎混匀后,加入50 μL的50%的浓硫酸酸化,室温静置5 min,每分钟涡旋一次。随后,4875 r/min离心10 min。收集上清,加入内标二乙基丁酸50 μL和无水乙醚300 μL,充分混匀30 s,5000 r/min离心10 min。最后,取乙醚层5 μL用于气相色谱检测。参照王琳琳[21]等所述方法进行短链脂肪酸分析。采用安捷伦GC6890气相色谱仪检测小鼠粪便中短链脂肪酸含量,所用气相色谱柱为DB-FFAP弹性石英毛细管柱(30 m×0.25 nm×0.2 μm),所用检测器为火焰离子化检测器(FID),上样量为5 μL,不分流,载气为氮气,流速恒定为1 mL/min,设定程序温度和保持时间分别为:初始温度100 ℃,0.5 min;以8℃/min升到180 ℃,1 min;20 ℃/min升至220 ℃,5 min;进样口和检测器均为250 ℃。通过内标法分别计算出乙酸、丙酸、丁酸含量,内标物为二乙基丁酸。
1.3 数据处理
数据结果均用平均值±标准差形式表示,统计分析均使用SPSS 20.0软件进行组间比较,数据采用单因素方差分析(ANOVA)进行组间比较,组间差异检验采用Duncan检验。P<0.05为差异有统计学意义。所有实验均重复3次。
2 结果与分析
2.1 降糖益生菌的体外筛选
2.1.1 益生菌对α-葡萄糖苷酶活性的抑制效果 抑制α-葡萄糖苷酶的活性可延缓或阻碍碳水化合物的代谢,预防餐后高血糖的发生,该酶抑制率通常作为体外筛选降糖物质的指标[22]。通过α-葡萄糖苷酶抑制率评估菌株的降糖功能,实验结果如表1所示,在35株益生菌中,9株菌株可以有效抑制α-葡萄糖苷酶活性,抑制率在5.66%~17.14%之间,其中K11、J5、G15和K14这4株乳杆菌抑制率较高(分别为15.92%±3.40%、13.05%±3.17%、10.78%±2.68%和9.54%±6.61%),该4株菌株对α-葡萄糖苷酶的抑制活性均可达到阳性对照菌株LGG抑制活性的50%[13];其余菌株未检测到对α-葡萄糖苷酶的抑制作用。
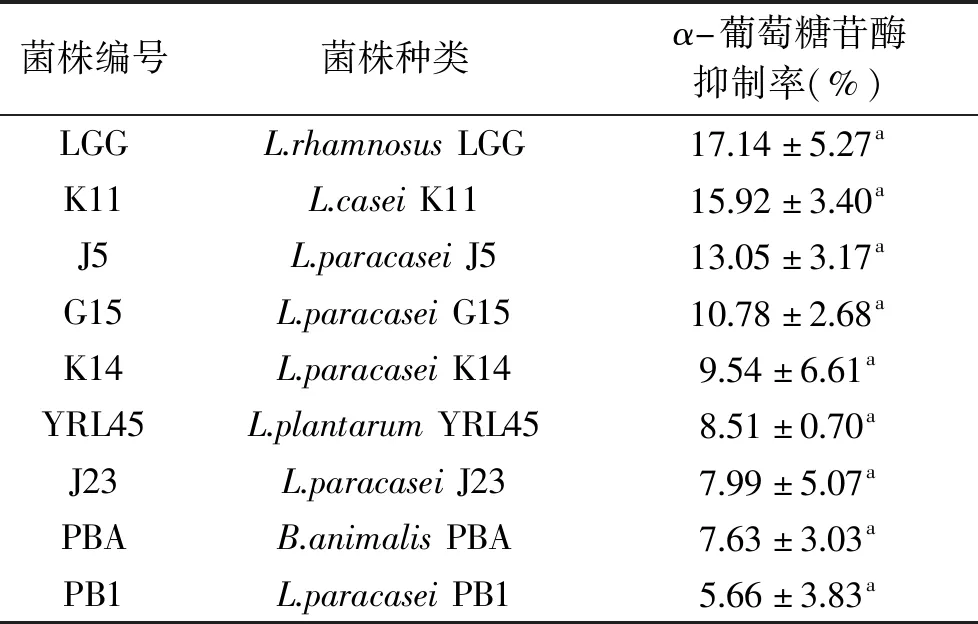
表1 益生菌对α-葡萄糖苷酶的抑制率
2.1.2 益生菌疏水性能和自聚性能 益生菌只有黏附并定殖于肠上皮才能发挥功效,菌株的定殖黏附能力越好,其发挥功效的可能性越大。疏水性和自聚性常用于衡量菌株体外黏附能力。在通过α-葡萄糖苷酶抑制率筛选出9株具有潜在降糖功能益生菌的基础上,测定其疏水性和自聚性能,一般认为,益生菌表面疏水性在20%以上,则具有黏附能力;自聚性小于10%,则认为没有自聚性能[23-24]。实验结果如图1所示,G15、J5、K11、YRL45和J23这5株乳杆菌的疏水性均大于20%;在这5株表面疏水性能良好的菌株中G15没有检测到自聚性能。结合益生菌对α-葡萄糖苷酶的抑制率,菌株J5、K11和G15具有良好的α-葡萄糖苷酶抑制活性。体外筛选出具有良好降糖能力与益生特性的菌株为:副干酪乳杆菌J5和干酪乳杆菌K11。

图1 菌株表面疏水性和自聚能力的比较
2.2 体内探究降糖益生菌的效果及作用机制
2.2.1 补充益生菌对空腹血糖和餐后血糖的影响 空腹血糖≥7.0 mmol/L是糖尿病检测最常用的指标[18]。空腹血糖结果如图2A所示,注射STZ后,造模组小鼠的空腹血糖值≥7.0 mmol/L,造模成功。在第5周到第13周期间,DM组空腹血糖水平显著高于N组(P<0.05)。在实验的第13周末,与DM组相比,所有组均显著降低了小鼠的空腹血糖水平(P<0.05),补充干酪乳杆菌K11和副干酪乳杆菌J5将小鼠空腹血糖降低了37.62%和31.38%(P<0.05),与LGG组不存在显著性差异。餐后血糖代表葡萄糖负荷后的血糖水平,餐后血糖≥11.1 mmol/L是早期诊断糖尿病的重要指标[18]。餐后血糖结果如图2B所示,在实验的第13周末,与DM组相比,所有组均能显著降低小鼠的餐后血糖水平(P<0.05),其中效果最好的为K11组,补充干酪乳杆菌K11将餐后血糖降低了36.36%(P<0.05),与Acarbose组和LGG组不存在显著性差异(P>0.05)。这些结果表明,干酪乳杆菌K11能缓解糖尿病小鼠的高血糖状态。
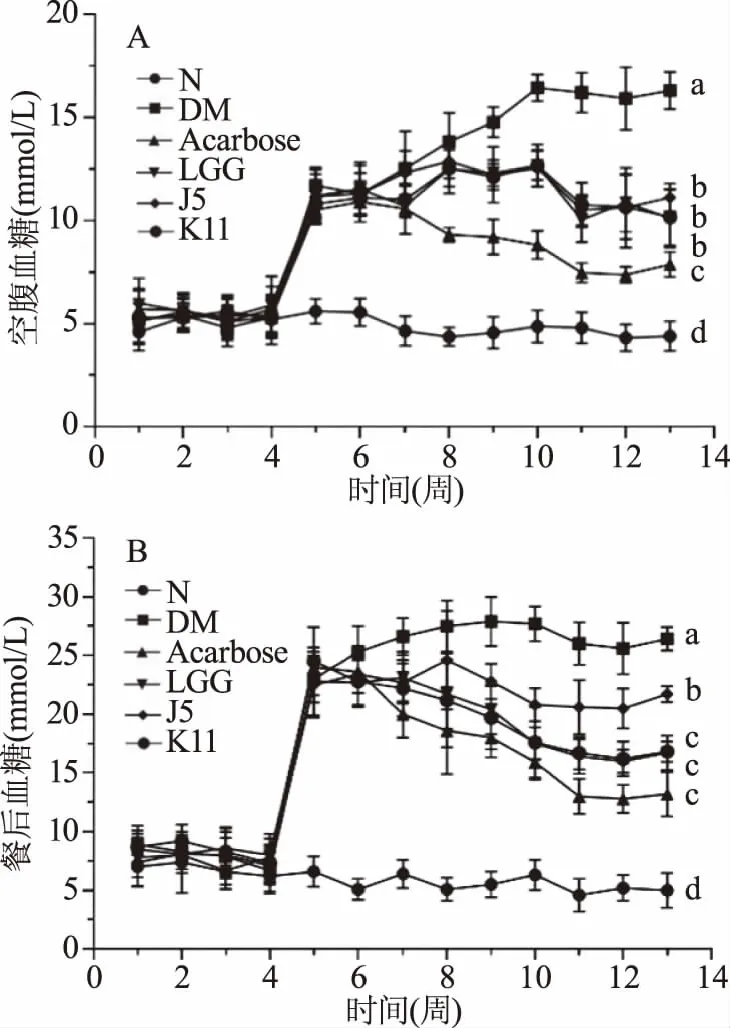
图2 实验期间小鼠血糖水平变化
2.2.2 补充益生菌对小鼠口服葡萄糖耐量的影响 口服葡萄糖耐量实验(OGTT)是一种葡萄糖负荷实验,以衡量胰岛β细胞功能状况以及机体对于血糖的调节能力[25]。在实验的第13周末进行OGTT实验,结果如图3A所示,糖尿病小鼠在口服葡萄糖溶液30 min内血糖迅速上升,并在接下来的90 min内缓慢下降,所有时间点内DM组的血糖值均高于N组(P<0.05)。根据口服葡萄糖耐量曲线,利用软件计算葡萄糖曲线下的面积(AUCglucose)并绘制柱状图。AUCglucose数值越大,证明机体糖耐量受损越严重。实验结果如图3B所示,与DM组相比,K11组AUCglucose显著下降了22.72%(P<0.05)。这些结果表明,补充干酪乳杆菌K11能够有效缓解2型糖尿病小鼠的糖耐量受损症状。

图3 益生菌对小鼠OGTT(A)和AUCglucose(B)的影响
2.2.3 补充益生菌对小鼠糖化血红蛋白、胰岛素水平以及胰岛素抵抗的影响 血红蛋白与葡萄糖经过缓慢不可逆的结合生成糖化血红蛋白,与血糖高低密切相关。结果如图4A所示,与DM组相比,干酪乳杆菌K11缓解由糖尿病带来的糖化血红蛋白升高效果最好(P<0.05),可将糖化血红蛋白水平降低18.84%,显著优于LGG组(P<0.05)。在2型糖尿病患者体内,胰岛素水平增高却无法发挥有效作用,即胰岛素抵抗。如图4B所示,DM组小鼠胰岛素分泌水平显著高于N组(69.83%)(P<0.05);K11、LGG、J5组均能够显著降低胰岛素水平,但各组间不存在显著性差异(P>0.05);HOMA-IR指数是衡量机体胰岛素抵抗水平的指标,如图4C所示,DM组小鼠HOMA-IR指数显著增高(P<0.05);其中补充干酪乳杆菌K11可将HOMA-IR指数显著降低37.57%(P<0.05),效果与LGG组不存在显著性差异,但不及Acarbose组(P<0.05)。这一结果表明,补充干酪乳杆菌K11能够较好的缓解由2型糖尿病带来的胰岛素抵抗(P<0.05)。

图4 益生菌对小鼠糖化血红蛋白(A)、血清胰岛素水平(B)和胰岛素抵抗(C)的影响
2.2.4 补充益生菌对小鼠炎症因子的影响 炎症因子状态在2型糖尿病的发病过程中也起着非常重要的作用,TNF-α引起胰岛素抵抗,而IL-6会对胰岛细胞产生毒害作用,进而加快糖尿病的进程[26]。如图5所示,2型糖尿病显著增加了小鼠血清内TNF-α水平(47.15%)(P<0.05),其中补充干酪乳杆菌K11可将小鼠血清内TNF-α水平显著降低9.70%(P<0.05),但效果不及LGG组和Acarbose组;与此同时,DM组小鼠体内IL-6水平显著升高(73.36%)(P<0.05),补充干酪乳杆菌K11能够显著降低由2型糖尿病带来的IL-6水平升高(P<0.05),K11组可将小鼠血清内的IL-6水平降低18.54%(P<0.05),效果与LGG组和Acarbose组不存在显著性差异(P>0.05)。这一结果表明,干酪乳杆菌K11对降低TNF-α和IL-6含量效果最为显著(P<0.05)。

图5 益生菌对小鼠促炎因子水平的影响
2.2.5 补充益生菌对小鼠GLP-1分泌的影响 肠道菌群产生的关键信号分子短链脂肪酸与G蛋白偶联受体GRP43(也被称为FFAR2)结合,随后诱导GLP-1的分泌,GLP-1对胰岛素的合成和释放以及β细胞增殖具有实质性影响,并能改善胰岛素敏感性[27]。如图6所示,与N组相比,DM组GLP-1水平显著降低(P<0.05);补充干酪乳杆菌K11将GLP-1水平显著增加了38.48%(P<0.05),与LGG组(38.80%)不存在显著差异(P>0.05)。综合上述全部生化指标,K11组展示出了较强的作用,因此,确定K11组为研究对象测定其粪便中短链脂肪酸含量。

图6 益生菌对小鼠血清GLP-1的影响
2.2.6 补充益生菌对小鼠粪便中短链脂肪酸水平的影响 短链脂肪酸是肠道菌群的主要产物,主要由乙酸、丙酸和丁酸组成。短链脂肪酸除了可以为宿主提供能量外,还具有调节机体葡萄糖稳态的作用[28]。2型糖尿病会导致机体粪便短链脂肪酸含量降低,引起肠道微生物代谢活性的改变和肠道菌群生态失调[29]。实验结果如图7所示,与N组相比,糖尿病小鼠粪便中乙酸、丙酸以及丁酸含量显著降低(P<0.05)。K11组能够显著改善由2型糖尿病带来的短链脂肪酸降低,与DM组相比,补充干酪乳杆菌K11可分别将乙酸、丙酸、丁酸水平提升69.61%、16.07%以及52.69%,与LGG组不存在显著性差异(P>0.05)。由以上结果可知,干酪乳杆菌K11对提升糖尿病小鼠粪便中短链脂肪酸含量效果显著(P<0.05)。短链脂肪酸可与FFAR2和FFAR3受体结合,促进GLP-1的释放,最终发挥调控血糖的作用[30]。

图7 益生菌对小鼠粪便中短链脂肪酸的影响
3 讨论
2型糖尿病及其并发症的发病率不断增高,严重影响着人们的生活质量[31]。2型糖尿病的典型特征就是血糖异常和胰岛素抵抗。胰岛素抵抗引起的血糖异常往往会导致一系列的健康问题。因此,稳定血糖和改善胰岛素抵抗是糖尿病治疗和预防中最重要的环节。近来研究表明肠道微生物,特别是益生菌对防治糖尿病起到重要作用,但其机制尚不完全明确[32]。因此,本研究通过体外筛选出功能性益生菌,并在体内评价益生菌对2型糖尿病小鼠模型的降糖作用及缓解胰岛素抵抗的效果。
α-葡萄糖苷酶抑制剂作为治疗糖尿病的一大类药物,可以有效地减少餐后高血糖的发生[33]。已有研究表明,鼠李糖乳杆菌、干酪乳杆菌、保加利亚乳杆菌以及双歧杆菌等对α-葡萄糖苷酶有着良好的抑制效果[14]。本文采用以α-葡萄糖苷酶为指标衡量菌株的功能特性,以菌株的黏附能力衡量其自身特性,从多株益生菌中筛选与降低血糖相关的菌株。本研究确定,在34株供试菌中K11、J5和G15这3株乳杆菌表现出了与鼠李糖乳杆菌LGG相同的良好抑制α-葡萄糖苷酶的能力。菌株的黏附能力是益生菌发挥其功效的重要前提,菌株的疏水性和自聚性与细胞黏附特性密切相关,是衡量其体外黏附能力的常用指标[22]。目前,以疏水性和自聚性作为筛选指标衡量益生菌的性能已得到普遍认可。本研究发现,干酪乳杆菌K11有着良好的疏水性和自聚性能,副干酪乳杆菌J5有着良好的疏水性,但自聚性较弱。阳性对照菌株LGG表面疏水能力较弱,这会阻碍其在肠道中定殖及持续发挥作用,这可能也是每天需要补充益生菌一次甚至更多次才有效的原因。另外,已有研究报道益生菌发挥作用与其菌体成分有关,不是活菌也会产生功能性[34]。杜兰兰等在研究益生菌黏附特性时发现,类植物乳杆菌L-ZS9疏水性和黏附性均优于LGG,这与本研究研究相一致[35]。结合对α-葡萄糖苷酶的抑制作用,选取干酪乳杆菌K11和副干酪乳杆菌J5作为目标降糖菌株,选取鼠李糖乳杆菌LGG为阳性对照菌株进行后续降糖作用机制的研究。
2型糖尿病是一种以血糖升高、胰岛素抵抗为特征的慢性代谢疾病[36],补充益生菌可以抑制患者或小鼠的血糖升高。在本研究中补充干酪乳杆菌K11和副干酪乳杆菌J5能够显著降低2型糖尿病小鼠的空腹血糖和餐后血糖,这可能是菌株能够增加葡萄糖的利用,从而抑制了餐后高血糖的发展[19]。糖化血红蛋白是用来反应一定时间内血糖水平的重要指标,因为它与葡萄糖分子和红细胞中的血红蛋白的缓慢、不可逆的结合有关[37]。补充干酪乳杆菌K11和副干酪乳杆菌J5可以有效降低糖化血红蛋白含量,证明其对血糖的调节能力是较为持久的。以上这些研究表明,补充益生菌可以通过降低空腹血糖、餐后血糖水平以及糖化血红蛋白含量来改善2型糖尿病血糖控制情况,其中干酪乳杆菌K11的功效强于副干酪乳杆菌 J5。2型糖尿病患者体内胰岛素水平增高,但由于无法发挥正常功效而产生胰岛素抵抗状态,常用HOMA-IR指数衡量胰岛素抵抗水平。Hu等[38]研究发现,补充益生菌可以降低糖尿病患者胰岛素水平以及HOMA-IR指数,减轻胰岛素抵抗状态。这些研究结果表明,益生菌对于血糖调节的有益功效,可能是基于改善胰岛素抵抗状态来实现的;本研究发现,补充干酪乳杆菌K11对改善糖尿病小鼠的糖耐量受损有着良好的功效。2型糖尿病小鼠的空腹胰岛素水平以及HOMA-IR指数综合衡量了机体的胰岛素抵抗状态,干酪乳杆菌K11可以恢复糖尿病带来的胰岛素水平升高和胰岛素抵抗状态。
短链脂肪酸是肠道内微生物重要代谢产物之一,在2型糖尿病小鼠体内短链脂肪酸含量的降低会导致葡萄糖代谢紊乱并加剧胰岛素抵抗状态[39]。本研究发现,补充干酪乳杆菌K11显著增加了糖尿病小鼠粪便中乙酸、丙酸以及丁酸含量。益生菌可以通过促进短链脂肪酸的产生,进而对L细胞上G蛋白偶联受体FFAR2和FFAR3进行激活,促进GLP-1的释放[40],降低炎症因子最终改善胰岛素抵抗和高血糖状态[41]。GLP-1是一种参与葡萄糖稳态的肠促胰岛素激素,干酪乳杆菌K11作为一种新型的α-葡萄糖苷酶抑制剂能够显著增加小鼠血清内GLP-1的含量。同时,短链脂肪酸还可以降低炎症因子的水平,最终改善胰岛素抵抗[42],已有研究表明短链脂肪酸含量的增加可以通过激活FFAR2和FFAR3受体,进而刺激GLP-1的分泌,基于短链脂肪酸-G蛋白偶联受体-GLP-1这一途径,改善了糖尿病小鼠的炎症状态,最终达到降低糖尿病小鼠的血糖、改善胰岛素抵抗的功效。
4 结论
本研究通过α-葡萄糖苷酶抑制率、表面疏水性和自聚能力指标筛选出具有潜在降糖功效和良好肠道黏附能力的干酪乳杆菌K11和副干酪乳杆菌J5。通过动物实验研究发现,补充干酪乳杆菌K11可以维持血糖稳定、改善胰岛素分泌、减轻胰岛素抵抗,并可以有效降低糖尿病小鼠血清中炎症因子TNF-α及IL-6水平,最终改善了糖尿病小鼠的糖代谢紊乱,其作用机制可能是通过调节短链脂肪酸含量刺激血糖代谢靶向通路来实现的。未来需进一步研究益生菌是如何调控短链脂肪酸参与改善机体血糖代谢,缓解2型糖尿病的发生发展。
