3种不同溶剂中根皮苷与牛血红蛋白的相互作用及抗氧化性
2020-10-23高义霞周向军
高义霞,杨 艳,周向军
(1.天水师范学院生物工程与技术学院,甘肃天水 741001;2.甘肃省大樱桃工程技术研究中心,甘肃天水 741001)
根皮苷(phlorizin,PHL)是根皮素与2′-β-D-葡萄糖形成的二氢查尔酮苷类化合物[1],富含于苹果、梨、荔枝和多穗柯甜茶等组织的嫩叶、根茎及苹果果实中[2]。研究表明,根皮苷是钠-葡萄糖转运蛋白(SGLTs)的竞争性抑制剂[3],可减轻Ⅲ型糖尿病的胰岛素抵抗,同时也可促进葡萄糖的外排分泌,降低餐后血糖水平而不产生低血糖等副作用,因而对糖尿病及并发症有良好的防治作用。同时,PHL还具有保护心血管[4]、抗病毒[5]、抗感染[6]和抗氧化[7]等多种功能。
光谱法是研究蛋白质与小分子化合物相互作用的主要手段,主要有紫外光谱法、荧光光谱法和红外光谱法等[8]。每种光谱法均有一定局限性,应尽可能结合上述方法进行研究。通过紫外光谱,可判断蛋白质分子中芳香族氨基酸的微环境变化,分析蛋白质与小分子是否存在相互作用;通过荧光光谱,可计算出两者的结合常数和结合位点数,判断结合位置和作用力类型等;通过同步荧光光谱,可克服Trp、Tyr和Phe发射光谱重叠问题,从而获得更为清晰的荧光图谱;通过红外光谱,可分析蛋白质与小分子化合物作用后二级结构的变化。
血红蛋白是高等生物红细胞内执行输氧功能的呼吸蛋白,常作为血液缓冲剂或通过可逆结合多种配体来调节各种生命现象。牛血红蛋白(bovine hemoglobin,BHb)与人血红蛋白具有极高的一级结构同源性,空间结构几乎完全一致且容易获得,因此常用于模拟生物大分子与小分子化合物的相互作用研究。小分子化合物与血红蛋白的相互作用,不仅影响其体内浓度、循环、分布和生物活性等[9],而且对血红蛋白结构和功能发挥也有一定影响[10],最终影响药物的治疗效果。近年来国内外相关研究主要集中在牛血清蛋白或单一溶剂体系,少有采用血红蛋白或多溶剂体系的报道。但一方面,由于高浓度PHL的水溶性较差,在食品医药领域常需添加乙醇(EtOH)、二甲基亚砜(DMSO)等助溶剂[11],另一方面,小分子化合物与蛋白质的相互作用对其抗氧化性影响也不明确。因此,本实验利用紫外光谱、荧光光谱、同步荧光光谱和红外光谱法,研究在dH2O、10% DMSO(v/v)和10% EtOH(v/v)不同溶剂体系中,根皮苷与牛血红蛋白的作用类型、猝灭机理、结合位点数及结合距离等,并分析PHL-BHb对DPPH和ABTS自由基清除率的影响,为研究小分子化合物与血红蛋白的相互作用提供参考。
1 材料与方法
1.1 材料与仪器
牛血红蛋白(BHb) 纯度>90%,Worthingtong Biochemical Corporation;根皮苷(PHL) 纯度>98%,索莱宝;DPPH(1,1-二苯基-2-三硝基苯肼)、ABTS(2,2′-联氮双(3-乙基苯并噻唑啉-6-磺酸)二铵盐) Sigma;DMSO和EtOH 生工生物工程(上海)股份有限公司;实验用水 娃哈哈纯净水。
RF5301荧光光谱仪、UV-1800紫外可见分光光度计 日本岛津;Nicolet iS5红外光谱仪 美国赛默飞世尔;PHS-3D型pH计 上海雷磁;ME204电子天平 瑞士梅特勒托利多。
1.2 实验方法
1.2.1 3种不同溶剂体系中PHL对BHb紫外光谱的影响 在dH2O、10%DMSO和10%EtOH不同溶剂体系中,固定BHb终浓度为1.0×10-5mol·L-1,调节PHL用量使其终浓度分别为0、1.5×10-5、4.5×10-5、7.5×10-5、10.5×10-5、13.5×10-5mol·L-1,在298 K条件下混合均匀,20 min后在240~360 nm范围内测定紫外吸收光谱[12]。
1.2.2 3种不同溶剂体系中PHL对BHb荧光光谱的影响 在dH2O、10% DMSO和10% EtOH不同溶剂体系中,固定BHb终浓度为1.0×10-5mol·L-1,调节PHL用量使其终浓度分别为0、1.5×10-5、4.5×10-5、7.5×10-5、10.5×10-5、13.5×10-5mol·L-1,混合均匀,20 min后在激发波长280 nm,激发狭缝和发射狭缝均为5 nm,扫描速率1200 nm/min条件下,在300~400 nm范围内分别测定298、304和310 K时荧光发射光谱[13]。在298 K条件下,固定Δλ=15 nm和Δλ=60 nm,其它参数同荧光光谱,分别测定298 K时BHb的同步荧光光谱[14]。
1.2.3 BHb、PHL-BHb的红外光谱 在dH2O体系中,固定PHL浓度为1.0×10-4mol·L-1,BHb浓度为1.0×10-4mol·L-1。相互作用20 min后真空冷冻干燥24 h。取2 mg样品与200 mg KBr进行研磨后压成透明薄片,在分辨率为4 cm-1,扫描次数为16次,4000~400 cm-1范围内扫描其红外光谱。
1.2.4 3种不同溶剂体系中PHL、BHb、PHL-BHb抗氧化性 DPPH自由基清除率参考Sharma[15]方法,研究在3种不同溶剂体系下,PHL和BHb分别为1.5×10-2mol·L-1和1.5×10-5mol·L-1时,其对PHL抗氧化性的影响;ABTS+·清除率参考封易成[16]方法,研究在3种不同溶剂体系下,PHL和BHb分别为1.5×10-2mol·L-1和1.5×10-3mol·L-1时,其对PHL抗氧化性的影响。
1.3 数据分析
2 结果与分析
2.1 紫外光谱
在3种不同溶剂体系中,PHL与BHb相互作用的紫外光谱见图1(a)、1(b)和1(c)。由图1(a)、1(b)和1(c)可知,随PHL浓度不断增加,BHb在280 nm附近均逐渐出现增色效应,但这仅表明PHL与BHb存在相互作用[17],不能完全归属于BHb分子中Tyr和Trp的π-π*和n-π*跃迁,因为PHL的λmax也在284 nm[18]左右且与BHb紫外吸收存在一定程度重合。在3种不同溶剂体系中,BHb的λmax均发生轻微红移。可能原因:PHL与BHb分子间的相互作用,导致π-π*跃迁所需能量减少[19],因而出现红移。当PHL浓度增至7.5×10-5mol·L-1时,BHb分子在330 nm附近均逐渐出现微弱副峰,这进一步验证了PHL与BHb存在相互作用。

图1 3种不同溶剂体系中PHL-BHb的紫外光谱
2.2 荧光光谱
2.2.1 荧光光谱 在3种不同溶剂体系中,PHL与BHb相互作用的荧光光谱见图2(a)、2(b)和2(c)。理论上采用280 nm波长激发时,Phe荧光发射可忽略,Tyr荧光峰应在313 nm附近,但本实验313 nm处未见荧光峰,而在320 nm附近出现荧光峰。可能原因:尽管每个BHb分子含有10个Tyr残基和6个Trp残基,但BHb疏水腔内的β-37Trp为其内源荧光的主要来源[20],因此,可能是BHb分子发生了Tyr到Trp的能量转移,从而导致Tyr荧光猝灭和Trp荧光增强。在3种不同溶剂体系中,随PHL浓度不断增加,一方面,BHb荧光峰在320 nm附近逐渐变宽甚至消失;荧光强度成规律性降低,且降低程度逐渐减弱。这表明PHL对BHb发生了荧光猝灭,且BHb分子中可被PHL结合的位点被不断占据而最终使荧光猝灭程度趋于稳定[21]。当PHL浓度增至7.5×10-5mol·L-1时,3种不同溶剂体系中的BHb荧光峰出现峰裂分,即原来320 nm处的单峰逐渐裂分为极其微弱的二重峰,其中一个峰红移至340 nm附近,可认为是Trp的发射峰;另一个峰蓝移至315 nm附近,可认为是Tyr的发射峰。对于荧光二重峰归属问题,目前尚无明确定论,初步认为:随PHL浓度增大(>7.5×10-5mol·L-1),BHb分子中Tyr残基受PHL诱导而终止与Trp残基的能量共振转移,从而发射Tyr荧光峰的趋势逐渐增强[22]。
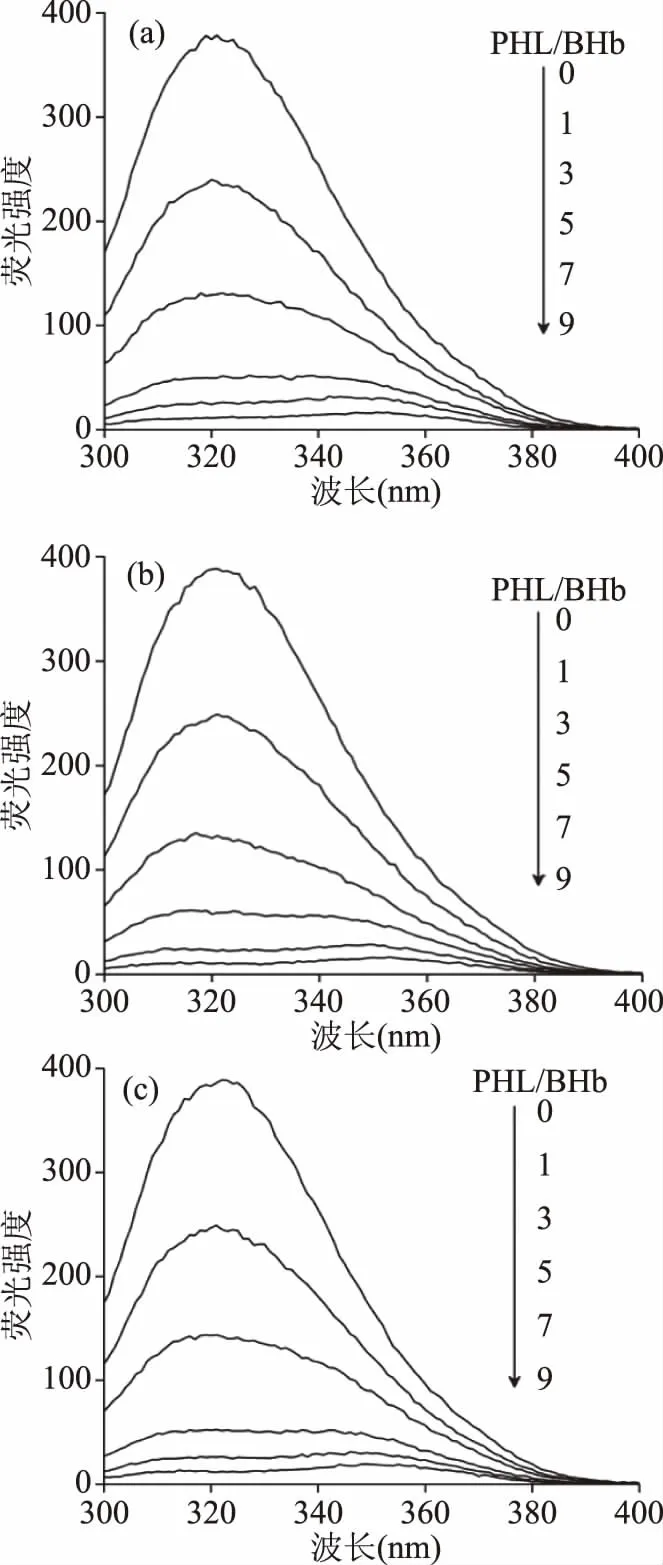
图2 3种不同溶剂体系中PHL-BHb荧光光谱
在dH2O体系中,随PHL浓度增大,BHb的λem由321 nm逐渐红移至349 nm;在10% DMSO体系中,BHb的λem由321 nm逐渐红移至350 nm;在10% EtOH体系中,BHb的λem由322 nm逐渐红移至349 nm。一般认为,Trp处于非极性介质时,荧光峰在310~324 nm范围;处于分子内部疏水介质时,荧光峰在326~332 nm范围;暴露分子表面时,荧光峰在350~353 nm范围[23]。本实验结果表明,3种不同溶剂体系中的Trp处于从疏水性介质向分子表面暴露阶段,即部分位于疏水介质中。PHL分子中存在的给电子基团-OH,可诱导BHb发生红移,这是分子内电荷转移而引起的能量转移结果[24]。
2.2.2 荧光猝灭机理 假设PHL对BHb的荧光猝灭为动态猝灭,根据Stern-Volmer曲线拟合:
F0/F=1+Kqτ0[Q]=1+Ksv[Q]
式(1)
式(1)中:F0和F分别为未加和加入PHL时的荧光强度,[Q]为PHL浓度,Kq为速率常数,τ0为无PHL时荧光寿命(10-8s),Ksv为猝灭常数。
lg[(F0-F)/F]=nlg[Q]+lgKa
式(2)
式(2)中:n为结合位点数,Ka为结合常数。
根据PHL浓度及荧光强度,计算KSV、Kq、Ka等,结果见表1。在3种不同溶剂体系中,Kq均为1012L·(mol·S)-1数量级且大于2.0×1010L·(mol·S)-1,故PHL对BHb为静态猝灭[25]。在3种不同溶剂体系中,平均结合位点数(n)分别为1.57、1.58和1.57,n和Ka均随温度升高而降低,这表明温度升高降低了PHL-BHb稳定性,符合静态猝灭。3种不同溶剂体系中,Ka均为107L·mol-1数量级,表明理论上PHL与BHb的结合作用较强[26],可被蛋白质运输或储存。
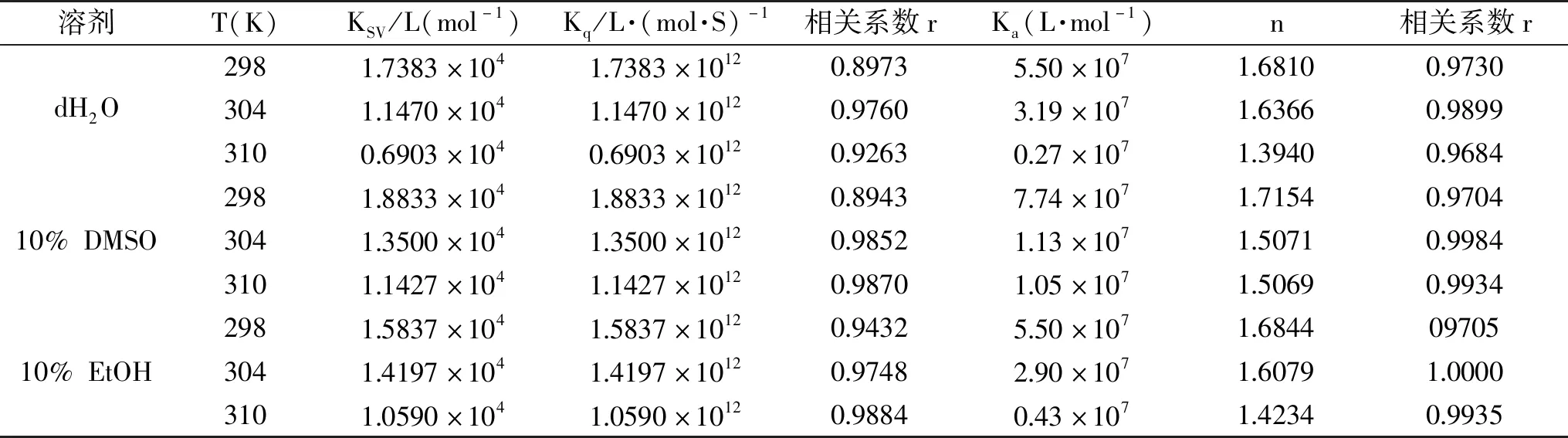
表1 不同溶剂中PHL-BHb的猝灭常数、结合常数和结合位点数
2.2.3 热力学和相互作用力 当温度变化范围较小时,ΔH可视为常数,故PHL-BHb热力学参数可采用Van’t Hoff方程计算。
式(3)
ΔG=ΔH-TΔS
式(4)
式(3)中:R为气体摩尔常数,8.31J/(mol·K);Ka为结合常数。
计算结果见表2。由表2可知,各不同溶剂体系的ΔG<0,说明反应可自发进行;ΔS<0,ΔH<0,说明PHL-BHb相互作用以范德华力和氢键为主[27]。

表2 不同溶剂体系中PHL-BHb的热动力学参数
2.2.4 结合距离 根据Forster偶极-偶极非辐射能量转移机理及下列关系式
式(5)
式(6)
J=∑F(λ)ε(λ)λ4Δλ/∑F(λ)Δλ
式(7)
式(5)中,F0为荧光发射强度,F为荧光发射体/荧光受体浓度比为1∶1时的荧光强度;式(6)中,K2、N、φ和J分别表示偶极空间取向因子,介质折射常数,BHb荧光量子产率,供体荧光发射谱与受体吸收谱的重叠积分;式(7)中,F(λ)为BHb在波长λ处的荧光强度,ε(λ)为荧光受体在波长λ处的摩尔吸光系数。在相同条件下测定BHb荧光光谱和PHL的紫外光谱,将两光谱重叠见图3(a)、(b)和(c),并利用式(7)计算重叠面积J。

图3 3种不同溶剂体系中BHb发射光谱与PHL吸收光谱重叠图
Trp量子产率Φ=0.15,N为1.366,K2为2/3,结果见表3。在dH2O、DMSO、EtOH 3种不同溶剂体系中,BHb与PHL的结合距离r0分别为4.561、4.576、4.566 nm,均小于7 nm,说明PHL与BHb在不同溶剂体系中均发生了非辐射能量转移[28]。

表3 不同溶剂体系中PHL-BHb的结合距离
2.3 同步荧光光谱
BHb分子中Trp、Tyr和Phe荧光峰存在重叠现象,采用同步荧光光谱法可判断其微环境和极性变化。Δλ=15 nm和Δλ=60 nm分别代表Tyr和Trp的荧光光谱[29]。图4(a)和4(b)、图5(a)和5(b)、图6(a)和6(b)分别表示dH2O、10% DMSO和10% EtOH体系在Δλ1=15 nm和Δλ2=60 nm的同步荧光光谱,其荧光发射峰约在307 nm和333 nm左右。由图4(a)和4(b)、图5(a)和5(b)、图6(a)和6(b)可知,随PHL浓度增加,Tyr和Trp荧光强度均逐渐降低,且代表Trp的荧光强度下降程度大于代表Tyr的荧光强度,表明PHL主要与Trp残基而非Tyr相互作用[30]。根据Horst[31],同步荧光还可用来判断蛋白质分子的共轭度,荧光峰红移,共轭度增加,反之,共轭度降低。随PHL浓度增加,在dH2O中,Tyr发生轻微红移,而Trp发生轻微蓝移,其它2种溶剂体系无明显红/蓝移,这表明,在dH2O中,PHL使BHb共轭度受到一定影响而下降,且Trp残基的微环境更加疏水[32]。

图4 dH2O中PHL-BHb同步荧光光谱
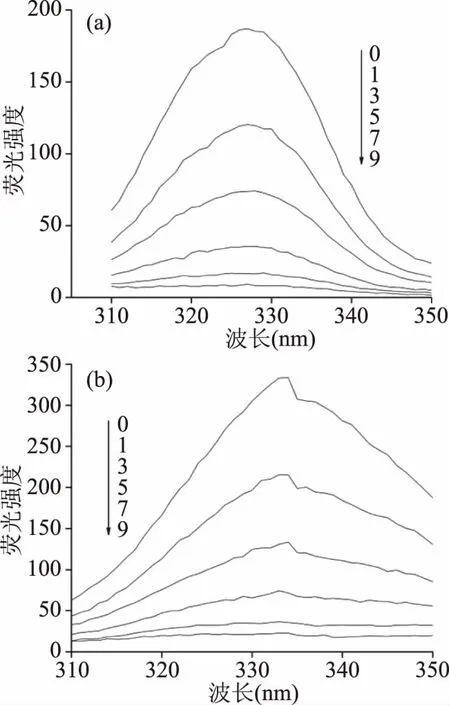
图5 10% DMSO中PHL-BHb同步荧光光谱

图6 10% EtOH中PHL-BHb同步荧光光谱
2.4 红外光谱
PHL对BHb红外光谱的影响见图7。由图7可知,PHL使BHb酰胺Ⅱ带的N-H弯曲振动和C-N伸缩振动从1541.809 cm-1红移至1540.363 cm-1,这归属于α-螺旋、β-折叠、β-转角和无规则卷曲的叠加[33],PHL使BHb酰胺I带的C=O伸缩振动从1657.517 cm-1红移至1656.071 cm-1,这归属于α-螺旋的特征吸收峰[34],这表明PHL与BHb存在相互作用且使BHb分子中C=O、N-H、C-N的存在状态发生了某种变化,改变了BHb二级结构。另外,PHL使BHb酰胺I带和酰胺Ⅱ带强度均增强,这可能是由于PHL的酚羟基与BHb分子中C=O或C-N基团通过氢键作用,使BHb有序性降低而发生某种重排所致[35]。朱颖[36]研究表明,花青素引起大豆分离蛋白的酰胺Ⅰ和Ⅱ带发生蓝移,而韩敬美[37]研究表明,烟碱使胃蛋白酶的酰胺I带和酰胺Ⅱ带分别发生红移和蓝移,这说明不同种类蛋白质和小分子化合物作用,其引起蛋白二级结构的变化不同。
2.5 3种不同溶剂体系对PHL、BHb、PHL-BHb抗氧化性的影响
在3种不同溶剂体系中,BHb、PHL、PHL-BHb对DPPH和ABTS自由基清除率分别见图8(a)和8(b)。PHL抗氧化性主要取决酚羟基的供氢或供电子能力[38]。通过测定PHL对DPPH和ABTS自由基清除率的大小,分析加入BHb后不同溶剂体系对PHL氧化性的影响。由图8(a)可知,当加入BHb后,在dH2O和10%DMSO体系中,PHL对DPPH自由基清除率均显著增加(P<0.05);在10%DMSO体系中,PHL对DPPH自由基清除率增加显著(P<0.05);在10%EtOH体系中,PHL对DPPH自由基清除率显著下降(P<0.05)。由图8(b)可知,当加入BHb后,在3种不同溶剂体系中,PHL对ABTS自由基清除率均显著增加(P<0.05)。这表明在不同的抗氧化体系中,BHb对PHL抗氧化性的影响不同。
3 结论
在3种不同溶剂体系中,紫外光谱表明PHL与BHb均存在相互作用,荧光光谱表明PHL对BHb具有荧光猝灭作用,且猝灭机理均为静态猝灭和非辐射能量转移,相互作用力以范德华力和氢键为主。同步荧光光谱表明,BHL与PHL的相互结合位点更接近BHb的Trp残基而非Tyr残基。红外光谱表明,在dH2O体系中,酰胺Ⅰ和Ⅱ带发生轻微红移。对DPPH和ABTS自由基清除率表明,除10%EtOH-DPPH体系外,PHL-BHb均不同程度提高了PHL对DPPH和ABTS自由基的清除率。前人有关小分子化合物与生物大分子的相互作用研究,大多为单一溶剂体系且主要以牛血清白蛋白为模型蛋白,而本实验在dH2O、10% DMSO和10% EtOH等溶剂体系,研究了PHL与BHb的相互作用及其对PHL抗氧化性的影响,这为拓展水溶性较差的小分子活性化合物与生物大分子的相互作用提供了新视角,但PHL与BHb相互作用的具体结合位点仍有待于通过分子模拟等手段进一步阐明,同时PHL与BHb的相互作用对BHb生物学功能的影响也有待于进一步研究。
