人参山羊奶粉缓解体力疲劳作用及其标志性成分含量测定
2020-10-23韩燕燕王悦宏李曼微王恩鹏陈长宝
韩燕燕,吴 巍,王悦宏,李 慧,陈 雪,李曼微,王恩鹏,*,陈长宝,*
(1.长春中医药大学吉林省人参科学研究院,吉林长春 130117;2.吉林建筑大学松辽流域水环境教育部重点实验室,吉林长春 130118)
疲劳是指脑力或体力到达一定阶段时必然出现的一种生理现象[1-4],有数据表明,全球目前有35%以上的人处于疲劳状态,其中男性占60%,且常伴有运动性疲劳,属于中医肾虚证的主要证候[5-10]。一旦疲劳不能及时恢复,将导致机体内分泌紊乱、免疫力下降,是威胁人类健康的重要因素[11-12]。
人参作为百草之王,是公认的药食两用的补益类药材,具有优异的抗疲劳功能[13-19],其活性成分主要为人参皂苷、多糖等[20-23],可通过清除自由基、调节糖代谢、减少乳酸堆积、抗中枢神经递质紊乱等方面缓解体力疲劳[24,25]。山羊奶是世界上公认的最接近人奶的乳品,有“奶中之王”的美誉,富含蛋白质、氨基酸、脂肪及脂肪酸等[26-27]。《本草纲目》中记载:“羊乳,甘温无毒,补寒冷虚乏,润心肺,治消渴,疗虚痨,益精气,补肺肾气,和小肠气,补肾虚,利大肠”[28-29]。目前国内外开发的山羊奶产品种类繁多,主有婴幼儿配方奶粉、酸奶、奶酪等产品,功能涉及降压、降脂、降血糖及益智健脑、美容养颜等方面[30-31],然而将二者结合开发成具有抗疲劳功效的保健食品则鲜有报道。
高分离快速液相色谱-四极杆-飞行时间质谱(rapid resolution liquid chromatography quadrupole time of flight mass spectrometry,RRLC-Q-TOF-MS)联用技术具有高分辨、高质量精度等诸多优点,特别适用于复杂体系中活性成分的定性及定量分析[32-35]。本文旨在开发一种将人参、山羊奶结合的保健食品,为申报前期的功能性评价及含量测定提供参考,为合理开发利用人参及山羊奶资源提供依据。
1 材料与方法
1.1 材料与仪器
干法制人参山羊奶粉、湿法制人参山羊奶粉、人参超微粉 由黑龙江飞鹤乳业有限公司提供;标准品:Re、Rg1、Rb1、Rc、Rb2、Rd(纯度>98%) 均购自南京泽朗有限公司;ICR雄性小鼠 购自辽宁长生生物技术有限公司,动物合格证号:SCXK-(辽)2015-0001;尿素氮试剂盒、血清乳酸脱氢酶测定试剂盒、全血乳酸试剂盒 购自南京建成生物工程研究所;羧甲基纤维素钠 购自天津光复精细化工研究所;氢化可的松注射液 购自国药集团容生制药有限公司(国药准字H20023069);其它试验用试剂及材料 北京鼎国生物技术有限公司。
Tecan infinite M200 Pro型酶标仪 瑞士帝肯公司;ES-100A型电子天平 沈阳龙腾电子仪器公司;AG 22331高速冷冻离心机 德国EPPendorf公司;Vortex-Genie 2型涡旋振荡器 美国SI公司;Bio-Gen PRO 200型精密匀浆器 美国PRO Scientific公司;电热恒温水浴箱 北京长安科学仪器厂;超声提取KQ-3200B 昆山市超声仪器有限公司;真空泵 SHB-3 郑州杜甫仪器厂;旋转蒸发仪N-1100 日本东京理化;Aglient 6520液质联用仪 Aglient1200型液相色谱系统 Aglient accurate6520(Q-TOF)四极杆-飞行时间质谱仪 美国Aglient公司等。
1.2 实验方法
1.2.1 人参山羊奶粉人参皂苷含量测定
1.2.1.1 标准品溶液的制备 分别取Rg1,Re,Rb1,Rb2,Rc和Rd标准品适量,精密称定,加适量甲醇溶解并定容至刻度,分别制成浓度为1 mg/mL标准品溶液[36]。
1.2.1.2 供试品溶液制备 精密称取人参超微粉1 g,记为G1、G2、G3;分别精密称取干法奶粉和湿法人参山羊奶粉各16.84 g,共三份,分别记为DP-1,DP-2,DP-3和WP-1,WP-2,WP-3。同时为验证空白奶粉中皂苷含量,精密称取空白奶粉15.84 g,共3份,记为P-1、P-2、P-3。将上述样品分别置于250 mL具塞三角瓶中,加入70%的甲醇适量,超声提取两次,合并提取液,减压浓缩并定容至50 mL。将样品转移至250 mL分液漏斗中,加适量乙醚,萃取3 次,弃去乙醚层。再加入适量水饱和正丁醇溶液,萃取3 次,合并正丁醇层,于60 ℃水浴挥干。用适量甲醇溶解并定容至10 mL,过0.45 μm微孔滤膜,待进样分析。
1.2.1.3 色谱条件 色谱柱:Sigma-Aldrich C18色谱柱(50 mm×3.0 mm,2.7 μm);采用二元线性梯度洗脱:以0.1%甲酸水溶液(A)-乙腈(B)为流动相;梯度洗脱:0~5 min,15%~19% B;5~10 min,19% B;10~28 min,19%~26% B;28~30 min,26%~60%;流速为0.5 mL/min,柱温35 ℃,进样量5 μL[36]。
1.2.1.4 质谱条件 采用负离子模式,扫描范围m/z 200~1500。离子源为电喷雾电离源(ESI),雾化气温度300 ℃,干燥气(N2)流速9 L/min,干燥气温度350 ℃;雾化器压力45 Psi[36]。
1.2.1.5 标准曲线的建立 取6种标准品溶液,稀释成浓度分别为0.5、1、2、5、10、20、50 μg/mL的标准品系列溶液,在1.2.3和1.2.4条件下,进样分析,记录色谱图提取离子流峰面积定量。以浓度为横坐标(X),相应生成的峰面积为纵坐标(Y),做线性回归分析,作回归方程,得到六种皂苷单体标准品的回归方程及决定系数分别为:Rg1(Y=58000X+13312,R2=0.9926),Re(Y=60481X-60643,R2=0.9994),Rb1(Y=46203X+23465,R2=0.9994),Rb2(Y=12847X+6524.7,R2=0.9981),Rc(Y=14994X+6718.5,R2=0.9998),Rd(Y=41452X+23932,R2=0.9995)。
1.2.2 动物分组及给药剂量 在标准环境下(湿度50%±10%;温度25±2 ℃;12 h昼夜循环)自由进食进水,适应性喂养 3 d 后,按体重随机为空白组、模型组、人参山羊奶粉低(1.580 g/kg)、中(3.167 g/kg)、高剂量(6.333 g/kg),每组15只;灌胃给药,每天一次,其中低、中、高剂量组分别给予相应剂量干法制人参山羊奶粉,空白组及模型组按体重给予相同体积的0.5%羧甲基纤维素钠水溶液,连续灌胃给药30 d;在给药第26~29 d,皮下注射氢化可的松50 mg/kg,制备肾虚动物模型。
1.2.3 负重游泳实验 末次给药50 min后,将尾根部负荷7%体重铅皮的小鼠置于水深25 cm,水温(28±1.0) ℃的游泳箱内,记录小鼠自游泳开始至下沉10 s不再浮上来的时间,即为负重游泳时间[37]。
1.2.4 爬杆时间实验 末次给药50 min后开始试验,将小鼠放到玻璃棒上,使肌肉处于静力紧张状态,记录小鼠由于肌肉疲劳从玻璃棒上跌落下来的时间,累计3次,即为爬杆时间。
1.2.5 尿素氮(BUN)和丙二醛(MDA)含量及超氧化物歧化酶(SOD)活力测定 参考文献[38-39],末次给药50 min后,将小鼠置于水温为28 ℃游泳缸中不负重游泳60 min,休息40 min后,摘眼球取血,离心,取血清,按测试盒说明书测定BUN和MDA含量及SOD活力。
1.2.6 血乳酸(LA)含量测定 参考文献[38],末次给药30 min后,采血20 μL,在30 ℃水中不负重游泳10 min后采血20 μL,休息20 min后采血20 μL,目内眦取血,不加抗凝,按试剂盒要求测定3个时间点的LA含量。
1.2.7 统计学分析 数据以Excel建立数据库,利用GraphPad Prism作图,采用SPSS统计软件进行处理。组间差异比较用ANOVA 及Newman-Student 多重比较t检验分析,由SPSS 21.0统计软件完成。双侧P<0.05为差异有统计学显著意义。
2 结果与分析
2.1 不同样品6种主要皂苷的含量测定及鉴别
在1.2.1.3和1.2.1.4条件下,取1.2.1.2项下样品进行质谱分析,各色谱峰分离度良好,各样品总离子流图,见图1;以标准品进行比对并串联离子碎片进行定性,串联离子碎片信息见表1,串联离子碎片质谱图见图2,与已报道文献结果一致[40];提取离子流峰面积定量,带入1.2.1.5项下相应标准曲线中;结果,干法制人参山羊奶粉中6种主要皂苷含量为0.09~0.24 mg/g,湿法制人参山羊奶粉中6种主要皂苷含量为0.07~0.19 mg/g;由表2可知,干法制人参山羊奶粉中6种主要皂苷含量均略高于湿法制人参山羊奶粉,可能是由于在湿法制备过程中,在喷雾干燥工艺中,受高温影响,皂苷结构被破坏或发生转化[41]。故选择干法制备人参山羊奶粉。
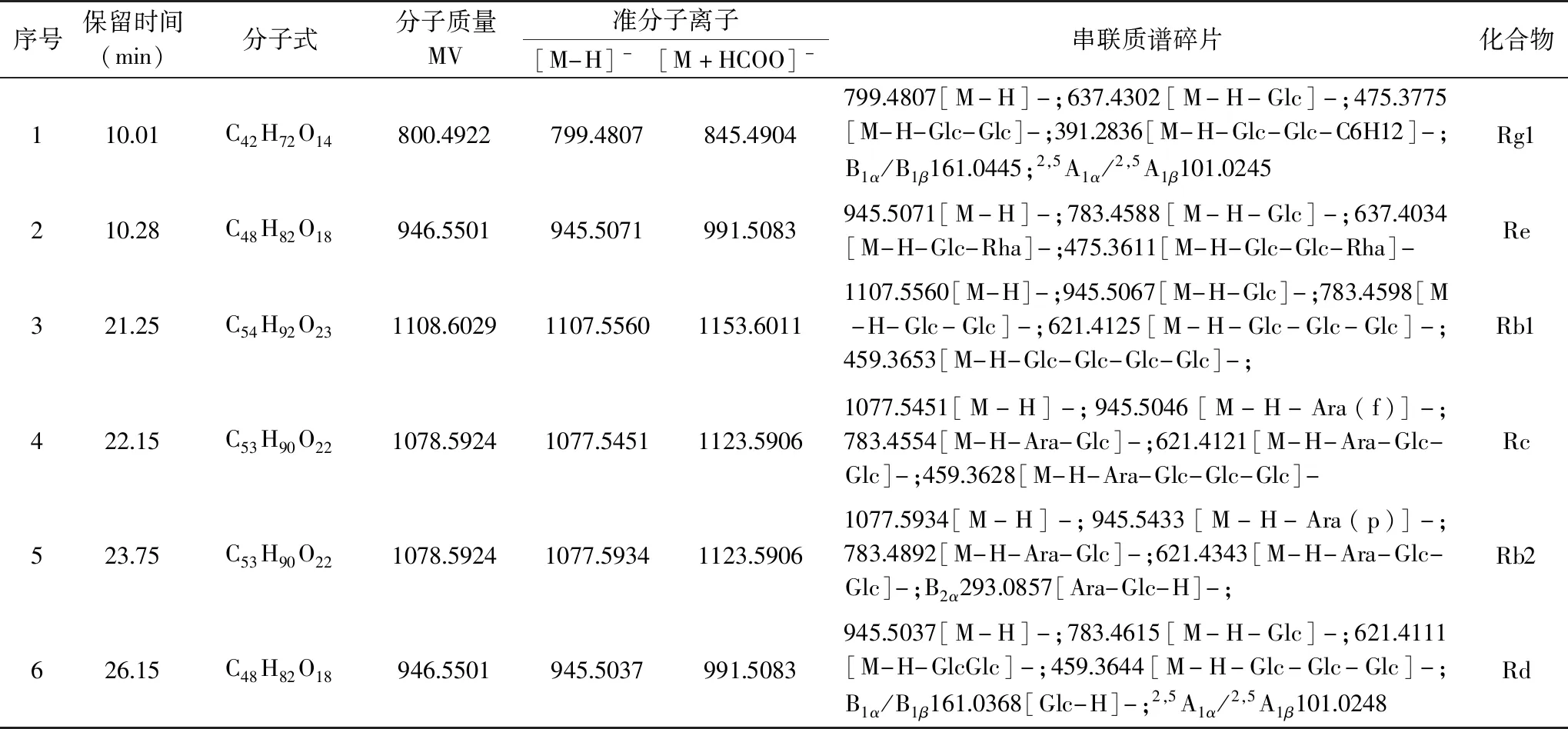
表1 不同奶粉样品中6种主要皂苷鉴定结果
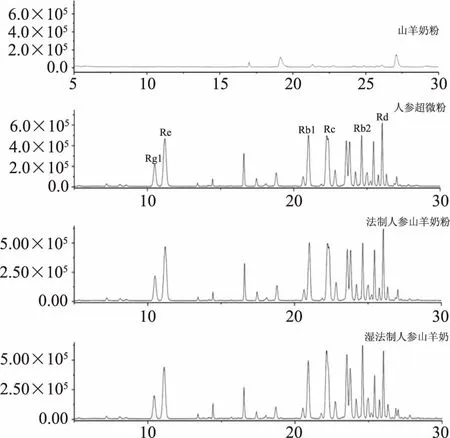
图1 人参总离子流色谱图

表2 六种皂苷单体含量测定的结果
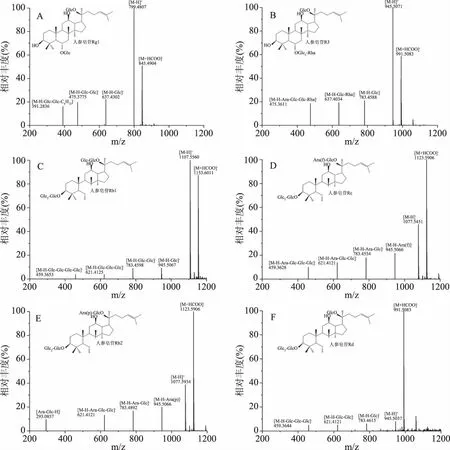
图2 在负离子模式下获得的人参皂苷的MS/MS谱图
2.2 对小鼠负重游泳时间的影响
由实验结果可知,与空白组相比,肾虚模型组小鼠负重游泳时间极显著缩短(P<0.01)。与肾虚模型组相比,组方低、中、高剂量均能明显延长小鼠负重游泳时间(P<0.05或P<0.01),结果见表3。
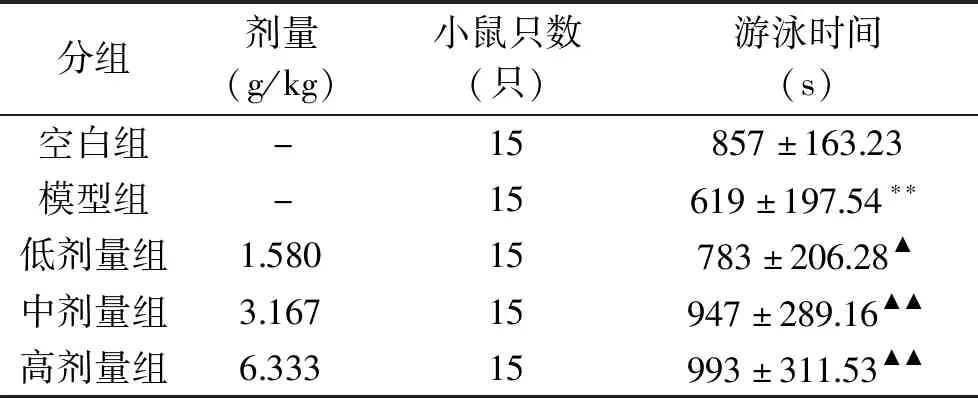
表3 小鼠负重游泳时间试验结果
2.3 对小鼠爬杆时间的影响
由实验结果知,与空白组相比,肾虚模型组小鼠爬杆时间极显著缩短(P<0.01)。与肾虚模型组相比,组方低、中、高剂量均能显著延长小鼠爬杆时间(P<0.05或P<0.01),结果见表4。
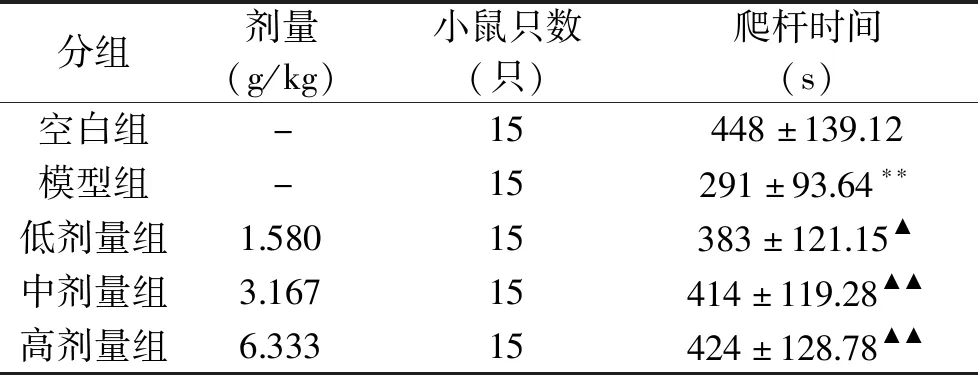
表4 小鼠爬杆时间试验结果
2.4 对小鼠血清丙二醛(MDA)含量的影响
由实验结果可知,与空白组相比,肾虚模型组小鼠血清MDA含量显著升高(P<0.05)。与肾虚模型组相比,组方低剂量有降低小鼠血清MDA含量的趋势(P>0.05);组方中、高剂量能显著降低小鼠血清MDA含量(P<0.05),结果见图3。
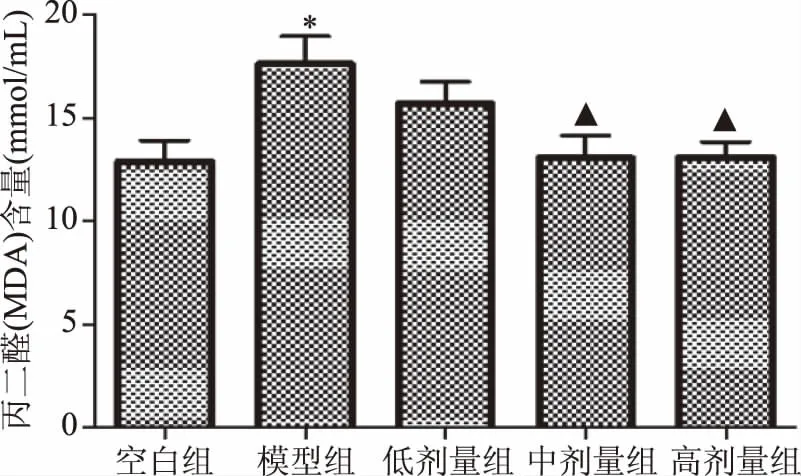
图3 小鼠血清丙二醛(MDA)含量试验结果
2.5 对小鼠血清尿素氮(BUN)含量的影响
由实验结果可知,与空白组相比,肾虚模型组小鼠血清BUN含量升高(P<0.05)。与肾虚模型组相比,组方低剂量有降低小鼠血清BUN含量的趋势(P>0.05);组方中、高剂量均能降低小鼠血清BUN含量(P<0.05或P<0.01),见图4。
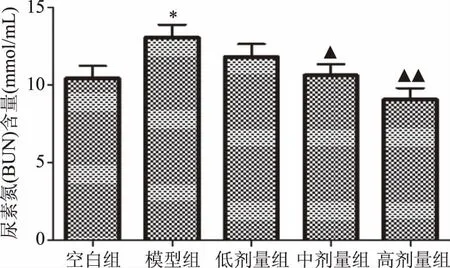
图4 小鼠血清尿素氮(BUN)含量试验结果 Fig.4 Results of the content of blood urea nitrogen of mice
2.6 对小鼠超氧化物歧化酶(SOD)活力的影响
由实验结果可知,与空白组相比,肾虚模型组小鼠血清SOD活力显著降低(P<0.01)。与肾虚模型组相比,组方低剂量有升高小鼠血清SOD活力的趋势(P>0.05);组方中、高剂量能显著升高小鼠血清SOD活力(P<0.05或P<0.01),结果见图5。

图5 小鼠血清超氧化物歧化酶(SOD)活力试验结果
2.7 对小鼠游泳10 min后和游泳休息20 min后血乳酸(LA)含量的影响
由实验结果可知,小鼠游泳10 min后,与空白组相比,肾虚模型组小鼠LA含量升高(P>0.05);与肾虚模型组相比,组方低剂量有降低小鼠LA含量的趋势(P>0.05);组方中、高剂量均能降低小鼠LA含量(P<0.05)。小鼠游泳休息20 min后,与肾虚模型对照组相比组方高剂量能显著降低小鼠LA含量(P<0.05),见表5。

表5 小鼠游泳后血乳酸含量试验结果
3 讨论与结论
人参是我国传统的滋补药材,主要的化学成分是人参皂苷[42]。刘娜[43]等研究发现,在连续28 d灌胃给予正常小鼠人参皂苷(3.2、1.6、0.8 g/kg)后,人参皂苷能够显著延长小鼠的负重游泳时间,降低小鼠体内尿素氮、乳酸及丙二醛的含量,提高肝糖原在体内的储备等,具有良好的抗疲劳作用。并且西欧一些科学家称山羊奶是天然抗生素,常喝山羊奶可使人面色红润、体力充沛[44]。
在本实验中利用RRLC-Q-TOF-MS检测技术对干、湿法奶粉中6种主要的皂苷类活性成分-Rg1、Re、Rb1、Rb2、Rc和Rd 进行含量测定,其中干法奶粉中6种皂苷含量为0.09~0.24 mg/g,湿法奶粉中6种皂苷含量为0.07~0.19 mg/g,干法制人参山羊奶粉中皂苷含量相对更高一些,故选择干法制人参山羊奶粉。并依据中华人民共和国卫生部2003年版《保健食品检验与评价技术规范》中“缓解体力疲劳功能检验方法”的要求进行实验设计。研究发现,与模型组相比,组方低、中、高剂量均能明显延长肾虚模型小鼠负重游泳时间和爬杆时间(P<0.05或P<0.01);组方中、高剂量能显著降低小鼠血清MDA含量(P<0.05)及BUN含量(P<0.05或P<0.01),能显著升高小鼠血清SOD活力(P<0.05或P<0.01),能降低小鼠游泳10 min后LA含量(P<0.05),组方高剂量能显著降低小鼠游泳20 min后LA含量(P<0.05);表明人参山羊奶可以提高肾虚模型小鼠的运动耐力,降低静用力时疲劳,提高有氧代谢能力,改善运动时骨骼肌的功能,具有缓解肾虚型体力疲劳的作用,与已报道的相关研究结果基本一致[43]。
综上所述,本文的研究内容可为人参山羊奶抗疲劳保健食品的开发及其标志性成分含量测定提供参考。
