刺果番荔枝叶多酚提取工艺优化及其体外抗氧化活性
2020-10-23孔方南李文砚杨志强张秀芬
孔方南,李文砚,韦 优,赵 静,周 婧,杨志强,张秀芬
(广西南亚热带农业科学研究所,广西龙州 532415)
刺果番荔枝(AnnonamuricataL.)又名红毛榴莲,番荔枝科番荔枝属,落叶乔木,原产于热带美洲,我国广东、广西、云南、海南等地均有引种栽培。刺果番荔枝果实口感清甜,含有必需氨基酸、蛋白质、矿物质、维生素等[1],具有美容养颜、清热解毒等功效[2-3]。刺果番荔枝的叶片、根、茎、种子中含有番荔枝内酯类化合物、生物碱类、酚类等有效成分,具有抗癌、抗肿瘤、抗寄生虫、抗疟等功能[4-5]。同时,刺果番荔枝具备生快长、四季常绿的特性,能够提供丰富的原材料。研究表明多酚具备极强的抗氧化、抗菌、抗病毒、抗炎等活性[6-10],具有医治心脑血管、调节血压、血脂等生理作用[11-15];研究发现多酚类化合物可以抑制肿瘤的形成延缓肿瘤的发作[16-17],同时可作为天然抗氧化剂及食品功能成分与其他抗氧化剂起到协同作用,如延长维生素C、维生素E的作用时间[18]。
目前植物多酚还没有标准化的提取方法,常用的提取方法主要是回流提取法、溶剂法、超声辅助提取法、酶辅助提取法等[19]。乙醇溶剂溶解性好,对细胞穿透性强,同时降低试验过程中试剂对人体造成的危害和对环境的污染。目前,国内尚无对刺果番荔枝植物相关部分多酚提取技术的研究。
本试验采用乙醇溶剂浸提法,从刺果番荔枝叶中提取多酚类物质,通过单因素实验考察乙醇溶剂体积分数、液料比、提取温度及提取时间对刺果番荔枝叶多酚提取量的影响,通过Box-Benhnken中心组合试验对其提取工艺进行优化,采用体外DPPH自由基和羟自由基(·OH)活性检测法测定其抗氧化能力。对刺果番荔枝叶多酚进行研究,从而获取具有多种用途的多酚物质,有利于植物多酚来源的拓宽,为抗氧化功能性食品研发提供理论依据。
1 材料与方法
1.1 材料与仪器
刺果番荔枝老叶 三年生,采摘于番荔枝种质资源圃;乙醇 广东光华科技股份有限公司;没食子酸、硫酸亚铁、水杨酸、抗坏血酸 天津市大茂化学试剂厂;无水碳酸钠 天津博迪化工股份有限公司;过氧化氢、福林酚(folin phenol,FC) 国药集团化学试剂有限公司;1,1-二苯基-2-三硝基苯肼(1,1-diphenyl-2-picrylhydrazyl,DPPH) 上海麦克林生化科技有限公司;实验室水为超纯水。
XM7D-8222电热恒温鼓风干燥箱 上海精宏实验设备有限公司;FW-100高速万能粉碎机 北京市永光明;TP-241精密电子天平 丹佛仪器(北京)有限公司;SH2-D(Ⅲ)循环水式真空泵 西安超杰生物科技有限公司;SHA-C水浴恒温振荡器 常州市华普达教学仪器有限公司;T6新世纪紫外可见分光光度计 北京普析通用仪器有限责任公司。
1.2 实验方法
1.2.1 刺果番荔枝叶预处理 将刺果番荔枝叶清水洗净,阴凉通风处晾干后,置于70 ℃鼓风干燥箱烘干至恒质量,粉碎后80目过筛,密封干燥备用。
1.2.2 多酚提取工艺 精确称刺果番荔枝叶干粉,置于玻璃具塞三角烧瓶,按照一定液料比添加乙醇溶剂,设置好提取温度、提取时间,利用恒温振荡器提取多酚类物质,真空泵抽滤样液,取滤液定容得到多酚粗提液。
1.2.3 单因素实验
1.2.3.1 乙醇体积分数对刺果番荔枝叶多酚提取量的影响 准确称取刺果番荔枝叶细粉1.0 g,设置液料比50∶1 mL/g、提取温度40 ℃、提取时间40 min,其他条件相同。在乙醇体积分数分别为30%、40%、50%、60%、70%下提取,分别抽滤并收集提取液定容,每个处理重复3次,各取1 mL提取液稀释一定倍数,测定各组刺果番荔枝叶多酚提取量。
1.2.3.2 提取温度对刺果番荔枝叶多酚提取量的影响 准确称取刺果番荔枝叶细粉1.0 g,设置液料比50∶1 mL/g、乙醇体积分数50%、提取时间40 min,其他条件相同。在提取温度分别为30、40、50、60、70 ℃下提取,分别抽滤并收集提取液定容,每个处理重复3次,各取1 mL提取液稀释一定倍数,测定各组刺果番荔枝叶多酚提取量。
1.2.3.3 液料比对刺果番荔枝叶多酚提取量的影响 准确称取刺果番荔枝叶细粉1.0 g,设置乙醇体积分数50%、提取温度40 ℃、提取时间40 min,其他条件相同。在液料比分别为40∶1、50∶1、60∶1、70∶1、80∶1 mL/g下提取,分别抽滤并收集提取液,每个处理重复3次,各取1 mL提取液稀释一定倍数,测定各组刺果番荔枝叶多酚提取量。
1.2.3.4 提取时间对刺果番荔枝叶多酚提取量的影响 准确称取刺果番荔枝叶细粉1.0 g,设置乙醇体积分数50%、提取温度40 ℃、液料比50∶1 mL/g,其他条件相同。在提取时间分别为40、60、80、100、120 min下提取,分别抽滤并收集提取液定容,每个处理重复3次,各取1 mL提取液稀释一定倍数,测定各组刺果番荔枝叶多酚提取量。
1.2.4 Box-Benhnken中心组合试验 对乙醇体积分数、液料比和提取时间3个单因素采用Box-Behnken中心组合试验进行试验设计,如表1所示。
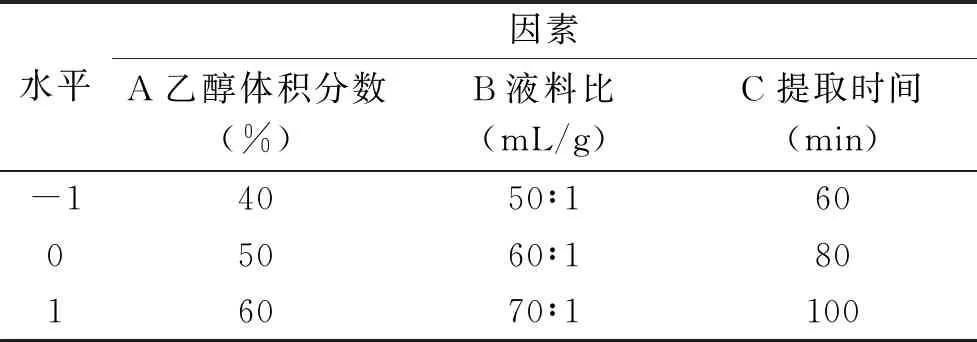
表1 Box-Benhnken中心组合试验因素与水平
1.2.5 刺果番荔枝多酚提取量的测定
1.2.5.1 没食子酸标准曲线 采用福林-酚法测定[20-21]。配制质量浓度为1 mg/mL没食子酸标准液(称量没食子酸50 mg,50 mL蒸馏水溶解并定容),分别吸取0.1、0.2、0.3、0.4、0.5、0.6 mL于10 mL容量瓶中,用蒸馏水定容,稀释质量浓度为0.01、0.02、0.03、0.04、0.05、0.06 mg/mL。各取1 mL置于10 mL具塞试管中,滴入10%福林酚试剂1.0 mL,摇匀反应15 min,而后滴入20%碳酸钠溶液2.0 mL,室温下避光反应60 min,反应完成后蒸馏水摇匀定容。蒸馏水调零,紫外可见分光光度计测定765 nm处吸光值。重复试验,平行测定3次,取平均值,建立标准曲线(以没食子酸溶液质量浓度为横坐标、吸光度为纵坐标),得到线性回归方程为y=7.2357x+0.0166,R2=0.9992,在0.01~0.06 mg/mL质量浓度范围内具有较好的线性相关性。
1.2.5.2 刺果番荔枝多酚提取量的测定及计算 移液枪吸取刺果番荔枝叶多酚提取液1.0 mL,置于10 mL具塞试管中,按没食子酸标准曲线制作的方法进行测定,滴入10%福林酚试剂1.0 mL,摇匀反应15 min,而后滴入20%碳酸钠溶液2.0 mL,室温下避光反应60 min,反应完成后蒸馏水摇匀定容。蒸馏水调零,紫外可见分光光度计测定765 nm处吸光值。重复试验,平行测定3次,取平均值。通过线性回归方程计算刺果番荔枝叶多酚质量浓度,多酚提取量公式如下:
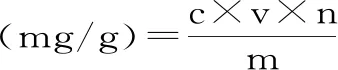
式(1)
式中:c为多酚质量浓度(mg/mL);v为多酚提取液总体积(mL);n为多酚提取液稀释倍数;m为样品重量(g)。
1.2.6 抗氧化性试验
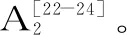
式(2)
1.2.6.2 羟自由基(·OH)清除率测定 取2 mL刺果番荔枝多酚溶液于具塞试管,其质量浓度分别为25、50、100、150、200、300 μg/mL,依次加入6 mmol/L硫酸亚铁溶液2 mL,6 mmol/L双氧水溶液2 mL,反应15 min,再加入6 mmol/L水杨酸溶液2 mL,反应30 min,蒸馏水调零,紫外可见分光光度计510 nm处测定吸光值,记为A溶液[25-26]。采用相同方法用蒸馏水替换水杨酸溶液换为测定吸光值,记为A对照。采用同样方法用蒸馏水替换多酚溶液测定吸光值,记为A空白。以VC作阳性对照。羟自由基(·OH)清除率按照公式(3)计算:
式(3)
1.3 数据处理
利用Excel 2003和Design-Expert.V 8.0.6软件进行数据统计分析并制图,用SPSS 20.0软件进行差异显著分析(不同小写字母表示差异显著P<0.05,不同大写字母表示差异极显著P<0.01),每个试验重复3次,结果以平均值±标准差(Mean±SD)表示。
2 结果与分析
2.1 单因素实验结果
2.1.1 乙醇体积分数对刺果番荔枝叶多酚提取量的影响 由图1可知,随着乙醇溶剂浓度上升,刺果番荔枝叶多酚提取量呈增大趋势,当乙醇体积分数50%时多酚提取量最大,为(13.64±0.79) mg/g;乙醇体积分数为50%、60%、70%时,多酚提取量极显著(P<0.01)高于乙醇体积分数30%时多酚提取量;乙醇体积分数50%多酚提取量显著(P<0.05)高于乙醇体积分数40%多酚提取量;乙醇体积分数为50%、60%、70%的多酚提取量差异不显著。以上表明,在一定浓度条件下,乙醇溶剂有效促进多酚类物质的溶解;乙醇溶剂浓度过大时,对氢键和疏水键的破坏力降低,同时色素、弱极性成分等溶出,抑制了某些多酚类物质的充分溶解[27-29],提取量降低。因此,刺果番荔枝叶多酚提取过程中,为了避免试剂的浪费,乙醇溶剂浓度50%最为适宜。
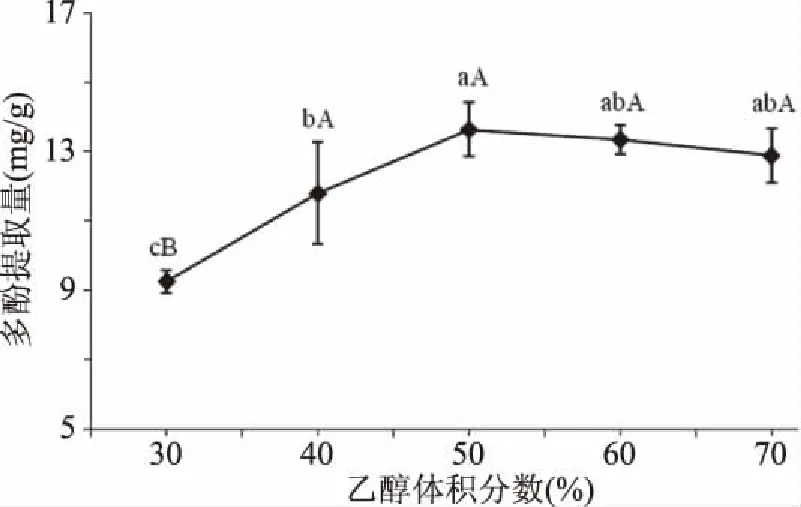
图1 乙醇体积分数对刺果番荔枝叶多酚提取量的影响
2.1.2 提取温度对刺果番荔枝叶多酚提取量的影响 由图2可知,随着提取温度的上升,刺果番荔枝叶多酚提取量呈增大趋势,当提取温度60 ℃时多酚提取量最大,为(17.13±0.84) mg/g,极显著(P<0.01)高于提取温度为30、40、50 ℃时多酚提取量;提取温度60 ℃时多酚提取量与提取温度70 ℃时多酚提取量差异不显著。因此,刺果番荔枝叶多酚提取过程中,从低耗能高效率的角度判断,适宜提取温度为60 ℃。
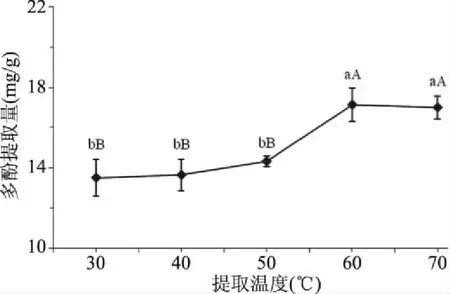
图2 提取温度对刺果番荔枝叶多酚提取量的影响
2.1.3 液料比对刺果番荔枝叶多酚提取量的影响 由图3可知,随着液料比的增加,刺果番荔枝叶多酚的提取量呈增大趋势;在液料比60∶1 mL/g时多酚提取量达到最大,为(16.91±0.34) mg/g,极显著(P<0.01)高于其他液料比的多酚提取量;随着料液比继续增大,多酚提取量呈下降趋势。由于在一定乙醇溶剂体积范围内,溶液的用量可以促进多酚类物质的溶出,当料液比增加至60∶1 mL/g时,多酚类物质的溶出已到达基本达饱和状态。而乙醇溶剂用量的增加,致使色素、非多酚杂质等成分继续溶出[22,27],从而影响了提取效果,导致多酚提取量逐渐降低。因此,刺果番荔枝叶多酚提取过程中,从能耗角度考虑,料液比60∶1 mL/g最为合适。
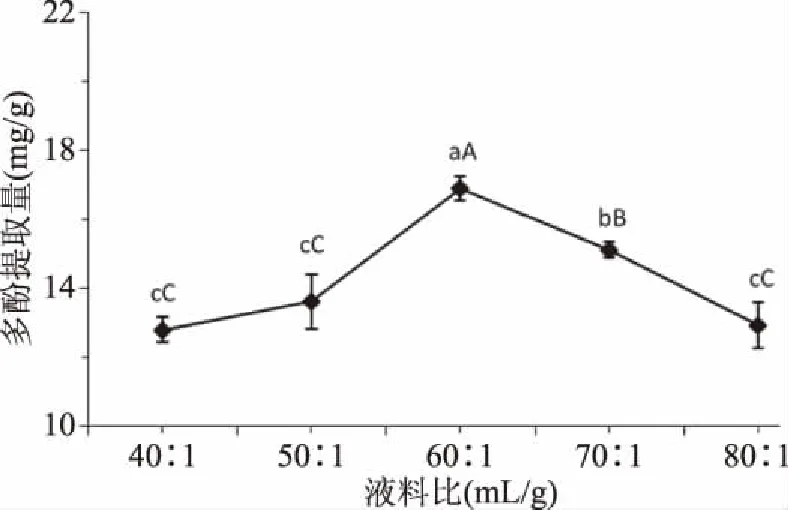
图3 液料比对刺果番荔枝叶多酚提取量的影响
2.1.4 提取时间对刺果番荔枝叶多酚提取量的影响 由图4可知,随着提取时间的延长,刺果番荔枝叶多酚的提取量呈增大趋势,在提取时间80 min时多酚提取量达到最高,为(17.74±0.86) mg/g,极显著(P<0.01)高于提取时间40 min时多酚提取量;提取时间60、80、100、120 min之间的多酚提取量差异不显著。样品与溶剂在一定提取时间范围内,接触时间的延长利于多酚类物质的溶出;但提取时间超过80 min后,多酚类物质不够稳定,有氧气进入参与反应,导致多酚类物质氧化分解,与此同时其他杂质成分相继溶出,从而导致多酚提取量逐渐降低并趋于稳定[21-22,30-31]。因此,刺果番荔枝叶多酚提取过程中,提取时间80 min最为适宜。
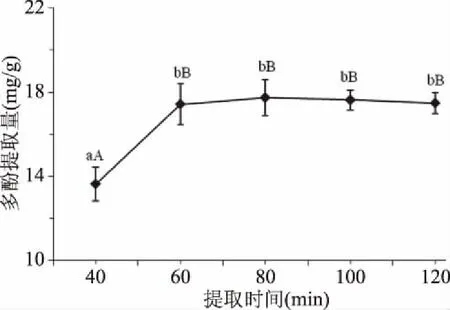
图4 提取时间对刺果番荔枝叶多酚提取量的影响
2.2 Box-Benhnken中心组合试验结果及数据分析
2.2.1 回归模型的建立及方差分析 在单因素实验基础上,采用 Box-Benhnken中心组合试验设计对刺果番荔枝叶多酚提取进行优化。选择单要素为A乙醇体积分数、B液料比、C提取时间,响应值Y为刺果番荔枝叶多酚提取量,设计出3因素3水平的17组试验(中心点重复次数为5次)。试验过程中每个因素水平提取3次,计算得出的平均值即为多酚提取量。通过Design-Expert 8.0.6.1软件对试验数据进行分析。表2为试验设计及结果,表3以多酚提取量为响应值的方差分析,图5为试验设计得到的各响应面结果。
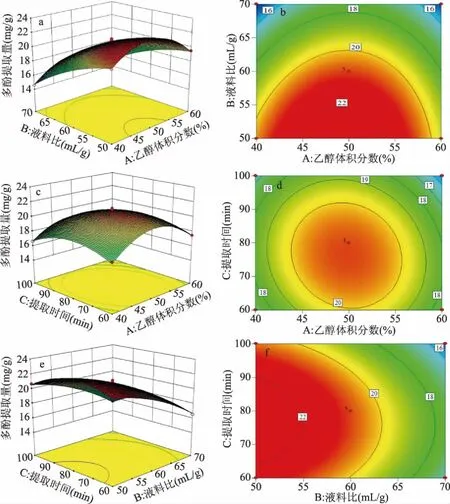
图5 各要素对多酚提取量的效应面图和等高线图
通过Design Expert8.0.6.1软件对表2试验数据进行多元回归拟合,得到与A乙醇体积分数、B液料比、C提取时间3个要素相关的刺果番荔枝叶多酚提取量Y的二次多项回归模型为:
Y=20.87-0.20A-2.56B-0.58C+0.32AB-0.39AC-0.09BC-2.68A2-0.83B2-1.52C2
式(4)
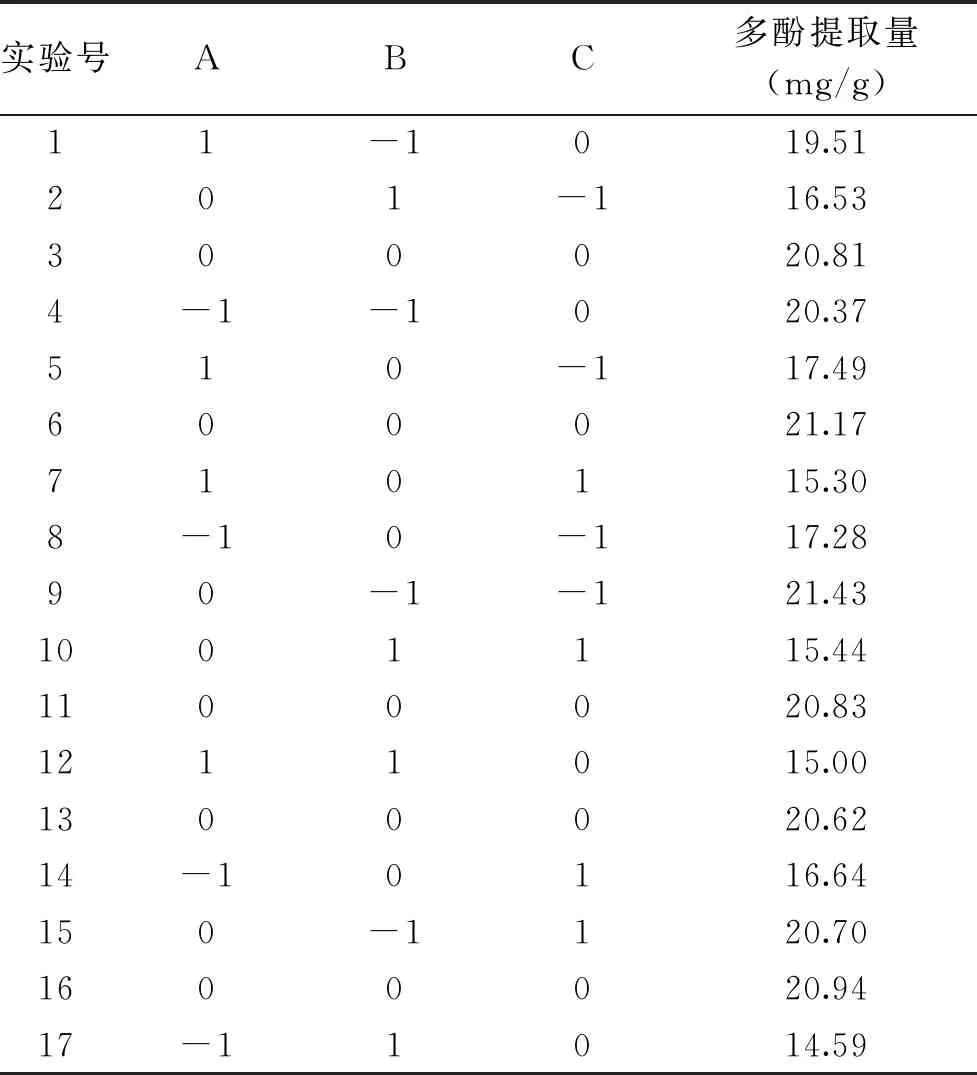
表2 Box-Behnken试验设计及结果
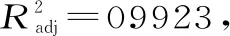
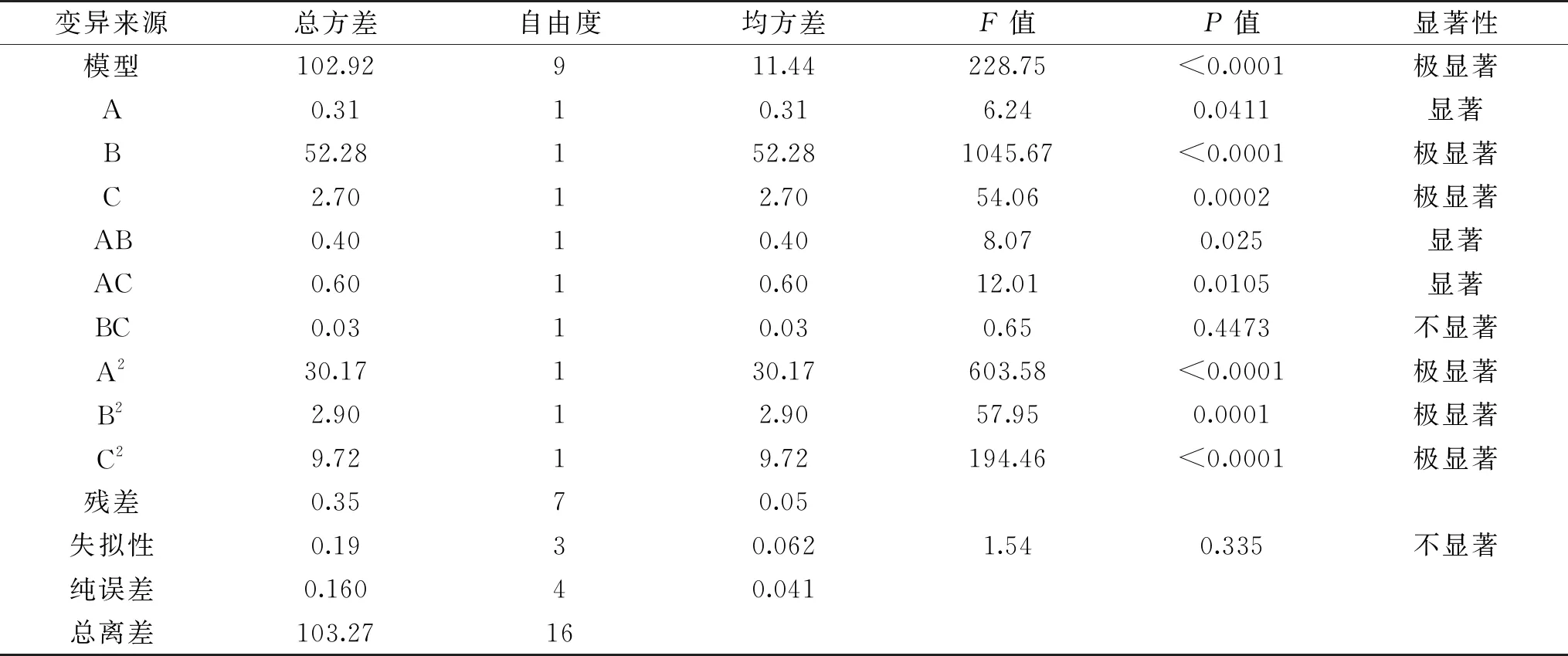
表3 以多酚提取量为响应值的方差分析
2.2.2 效应图及等高线图分析 图5是A乙醇体积分数、B液料比和C提取时间对Y刺果番荔枝叶多酚提取量的效应图及等高线图。由图4a、4c、4e可看出当A、B、C取值较小时效应面曲线较陡,说明此时A、B、C对Y的影响较为明显;当A、B、C取值较大时效应面曲线较平缓,此时A、B、C对Y影响较小。由图5b可知,朝着B要素向峰值移动等高线密度显然高于A沿因素移动的密度,表明液料比对效应值影响更大,与方差分析结果一致。由图5d可知,朝着A要素和C要素向峰值移动的等高线密度比较大,且A和C取值较小时对Y的影响更大,当乙醇体积分数高于50%时等高线密度变低,表明较高的乙醇体积分数对响应值Y的影响不如较低超声时间显著。由图5f可知,B要素与C要素进行比较,B向峰值方向移动等高线密度显然较大,提取时间较低时等高线密度较大,当提取时间高于80 min时等高线密度变低,说明较高液料比对响应值的影响显著。
各要素对响应值的影响能够被效应面直观体现出来,效应面越陡则证明相关因素的交互作用越强[32],交互效应的大小由等高线的形状体现,两因素的交互作用的强弱由椭圆形或圆形反映。各要素大小从四周向中心点聚拢时,效应图呈凸起趋势,即多酚提取量趋于最大化,表明存在最大响应值。图5b、图5d可看出等高线呈现明显的椭圆形、响应曲线相对较陡,说明A乙醇体积分数和B液料比、A乙醇体积分数和C提取时间之间交互作用显著,与方差分析结果一致。
2.2.3 刺果番荔枝叶多酚提取工艺优化及验证结果 利用Design-Expert.V 8.0.6.1软件进行回归分析,刺果番荔枝叶多酚用乙醇浸提法提取的理论最优工艺为:乙醇体积分数55.23%、液料比50∶1 mL/g、提取时间95.76 min,由此工艺得到刺果番荔枝叶多酚提取量的理论预测值为20.11 mg/g。
根据试验操作的需要,提取工艺调整为:乙醇体积分数55%、料液比50∶1 mL/g、提取时间96 min。在该工艺下提取刺果番荔枝叶多酚,试验重复3次,得到刺果番荔枝叶多酚提量为(20.37±0.34) mg/g,接近于理论值。表明,运用Box-Benhnken中心组合试验设计所得的模型参数准确可靠,优化刺果番荔枝叶多酚提取工艺方法可行。
2.3 抗氧化性试验
2.3.1 对DPPH自由基的清除能力 DPPH自由基作为具备高度氧化性的自由基,但多酚可通过提供氢原子或螯合剂来抑制氧化反应,具备清除自由基功能[33]。由图6可看出,刺果番荔枝叶多酚随着浓度的增加对DPPH具有较强的清除能力,清除率逐渐提升后最后趋于稳定,试验范围内的最大清除率为(51.34%±2.68%)。将刺果番荔枝叶多酚及抗坏血酸的质量浓度与其DPPH自由基清除率进行线性拟合,都呈良好的量效关系,拟合方程分别为y=0.344x+15.195(R2=0.968)和y=0.359x+44.303(R2=0.911)。刺果番荔枝叶多酚的半抑制浓度(IC50)为133.33 μg/mL,抗坏血酸的IC50为16.39 μg/mL。在试验浓度范围内,同浓度抗坏血酸对照可见,抗坏血酸对DPPH的清除率高于同浓度的刺果番荔枝叶多酚提取物,说明刺果番荔枝叶多酚提取物对DPPH具有较好的清除能力,但不及同浓度的抗坏血酸。
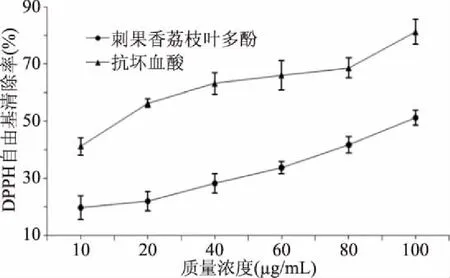
图6 不同质量浓度刺果番荔枝叶多酚对DPPH自由基清除能力
2.3.2 对羟自由基(·OH)的清除能力 羟基自由基是反应性强的氧化剂,它能够与细胞成分发生反应,对机体产生危害,导致引发各种疾病和加速机体衰老[34-35]。图7表明,刺果番荔枝叶多酚对羟自由基(·OH)具有较强的清除功效,随着浓度增加,清除率逐渐升高最后趋于稳定,在试验范围内的最大清除率为52.50%±2.29%。将刺果番荔枝叶多酚及抗坏血酸的质量浓度与其对羟自由基(·OH)清除率进行线性拟合,都呈良好的量效关系,拟合方程分别为y=0.101x+24.882(R2=0.956)和y=0.054x+43.973(R2=0.916)。刺果番荔枝叶多酚的半抑制浓度(IC50)为264.65 μg/mL,大于抗坏血酸的半抑制浓度(IC50)81.82 μg/mL。在试验浓度范围内与同浓度抗坏血酸比较,刺果番荔枝叶多酚对羟自由基(·OH)的清除功效不及同浓度抗坏血酸。在质量浓度为300 μg/mL时,刺果番荔枝叶多酚、抗坏血酸对羟自由基(·OH)的清除率相当,分别为为52.50%±2.29%、57.83%±1.32%,表明刺果番荔枝叶多酚对羟基自由基有较强的清除功效。
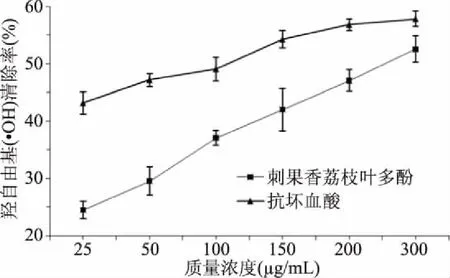
图7 不同质量浓度刺果番荔枝叶多酚对羟自由基(·OH)清除能力
3 结论
本试验选用乙醇浸提法对刺果番荔枝叶多酚进行提取,通过Box-Benhnken中心组合试验优化工艺参数。在最优提取工艺为乙醇体积分数55%、液料比50∶1 mL/g、提取时间96 min、提取温度60 ℃,实际测得多酚提量为(20.37±0.34) mg/g,理论值相近,能为工业生产提供优化方案。在试验浓度范围内,提取刺果番荔枝叶得到的多酚类物质对DPPH和·OH的清除率较高,虽然刺果番荔枝叶多酚提取物清除功效虽不及同浓度抗坏血酸,但清除功效良好。因此,刺果番荔枝在抗氧化功能食品和药品研发方面具备很好的潜力。
