卡培他滨对大鼠免疫功能影响的初步实验观察
2020-10-23张思睿王政禄刘涛吴迪侯文郑虹天津医科大学一中心临床学院天津009天津市第一中心医院病理科天津009天津市第一中心医院国家卫生健康委员会危重病急救医学重点实验室天津009天津市第一中心医院器官移植中心小儿肝移植科天津009天津市第一中心医院器官移植中心天津009
张思睿,王政禄,刘涛,吴迪,侯文,郑虹(.天津医科大学一中心临床学院,天津 009;.天津市第一中心医院病理科,天津 009;.天津市第一中心医院国家卫生健康委员会危重病急救医学重点实验室,天津 009;.天津市第一中心医院器官移植中心小儿肝移植科,天津 009;.天津市第一中心医院器官移植中心,天津 009)
原发性肝癌是最常见的恶性肿瘤之一,病死率较高,预后较差[1-2],肝移植是目前治疗肝癌较为有效的方法。我国肝癌肝移植患者约占肝移植手术患者的36.8%,但术后5 年肝癌复发率达20.0% ~ 57.8%,成为影响疗效的主要原因[3]。肝移植术后免疫抑制剂的应用增加了肿瘤复发的风险[4],且随 免疫抑制强度的增加复发风险增高。因此,寻找一种兼具免疫抑制和抗肿瘤作用的药物具有重要的临床意义。2017 年,Ravaioli 等[5]研究发现肝癌肝移植患者术后给予卡培他滨(capecitabine,CAP)节拍化疗取得了与抗肿瘤药索拉非尼相近的1 年生存率,同时在治疗期间无急性排斥反应的发生。上述研究提示CAP 可能是一种具有免疫抑制作用的抗肿瘤药物,但目前尚缺少单独针对CAP 免疫抑制作用的实验研究。本研究通过观察不同剂量CAP对大鼠免疫细胞、 白细胞介素-2(interleukin-2,IL-2)和γ-干扰素(interferon-γ,IFN-γ)的影响,探讨其对免疫系统的作用,为其作为具有免疫抑制效应的抗肿瘤药提供理论基础及前期的动物实验研究成果。
1 材料和方法
1.1 实验动物:成年清洁级雄性BN 大鼠18 只,购买自北京维通利华实验动物技术有限公司〔许可证号:SCXK(京)2016-0006〕,6 ~ 8 周龄,体重为200 ~ 220 g。
1.2 实验分组:大鼠分为空白组(CON 组)、CAP低剂量组(metronomic chemotherapy,MET 组)和CAP 高剂量组(most tolerance dose,MTD 组),每组6 只,给予大鼠普通维持饲料,自由进食水。
1.3 给药剂量和方法:CAP 购自北京索莱宝科技有限公司(Solarbio,货号:A8740)。参考临床常规化疗给药剂量[6]:2 500 mg/(m2·d),一日2 次;节拍化疗给药剂量[7]:500 mg/次,一日 2 次,分为MTD 组和MET 组两组。根据文献[8-9]
得知,依据成人平均体重60 kg,平均体表面积为1.76 m2,计算得出CAP 常规化疗单次给药剂量为36.7 mg/kg,节拍化疗单次给药剂量为 8.3 mg/kg。根据药理试验中动物间和动物与人体间的等效剂量换算方法[10],计算出MET 组和MTD组大鼠分别灌胃每次CAP 45 mg/kg,一日2 次 (加入生理盐水溶解配置成质量分数为0.75%的CAP溶液,4℃冰箱保存)和200 mg/ (kg·次),一日 2 次(加入生理盐水溶解配置成质量分数为3.33%的CAP 溶液,4℃冰箱保存)连续给药21 d。CON组大鼠给予1.2 ml 生理盐水,一日2 次,连续灌胃服用21 d。
1.4 检测方法
1.4.1 一般情况:3 组大鼠于给药前、给药后第7 天、14 天和21 天使用电子秤测量体重,观察大鼠精神、体力等一般状态并记录。
1.4.2 血清获取及保存:3 组大鼠于给药前、给药后第7 天、14 天和21 天分别经眼内眦静脉取血 2 ml,静置30 min 后,按3 000 RPM,4℃,离心 30 min,取上层血清于EP 管中,保存在-80℃冰箱,待ELISA 检测。
1.4.3 外周血淋巴细胞悬液制备:大鼠静脉血 1 ml 加入红细胞裂解液 (购自北京索莱宝科技有限公司,Solaribio,货号R1010)裂解红细胞洗涤后,加入PBS 并调整细胞计数为1×106/ml 备用。
1.4.4 流式细胞检测:淋巴细胞悬液中加入APC Anti-rat-CD3 抗 体( 购 自 美 国Biolegend 公 司,Cat#201414)、FITC Anti-rat-CD4 抗体(购自美国Biolegend 公 司,Cat#201505)和PE Anti-rat-CD8抗体(购自美国Biolegend 公司,Cat#200608),使用流式细胞仪(美国BD 公司,BD Accuri C6 Plus)检测总淋巴细胞数、T 淋巴细胞数、CD4+淋巴细胞数及CD8+淋巴细胞数。
1.4.5 血清IL-2 和IFN-γ 检测方法:使用IL-2和IFN-γELISA 试剂盒(购自南京森贝伽公司),按说明书操作完成血清及试剂添加,使用酶标仪(品牌:PerkinElmer、型号:EnSpire、产地:美国)检测吸光度,绘制标准曲线并计算对应IL-2 和IFN-γ 浓度。
1.5 统计学分析:采用SPSS 22 软件统计3 组大鼠体重、总淋巴细胞数、T 淋巴细胞数、CD4+淋巴细胞数、CD8+淋巴细胞数、CD4/CD8 比值、IL-2浓度和IFN-γ 浓度,组间差异采用单因素方差分析。淋巴细胞各项指标与IL-2 和IFN-γ 经验证其分布符合正态分布,相关性使用Pearson 法进行分析。P <0.05 为差异具有统计学意义。
2 结 果
2.1 一般情况:3 组大鼠于喂养21 d 后均健康存活,精神可、体力佳。给药前,CON 组、MET 组和MTD 组大鼠体重差异无统计学意义,随给药时间延长,3 组大鼠体重均逐渐升高,MET 组和MTD 组大鼠体重升高幅度小于CON 组。给药后第21 天时,CON 组和MTD 组间体重差异有统计学意义(P <0.05),CON 组和MET 组体重差异无统计学意义(P >0.05,表1)。
2.2 总淋巴细胞数和T 淋巴细胞数:3 组大鼠总淋巴细胞数和T 淋巴细胞数于给药前和给药后第 7 天差异无统计学意义(P >0.05)。MET 组和MTD 组总淋巴细胞数和T 淋巴细胞数随给药时间延长逐渐减少;CON 组和MTD 组总淋巴细胞数于给药后第14 天和第21 天差异有统计学意义(P <0.05);CON 组和MET 组总淋巴细胞数于给药后第14 天差异无统计学意义,于给药后第21 天差异有统计学意义(P <0.05)。3 组T 淋巴细胞数于给药后第7 天差异无统计学意义(P >0.05),给药后第14 天和第21 天,MET 组和MTD组与CON 组差异有统计学意义(P <0.05,表2)。MET 组和MTD 组总淋巴细胞数和T 淋巴细胞数于给药后第7 天、14 天和21 天差异均无统计学意义(P >0.05)。
2.3 CD4+和CD8+T 淋巴细胞数及CD4/CD8 比值:三组大鼠CD4+和CD8+T 淋巴细胞数在给药前差异无统计学意义(P >0.05)。MET 组和MTD 组CD4+和CD8+T 淋巴细胞数随给药时间延长,数量逐渐减少。3 组CD4+T 淋巴细胞数于给药后第7 天差异无统计学意义(P >0.05),于给药后第14 天和第21 天差异具有统计学意义(P <0.05);CON组与MTD 组相比CD8+T 淋巴细胞数于给药后第 7 天、14 天、21 天时差异有统计学意义(P <0.05);CON 组与MET 组CD8+T 淋巴细胞数于给药后第7 天差异无统计学意义(P >0.05),给药后第 14 天和21 天差异有统计学意义(P <0.05)。3 组大鼠CD4/CD8 比值在给药前、给药后第7 天、14 天、21 天差异均无统计学意义(P >0.05)(表3)。
表1 三组大鼠不同时间体重(g,±s)

表1 三组大鼠不同时间体重(g,±s)
注:与同时间CON 组相比,aP <0.05
组别 数量(只) 喂药前 第7 天 第14 天 第21 天CON 组 6 190±5.48 205.00± 5.48 221.67±7.53 235.00± 5.48 MET 组 6 190±5.48 200.83±12.81 220.00±8.94 228.33±11.69 MTD 组 6 190±6.32 193.33±17.80 207.50±19.43 214.17±20.60a
2.4 血清IL-2 和IFN-γ:3 组大鼠给药前IL-2 和IFN-γ 浓度差异无统计学意义,于给药后第7 天、14 天和21 天,MET 组和MTD 组与CON 组差异有统计学意义(P <0.05)。MET 组和MTD 组血清IL-2和IFN-γ 浓度随给药时间延长逐渐降低(表4)。
2.5 各组淋巴细胞变化和IL-2 和IFN-γ 相关性:3 组大鼠淋巴细胞总数、T 淋巴细胞总数、CD4+和CD8+T 淋巴细胞数减少与血清IL-2 和IFN-γ 下降呈正相关性(P <0.05),具体相关系数见表5。
3 讨 论
肝癌肝移植患者术后在应用免疫抑制剂预防排斥反应发生的同时需要抗肿瘤药物预防及治疗肿瘤复发。移植术后常以钙调神经磷酸酶抑制剂(calcineurin inhibitor,CNIs)联合联合霉酚酸酯为基础预防排斥反应。他克莫司进入细胞后与FKBPs结合,阻断钙调神经磷酸酶的磷酸化,抑制核因子-AT 的激活从而阻断T 细胞的活化及IL-2 的分泌,发挥免疫抑制作用[11]。霉酚酸酯在细胞内转化为霉酚酸(mycophenolic acid,MPA)抑制鸟嘌呤从头合成限速酶次黄嘌呤单核苷酸脱氢酶(inosine-5'-monophosphate dehydrogenase,IMPDH) 的活性发挥免疫抑制作用[12]。但CNIs 类药物可通过激活ras-raf 信号通路诱导转化生长因子-β(transforming growth factor-β,TGF-β) 及 血 管内 皮 生 长 因 子(vascular endothelial growth factor,VEGF)的表达促进肿瘤细胞增殖、转移,用药剂量与肿瘤复发密切相关[4,13-14]。2004 年Guba 等[15]回顾总结现有的几种免疫抑制剂发现,并非所有免疫抑制均会促进肿瘤进展,部分免疫抑制剂在发挥免疫抑制作用的同时兼具抗肿瘤作用,对移植术后肿瘤复发的预防和治疗具有重大意义。雷帕霉素阻断mTOR 信号通路抑制细胞增殖,发挥免疫抑制和抗肿瘤效果,但单一用药其抗肿瘤作用有限,且并发症较多[16]。CAP 是抗代谢药5-氟尿嘧啶 (5-FU)的前体药物[6],在体内经三步酶联反应转化为5-FU发挥细胞毒效应抑制细胞增殖、诱导细胞凋亡,胸腺嘧啶磷酸化酶(thymidine phosphorylase,TP)作为其转化关键酶在乳腺癌、结直肠癌、肝癌等癌组织中表达比正常组织更高,使其对上述肿瘤细胞具有一定靶向作用[6],对原发性肝癌有较好的治疗效果且不良反应少[17-18]。由于人体中脾脏、淋巴结和淋巴细胞中TP 活性和浓度较高,为CAP靶向性杀伤淋巴细胞提供了理论依据[19]。2006 年Schmiedt 等[20]研究显示CAP 联合环孢素及泼尼松龙能抑制狗肾移植同种异体排斥反应的发生。 因此, CAP 可能是一种具有免疫抑制效应的抗肿瘤药物。 2000 年Hanahan 等[21]提出节拍化疗 (metronomic chemotherapy,MET)即抗血管生成化疗[22]的概念,通过低剂量、高频次的方式给予抗代谢药物,作用于肿瘤周围新生血管内皮细胞,抑制新生血管形成,诱导肿瘤细胞凋亡。由于CAP的MET 和MTD 剂量对进展期肝癌均有较好的疗 效[18-23],因此,本研究采用MET 和MTD 给药剂量观察不同剂量和用药时间下CA 对大鼠免疫细胞的作用及其对机体产生的不良影响。
表2 三组大鼠不同时间总淋巴细胞及T 淋巴细胞数(个,±s)

表2 三组大鼠不同时间总淋巴细胞及T 淋巴细胞数(个,±s)
注:与同时间CON 组相比,aP <0.05
组别 数量(只)喂药前 第7 天总淋巴细胞 T 淋巴细胞 总淋巴细胞 T 淋巴细胞CON 6 2236.25±412.16 798.00±163.61 2108.83±424.57 756.75±158.99 MET 6 2352.58±342.53 808.58±173.88 2035.83±502.63 698.67±185.95 MTD 6 2255.67±420.19 867.50±136.24 1846.33±415.44 655.67±132.56组别 第14 天 第21 天总淋巴细胞 T 淋巴细胞 总淋巴细胞 T 淋巴细胞CON 2080.42±391.97 745.50±146.83 2036.08±383.36 723.92±143.23 MET 1825.08±109.37 602.25±37.89a 1515.92±532.28a 481.50±193.16a MTD 1554.67±288.89a 383.25±65.88a 1080.75±488.34a 340.83±175.70a
表3 三组大鼠不同时间CD4+、CD8+T 淋巴细胞数及CD4/CD8 比值(±s)
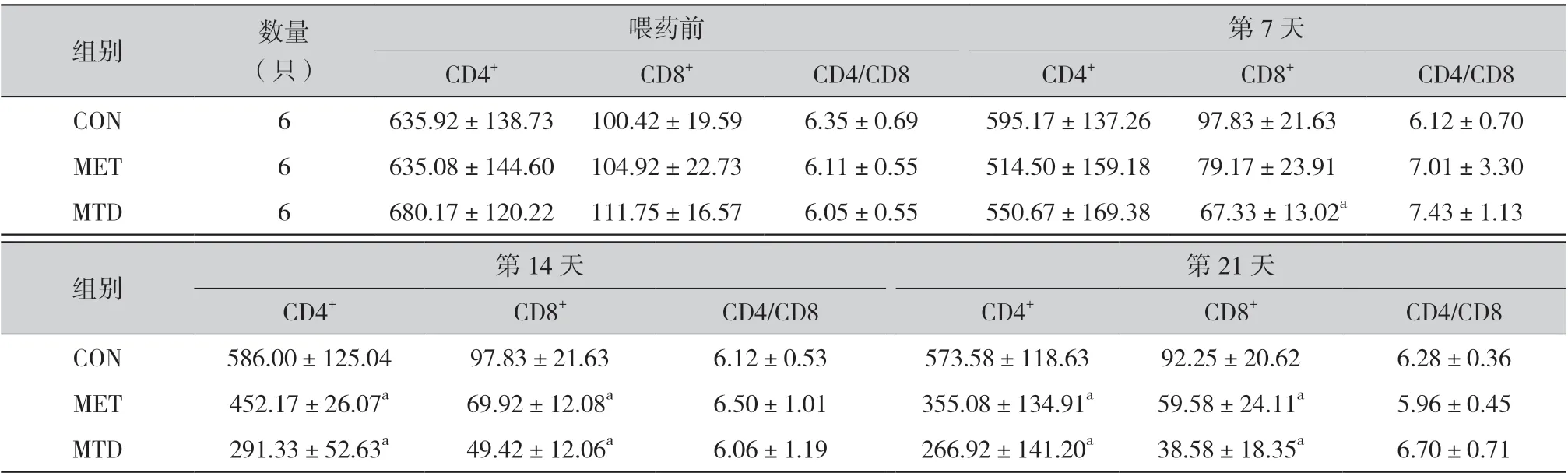
表3 三组大鼠不同时间CD4+、CD8+T 淋巴细胞数及CD4/CD8 比值(±s)
注:与同时间CON 组相比,aP <0.05
组别 数量(只)喂药前 第7 天CD4+ CD8+ CD4/CD8 CD4+ CD8+ CD4/CD8 CON 6 635.92±138.73 100.42±19.59 6.35±0.69 595.17±137.26 97.83±21.63 6.12±0.70 MET 6 635.08±144.60 104.92±22.73 6.11±0.55 514.50±159.18 79.17±23.91 7.01±3.30 MTD 6 680.17±120.22 111.75±16.57 6.05±0.55 550.67±169.38 67.33±13.02a 7.43±1.13组别 第14 天 第21 天CD4+ CD8+ CD4/CD8 CD4+ CD8+ CD4/CD8 CON 586.00±125.04 97.83±21.63 6.12±0.53 573.58±118.63 92.25±20.62 6.28±0.36 MET 452.17±26.07a 69.92±12.08a 6.50±1.01 355.08±134.91a 59.58±24.11a 5.96±0.45 MTD 291.33±52.63a 49.42±12.06a 6.06±1.19 266.92±141.20a 38.58±18.35a 6.70±0.71
表4 三组大鼠不同时间IL-2 和IFN-γ 浓度(pg/ml,±s)

表4 三组大鼠不同时间IL-2 和IFN-γ 浓度(pg/ml,±s)
注:与同时间CON 组相比,aP <0.05
喂药前 第7 天IL-2 IFN-γ IL-2 IFN-γ CON 6 77.55±12.38 164.5±12.81 83.62±8.28 164.65±11.02 MET 6 77.26±4.68 162.68±14.69 64.54±5.17a 141.8±10.21a MTD 6 79.62±5.77 162.99±20.73 62.17±3.33a 134.93±17.51a组别 数量(只)组别 第14 天 第21 天IL-2 IFN-γ IL-2 IFN-γ CON 79.16±10.71 162.64±28.2 79.53±11 165.71±28.63 MET 59.61±6.81a 134.44±27.24a 53.98±5.22a 115.48±13.64a MTD 55.81±11.46a 127.08±10.11a 55.58±3.85a 109.04±6.36a

表5 IL-2 和IFN-γ 与淋巴细胞总数、T 淋巴细胞数、CD4+、CD8+淋巴细胞数的Pearson 相关性分析
本组实验中3 组大鼠体重随喂养时间延长而逐渐增加,给药第21 天时MTD 组和MET 组体重均低于CON 组且MTD 组体重最轻。由于机体中TP 酶广泛分布,CAP 在机体组织中转化为5-FU 后产生细胞毒作用,导致正常组织损伤,引起体重增加减缓。这与Milovancev 等[24]观察到的结果一致。结果显示CAP 对机体有损害,且损害与给药剂量呈正相关性。 器官移植术后急性排斥反应多以T 细胞介导的细胞免疫为主[25]。因此,有效抑制T 淋巴细胞活化,可减少排斥反应的发生,抑制排斥反应的强度。本组实验大鼠在给予CAP 后外周血总淋巴细胞数、T 淋巴细胞数、CD4+和CD8+T 淋巴细胞数在给药第7 天、14 天及第21 天均出现减少,MTD 组的减少幅度大于MET 组,证实CAP 可杀伤淋巴细胞且与用药时间和剂量呈正相关性,与Quemeneur等[26]对5-FU 的体外实验结果相似。CAP 转化为5-FU 后在细胞内通过TP 转为脱氧氟脲苷一磷酸(FdUMP)与胸腺嘧啶合成(TS)竞争性结合抑制胸腺嘧啶的合成,阻断淋巴细胞DNA 合成抑制细胞增殖;5-FU 还可转化为脱氧氟尿苷三磷酸(FdUTP)和氟尿苷三磷酸(FUTP)渗入DNA 和RNA 中引起DNA、RNA 片段化,诱导淋巴细胞细胞凋亡[26-27]。大鼠给药后MET 组和MTD 组的CD4/CD8 比值间无显著差异,认为CAP 对T 淋巴细胞亚群并无显著的选择性杀伤作用。
本组实验中,MET 组和MTD 组在第7 天时即出现IL-2 和IFN-γ 的浓度降低且与用药时间和剂量呈正相关性。外来抗原的刺激通过钙调神经磷酸酶途径、RAS-MAPK 途径、核因子AT 途径等激活转录因子,促进IL-2 和IFN-γ 等细胞因子的合成、分泌,刺激T 细胞活化与分化,促进免疫反应和排斥的发生[28],减少IL-2 和IFN-γ 的分泌能在一定程度上控制免疫反应的发生并降低免疫反应的程度。我们通过Pearson 相关性分析得出淋巴细胞总数、T 淋巴细胞数、CD4+和CD8+T 淋巴细胞数降低与血清IL-2 和IFN-γ 浓度减少呈中等正相关性,推测是MET 组和MTD 组总淋巴细胞和T 淋巴细胞减少导致IL-2 和IFN-γ 的分泌减少。除了 T 淋巴细胞外,B 淋巴细胞和NK 细胞也参与了IL-2 和IFN-γ 的分泌,推测这两种细胞的参与使本实验中IL-2 和IFN-γ 减少曲线未完全与淋巴细胞总数、T 淋巴细胞数的降低曲线一致。我们将在未来深入研究免疫反应发生相关的B 淋巴细胞、NK细胞及其分泌的细胞因子亚群等,全面分析CAP 对各种免疫细胞及细胞因子的影响。目前我们正在进行不同剂量卡培他滨联合他克莫司对大鼠肝移植急性排斥模型免疫抑制作用的实验观察,评估二者联用对淋巴细胞、细胞因子及移植肝脏RAI 排斥活动指数的影响,探讨其在肝移植领域中的应用。
综上所述,本研究证实CAP具有杀伤T淋巴细胞、抑制IL-2 和IFN-γ 的分泌及剂量依赖性的副作用,对T 淋巴细胞的抑制强度与药物剂量有关,但差异不显著。节拍化疗剂量不良反应小于足量化疗剂量,在肝癌肝移植患者肿瘤复发的防治中具有应用价值,可作为一种具有潜在免疫抑制作用的抗肿瘤药物。
