脱落酸激素诱导拟南芥幼苗中花青素的合成
2020-10-20陈俊洁梅松胡彦如
陈俊洁 梅松 胡彦如

摘 要:脱落酸(abscisic acid,ABA)激素是一类重要的生长调节物质,参与调控植物的多种生理过程。花青素(anthocyanins)是植物次生代谢产生的类黄酮化合物,对植物的生长发育和逆境胁迫响应有重要作用。该文以拟南芥(Arabidopsis thaliana)为研究对象,探讨ABA信号对花青素生物合成的调控功能和作用机制。结果表明:外源施加ABA显著提高野生型幼苗茎尖中花青素的积累。相一致的是,ABA能诱导某些与花青素合成相关的转录因子及合成酶基因的表达。遗传学分析发现,ABA诱导花青素合成部分依赖于MBW复合体中的核心转录因子,如TTG1、TT8及MYB75等。初步機制研究揭示,ABA信号途径中的bZIP类转录因子ABI5能与TTG1、TT8及MYB75等相互作用形成蛋白复合物。综上结果认为,ABA信号诱导拟南芥幼苗中花青素的积累,并可能通过ABI5与MBW复合体协同作用调控花青素的合成。
关键词:拟南芥, 脱落酸, 花青素, ABI5转录因子, MBW复合体
中图分类号:Q943
文献标识码:A
文章编号:1000-3142(2020)08-1169-12
Abstract:Abscisic acid (ABA) is a critical phytohormone and widely modulates various biological processes in plants. Anthocyanins are flavonoids produced by plant secondary metabolism and play crucial roles in plant growth and stress responses. Recently, several transcription factors and synthetase genes involved in anthocyanins biosynthesis have been well studied; however, the upstream regulatory signals mediating their synthesis remain to be further explored. In this study, we taken Arabidopsis thaliana as the research object and investigated the function and mechanism of ABA in the control of anthocyanin biosynthesis. Phenotypic analysis showed that exogenous application of ABA significantly increased the accumulation of anthocyanins in the stem ends of wild-type A. thaliana seedlings. Consistently, ABA induced the expression of certain transcription factors and synthetase genes associated with anthocyanin synthesis. In addition, genetic analysis revealed that ABA-stimulated anthocyanin synthesis is partially dependent on core transcription factors in the MBW complex that positively regulates anthocyanin synthesis, such as TTG1, TT8, and MYB75. Preliminary mechanism studies revealed that the bZIP-type transcription factor ABI5 in the ABA signaling pathway physically interacts with TTG1, TT8 and MYB75 to form a protein complex. Taken together, this study shows that ABA signaling induces anthocyanin accumulation in A. thaliana seedlings and may regulate the synthesis of anthocyanins by synergizing the ABI5 with the MBW complex.
Key words:Arabidopsis thaliana, ABA, anthocyanin, ABI5 transcription factor, MBW complex
花青素是植物次级代谢产生的一类水溶性天然色素,属于类黄酮化合物,在食品营养和医药保健中具有重要的应用价值(Peiffer et al., 2016;Wei et al., 2018)。它广泛存在于被子植物中,是植物生长过程中形成的重要成分。花青素在提高植物耐逆境胁迫能力方面发挥重要作用,对植物生长繁殖及对环境适应有重要意义(Rowan et al., 2009;Fan et al., 2016;Liang & He,2018)。参与花青素合成途径的基因可分为结构基因和调控基因两类。结构基因包括早期生物合成基因(如CHS、CHI和F3H)和晚期生物合成基因(如DFR、ANS和UF3GT)(Tanaka et al., 2008;Zhang & Schrader,2017)。目前研究发现参与花青素合成的调控基因主要编码MYB、bHLH和WD40家族蛋白(Deng & Lu,2017;Ma & Constabel,2019)。PAP1为R2R3 MYB家族成员MYB75,它与同源蛋白PAP2/MYB90协调正调节花青素合成相关基因的表达,如PAL、CHS 和 DFR 等(Maier et al., 2013;Shin et al., 2015)。此外,Gonzalez et al.(2008)证明了MYB113或MYB114的过表达也导致拟南芥花色素的显著增加。TT8、GL3和EGL3蛋白属于bHLH家族的转录因子,均与玉米的R转录因子同源,正调控拟南芥花青素的生物合成(Baudry et al., 2004;Escaray et al., 2017)。TTG1属于WD40蛋白家族成员的PAC1进化枝,
Koornneef(1981)报道能控制种皮颜色、花青素积累、种子粘液和根毛发育等。MYB、bHLH和WD40调控因子通常形成三元MBW复合物发挥调节作用,直接调控花青素合成基因的表达,如DFR、BAN、LDOX、TT12、TT19和AHA10(Xu et al., 2014)。深入研究花青素生物合成途径及调控信号有助于人们理解植物的相关生理机制,对改良植物生长状况,提高作物经济效益具有潜在应用意义。
近年来,植物激素调控花青素的生物合成得到广泛关注。例如,通过施加外源激素可通过激活或抑制花青素合成相关基因的表达来控制水果中花青素的积累(Shen et al., 2014;Chen et al., 2016)。ABA激素是植物体内重要的生长调节物质之一,它广泛参与调控植物的各种生理过程,如胚胎发育、种子休眠与萌发、幼苗生长、根系发育、果实成熟、叶片衰老,以及对干旱、高盐、高渗透压和低温等逆境胁迫的应答反应(Nakashima & Yamaguchi-Shinozaki,2013;Dejonghe et al., 2018;Brunetti et al., 2019)。ABA信号途径关键转录因子ABI5属于bZIP家族成员,可被SnRK2激酶磷酸化,主要参与调控植物的种子萌发及萌发后生长等过程(Yu et al., 2015;Pan et al., 2018)。ABA激素能促进某些植物果实中花青素的合成和积累(Hiratsuka et al., 2001;Jiang & Joyce, 2003;Shen et al., 2014;An et al., 2018)。但是,目前关于ABA调控拟南芥花青素合成的生物学功能及分子机制仍不清楚。本研究以拟南芥为实验材料,通过遗传学和分子生物学相关的实验方法探究了ABA对拟南芥幼苗花青素的诱导作用以及其信号调控拟南芥幼苗花青素合成的分子机制。
1 材料与方法
1.1 材料及处理
所有突变体都是野生型拟南芥Columbia-0遗传背景,突变种子tt8、myb-RNAi 和 pap1-D由杨洪全教授提供。将野生型拟南芥种子与突变体种子tt8、myb-RNAi和 pap1-D,先用20%的84消毒液漂白8 min进行表面灭菌,再播种在含有0.6%琼脂和1%蔗糖的1/2 MS培养基上(pH 5.8),在4 ℃春化24 h后置于22 ℃的长日照条件下生长(光照/黑暗为16 h/8 h)。所用ABA激素从Sigma-Aldrich公司购买,Taq DNA聚合酶购自Takara Biotechnology公司,其他常用试剂购自生工生物工程(上海)股份有限公司。
1.2 ABA处理
参考An et al.(2018)的方法,将拟南芥种子播种在添加不同浓度(0、0.25、0.5、0.75 μmol·L-1)ABA的1/2 MS琼脂培养基上,4 ℃春化24 h 后置于长日照条件下,并在22 ℃生长6~12 d,观测幼苗花青素积累情况并取样用电子显微镜拍照。每个样品用ABA处理分析的生物重复不少于3个,且每个实验重复不少于3次。
1.3 花青素含量的测定
将含有0.25 μmol·L-1 ABA的1/2 MS琼脂培养基上生长的7 d龄的幼苗,包括野生型植株Col,突变体植株pap1-D、myb-RNAi和 tt8 在电子天平取样称重W(g)后加入1 mL盐酸甲醇提取物(甲醇∶盐酸体积比为99∶1),在4 ℃条件下保持在暗处振荡24 h。13 000 r·min-1离心10 min,取浸出液分别在530、657 nm波长处测量吸光度(OD值),花色素苷的相对含量用公式(A530-0.25×A657)·g-1 FW计算(Xie et al., 2016)。实验至少重复3次。
1.4 RNA提取和RT-qPCR
采用Hu & Yu(2014)的方法所述,使用Trizol试剂(Invitrogen)从拟南芥幼苗中提取总RNA后逆转录成cDNA后进行定量实时PCR(RT-qPCR)。第一链cDNA使用具有oligo(dT)18引物的M-Mu LV逆转录酶(Fermentas,EU),在20 μL反应体积中由1.5 μg DNA酶处理的RNA合成。使用2×SYBR Green I master mix在Roche Light Cycler 480实时PCR仪上进行RT-qPCR(Hu & Yu, 2014)。拟南芥ACTIN2基因用作基因表达的内参基因。每個样品用于RT-qPCR分析的生物学重复至少3个,且对每个生物学重复分析至少有2个技术重复。用于检测转录物的基因特异性引物见表1。
1.5 酵母双杂交实验 (Y2H)
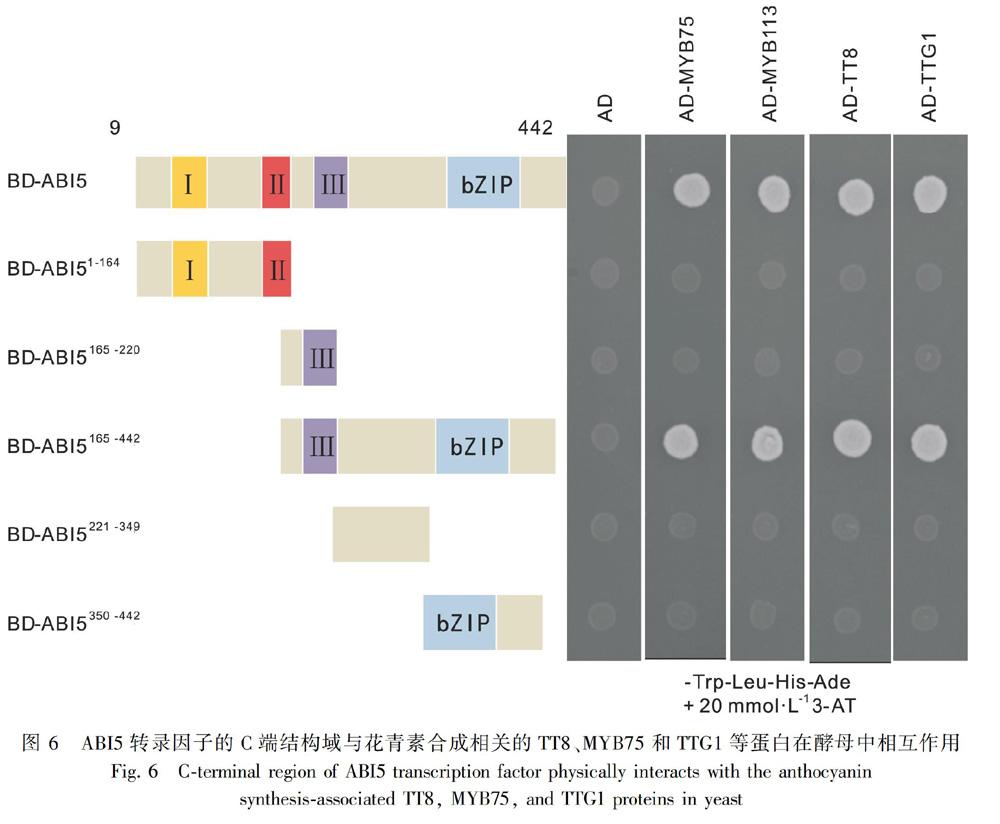
ABI5的CDs全长为1 326 bp,编码442个氨基酸。为验证ABI5蛋白与花青素合成相关蛋白的互作关系,将ABI5的全长序列克隆到pGBKT7构建质粒BD-ABI5,参考Chen et al.(2012)构建分段质粒:BD-ABI51-164、BD-ABI5165-220、BD-ABI5165-442、BD-ABI5221-349和BD-ABI5350-442。将花青素合成相关促进因子的编码序列克隆到载体pGADT7中构得质粒AD-MYB75、AD-MYB90、AD-MYB113、AD-MYB114、AD-TT8和AD-TTG1。参考Xie et al.(2016)的方法,分别将其分段为N端和C端:MYB75的第1~122个氨基酸为N端,第123~249个氨基酸为C端,构建分段质粒AD-MYB75-N和AD-MYB75-C;MYB113的第1~123个氨基酸为N端,第124~247个氨基酸为C端,构建分段质粒AD-MYB113-N和AD-MYB113-C;TT8的第1~358个氨基酸为N端,第359~519个氨基酸为C端,构建分段质粒AD-TT8-N和AD-TT8-C;TTG1的第1~174个氨基酸为N端,第175~342个氨基酸为C端,构建分段质粒AD-TTG1-N和AD-TTG1-C。将融合于不同载体的质粒进行酵母双杂交实验。用于构建各种克隆的引物见表2。
1.6 双分子荧光互补实验(BiFC Assays)
将173个氨基酸N末端增强的YFP(nYFP)和64个氨基酸C末端片段(cYFP)的cDNA序列进行PCR扩增并克隆到pFGC5941中分别产生pFGC-nYFP和pFGC-cYFP(Kim et al., 2008)。将ABI5的编码序列融合于pFGC-cYFP中构建质粒ABI5-cYFP,而MYB75、MYB90、MYB113、MYB114、TT8和TTG1的编码序列引入pFGC-nYFP以与nYFP形成N末端框内融合。将得到的质粒导入根癌土壤杆菌(菌株GV3101)中,如Hu & Yu (2014)所述进行烟草浸润,将不同质粒融合注射烟草叶片,常温放置于暗处48 h后用荧光染料染色,撕取注射叶片部分叶肉组织涂片,在共聚焦激光扫描显微镜(Olympus,Tokyo,Japan)下观察YFP和DAPI荧光。本实验中用于构建各种克隆的引物见表2。
2 结果与分析
2.1 ABA促进拟南芥幼苗中花青素的积累
将Columbia生态型背景的野生型(WT)种子播种在含有不同浓度ABA(0、0.25、0.50、0.75 μmol·L-1)的1/2 MS培养基上,验证外源施加ABA是否能诱导花青素的合成。观察到,ABA浓度的增加能诱导植物体花青素的积累,表现为幼苗茎尖颜色加深,呈现出紫红色的表型。进一步用显微镜观察ABA处理的幼苗表型,并拍摄不同天数的幼苗图片。随着ABA浓度的增加,野生型幼苗的生长越缓慢,幼苗茎尖花青素的积累越明显(图1:A)。通过测量不同浓度ABA处理的幼苗(光下生长6 d)中的花青素含量发现,野生型幼苗在不含ABA的1/2 MS板上花青素含量最低,在含0.75 μmol·L-1 ABA板上的花青素含量最高,随着ABA浓度增加花青素含量增多(图1:B)。测量结果与观察到的花青素积累表型趋势一致。这表明外源ABA处理能促进拟南芥幼苗中花青素的生物合成,从而促进其在植物体内的积累,且随着ABA浓度的增加呈递增趋势。
2.2 ABA诱导花青素合成相关基因的表达
PAL、C4H、4CL、CHS、CHI、F3H、DFR、LDOX和UF3GT等是花青素合成的关键结构基因,MYB75、MYB90、MYB113、MYB114、TT8、GL3、EGL3、TTG1、HY5和TT2是控制结构基因表达的重要调节基因,它们都参与花青素合成途径的重要酶促反应,它们的表达量上升均能导致拟南芥花青素的合成途径被激活,从而使得植物体内的花青素含量上升(Dubos et al., 2008;Gonzalez et al., 2008;Petroni & Tonelli,2011)。对不同浓度ABA诱导处理的野生型幼苗进行总RNA提取,逆转录成cDNA后进行RT-qPCR实验,检测上述所有花青素合成结构基因和调控基因的相对表达量。图2结果显示,在ABA处理的植物中,C4H、DFR、LDOX和UF3GT等花青素结构基因的表达显著增加,且随着ABA浓度增加呈正相关关系。此外,MYB75、MYB90、TT8、GL3、EGL3、TTG1、TT2和HY5等调节基因的表达水平也受ABA的诱导。这说明ABA激素能通过上调某些花青素合成相关基因的表达水平来诱导拟南芥幼苗中花青素的合成。
2.3 ABA诱导花青素的合成部分依赖于MYB75和TT8调节蛋白
本研究进一步通过遗传学实验分析了ABA促进花青素的合成是否依赖于上述调节蛋白的正常功能。我们收取同一批次的Columbia生态型背景野生型种子,花青素缺失突变体种子myb-RNAi 和tt8,以及花青素合成增强的植物种子pap1-D,播种到具有0.25 μmol·L-1 ABA浓度的1/2 MS培养基上。如图3:A所示,光下生长6 d的野生型植物幼苗茎尖呈浅紫色,而突变体植株myb-RNAi和tt8的幼苗无明显的颜色改变,整个茎尖以及叶片都为绿色;相反,pap1-D植物茎尖的颜色明显比野生型植物更深。为了进一步验证该结果, 本研究测量了相关植物中的花青素含量。图3:B结果表明,突变体植株myb-RNAi和tt8 在0.25和0.5 μmol·L-1 ABA浓度的1/2 MS培养基上的花青素含量明显比野生型植物低,而pap1-D植株的花青素含量显著高于野生型植物中的。进一步分析发现,野生型植物在0.5 μmol·L-1 ABA浓度的1/2 MS培养基上花青素与0 μmol·L-1 ABA浓度的1/2 MS培养基上花青素的比值显著高于突变体植株myb-RNAi和tt8相对应的比值(图3:C)。此外,本研究还检测了花青素合成相关结构基因(如DFR、LDOX和UF3GT)的表达量。提取0、0.5 μmol·L-1 ABA处理的野生型植物以及相关突变体植物的总RNA,逆转录成cDNA后进行RT-qPCR实验,检测它们的相对表达量。图3:D结果显示,在ABA处理的情况下,DFR、LDOX和UF3GT在突变体植株myb-RNAi 和 tt8 中的相对表达量明显低于野生型植物,而在pap1-D植株中的相对表达量明显高于野生型植物。这表明ABA促进拟南芥幼苗花青素的合成部分依赖于MYB75和TT8等调节蛋白的正常功能。
2.4 MYB75、TT8和TTG1蛋白与ABI5转录因子相互作用
为探究ABA激素调控拟南芥幼苗花青素合成的分子机理,本研究使用酵母双杂交系统检测了相关蛋白之间的相互作用关系。构建质粒BD-ABI5作为诱饵(Bait),构建质粒AD-MYB75、AD-MYB90、AD-MYB113、AD-MYB114、AD-TT8以及AD-TTG1作为潜在的互作猎物(Prey)。将相关的诱饵质粒和猎物质粒共转入酵母细胞中,图4结果显示ABI5与MYB75、MYB90、MYB113、MYB114、TT8和TTG1在酵母细胞中均有强相互作用。进一步采用双分子荧光互补实验在植物体内进行檢测分析。将ABI5与YFP蛋白的C端融合形成ABI5-cYFP,将MYB75、MYB113、TT8和TTG1分别与YFP蛋白的N端融合形成MYB75-nYFP、MYB113-nYFP、TT8-nYFP和TTG1-nYFP。当ABI5-cYFP与MYB75-nYFP、MYB113-nYFP、TT8-nYFP或TTG1-nYFP被共转化到烟草叶片中时,能观察到强的YFP荧光信号(图5)。与此对应的是,在相关的对照组中未能观察到任何荧光信号(图5)。这表明ABI5转录因子能与花青素合成相关的MYB75、TT8和TTG1等调节蛋白相互作用形成复合物。
2.5 MYB75、TT8和TTG1蛋白与ABI5转录因子的C端结构域相互作用
将ABI5突变成若干区段,并构建成相应的诱饵质粒(图6)。酵母双杂交实验发现,ABI5转录因子的C端278个氨基酸(含保守的bZIP结构域)对于它与MYB75、TT8和TTG1等调节蛋白的相互作用是必须的。如图6所示,当ABI5转录因子缺失C端278个氨基酸时,它不能与MYB75、TT8和TTG1等调节蛋白相互作用;相反,当ABI5转录因子缺失N端164个氨基酸时,它仍然可以与MYB75、TT8和TTG1等调节蛋白的相互作用。这表明ABI5的C端氨基酸结构域介导了它与MYB75、TT8和TTG1等调节蛋白之间的相互作用。
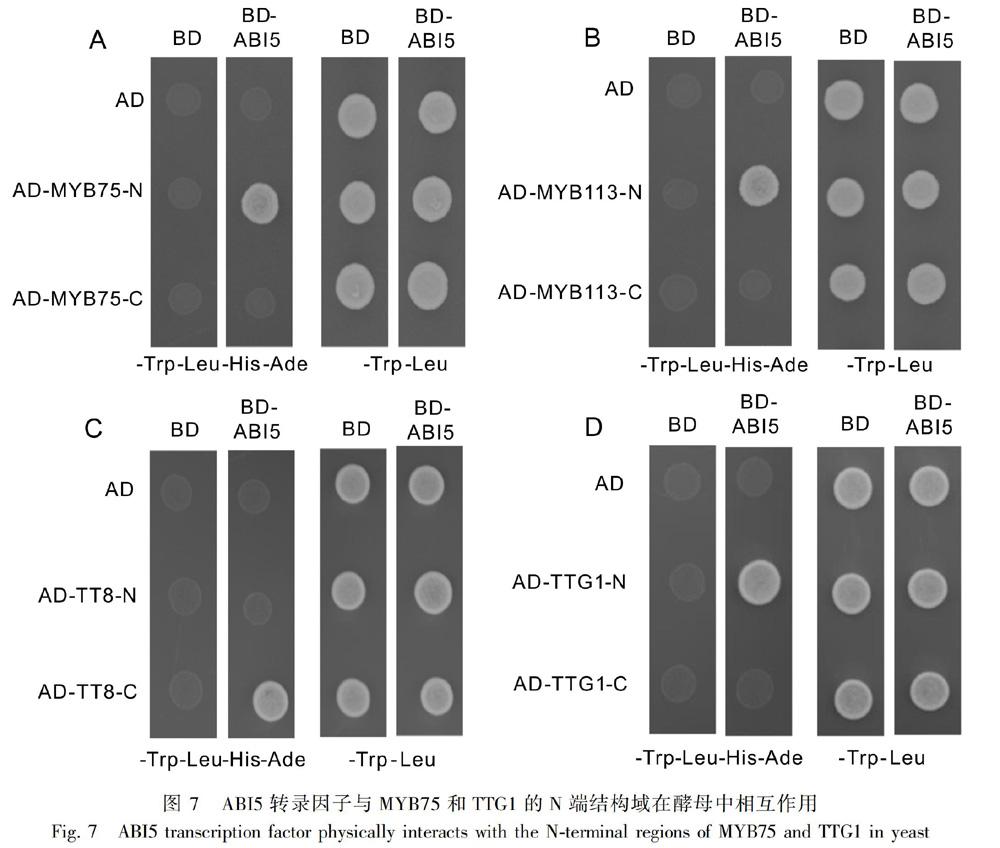
2.6 ABI5转录因子与MYB7、MYB113和TTG1的N端以及TT8的C端结构域相互作用
分别将MYB75、MYB113、TT8和TTG1等蛋白突变为N端和C端,并构建成相应的猎物质粒(图7)。酵母双杂交实验发现,MYB7、MYB113和TTG1的N端对于它们与ABI5转录因子的相互作用是非常重要的,当MYB7、MYB113和TTG1的N端缺失时,它们不能与ABI5相互作用(图7)。相反,TT8蛋白的C端对于它与ABI5转录因子的相互作用是必须的,当TT8的C端缺失时,它不能与ABI5相互作用(图7)。
3 讨论与结论
在ABA核心信号通路中,ABA结合PYR/PYL/RCAR等受体蛋白从而诱导后者的构象变化,稳定ABA受体和PP2C磷酸酶之间的相互作用,导致PP2C失活和SNF1相关蛋白激酶(SnRK2)的去阻遏。随后,SnRK2磷酸化并激活许多下游信号组分,如ABI5转录因子、离子通道和NADPH氧化酶等,以实现非生物胁迫耐受(Fujii & Zhu,2009;Park et al., 2009;Bauer et al., 2013;Yu & Xie,2017)。此外,ABA激素能促进某些植物果实中花青素的合成和积累,从而影响果实的品质(Koyama et al., 2010;Jia et al., 2011;Shen et al., 2014;An et al., 2018)。例如,ABA作为信号分子调控花青素合成,发挥促进甜樱桃果实成熟的作用(Shen et al., 2014)。同样,在葡萄果皮和细胞悬浮系中,外源施加ABA可以诱导多个花青素合成结构基因和调节基因的表达,促进花青素的积累(Jeong et al., 2004;Gagné et al., 2011)。在An et al.(2018)的研究中,他们发现苹果MYB转录因子MdMYB1激活花青素生物合成基因的表达也响应ABA。Loreti et al.(2008)发现ABA可以增强蔗糖诱导拟南芥中花青素的合成和积累,表明ABA和蔗糖对花青素的合成具有协同激活作用。已有少数研究表明ABA与植物色素或果皮颜色等存在内在联系,但ABA调控拟南芥花青素合成的生物学功能和分子机理仍有待深入研究。
本研究发现,ABA处理能促进拟南芥野生型幼苗花青素的积累,花青素含量测定结果也验证了同样的结论。通过分析相关基因的表达情况,实验结果表明在ABA处理的野生型植物中,C4H、DFR、LDOX和UF3GT等花青素结构基因的表达显著增加,并且随着ABA浓度增加呈正相关关系。除此之外,MYB75、MYB90、TT8、GL3、EGL3、TTG1、TT2和HY5等调节基因的表达水平也受ABA的诱导。这说明ABA激素能够通过上调花青素合成相关基因的表达水平来诱导拟南芥幼苗中花青素的合成。本研究进一步对花青素合成相关的突变体植物,如myb-RNAi、tt8和pap1-D,进行了外源ABA激素处理。通过表型分析发现,突变体植株myb-RNAi和tt8的花青素含量明显比野生型植物低,而pap1-D植株的花青素含量显著高于野生型植物中的。与此相一致的是在ABA处理的情况下,DFR、LDOX和UF3GT等结构基因在突变体植株myb-RNAi和tt8中的相对表达量明显较野生型植物低,而在pap1-D植株中的相对表达量明显较野生型植物高。综上所述,本研究认为ABA激素诱导拟南芥幼苗中花青素的合成可能需要MYB75和TT8等调节蛋白。
ABI5转录因子是植物ABA信号转导途径中的关键转录因子之一,可以参与调控植物种子萌发以及幼苗生长等生理过程(Finkelstein,2006;Pan et al., 2018),还可通过与其他蛋白相互作用介导不同信号途径之间的交互作用(Yu et al., 2015)。ABA是否通过ABI5与花青素合成调控因子(如MYB75、TT8和TTG1等)之间发生相互作用,从而影响花青素的生物合成。本研究中,ABI5转录因子确实能与花青素合成相关的重要调节蛋白相互作用,如MYB类的MYB75、MYB90、MYB13和MYB114,bHLH类的TT8,以及WD40类的TTG1。通过进行分段实验验证了ABI5与花青素合成相关调节蛋白发生相互作用的具体氨基酸结构域。这表明ABI5转录因子的C端278个氨基酸(含保守的bZIP结构域)对于它与MYB75、TT8和TTG1等调节蛋白的相互作用是非常重要的。当ABI5转录因子缺失C端278个氨基酸时,它不能与MYB75、TT8和TTG1等调节蛋白相互作用。本研究還进一步明确了ABI5转录因子与MYB75、MYB113和TTG1的N端以及TT8的C端相互作用。因此,本研究认为ABA信号途径中的bZIP类转录因子ABI5能与花青合成相关的MYB75、TT8及TTG1等蛋白相互作用形成复合物。将来通过详细分析ABI5转录因子相关的突变体或高表达转基因植物有望进一步明确ABI5转录因子调控花青素合成的功能及可能的分子机理。本研究初步揭示了ABA信号途径与花青素合成之间的内在联系,进一步研究将揭示ABA诱导拟南芥幼苗花青素合成的调控机制。
參考文献:
AN JP, YAO JF, XU RR, et al., 2018. Apple bZIP transcription factor MdbZIP44 regulates abscisic acid-promoted anthocyanin accumulation [J]. Plant Cell Environ, 41(11):2678-2692.
BAUDRY A, HEIM MA, DUBREUCQ B, et al., 2004. TT2, TT8, and TTG1 synergistically specify the expression of BANYULS and proanthocyanidin biosynthesis in Arabidopsis thaliana [J]. Plant J, 39(3):366-380.
BAUER H, ACHE P, LAUTNER S, et al., 2013. The stomatal response to reduced relative humidity requires guard cell-autonomous ABA synthesis [J]. Curr Biol, 23(1):53-57.
CHEN JX, MAO LC, MI HB, et al., 2016. Involvement of abscisic acid in postharvest water-deficit stress associated with the accumulation of anthocyanins in strawberry fruit [J]. Postharvest Biol Technol, 111:99-105.
CHEN R, JIANG HL, LI L, et al., 2012. The Arabidopsis mediator subunit MED25 differentially regulates jasmonate and abscisic acid signaling through interacting with the MYC2 and ABI5 transcription factors [J]. Plant Cell, 24(7):2898-2916.
DEJONGHE W, OKAMOTO M, CUTLER SR, 2018. Small molecule probes of ABA biosynthesis and signaling [J]. Plant Cell Physiol, 59(8):1490-1499.
DENG YX, LU SF, 2017. Biosynthesis andregulation of phenylpropanoids in plants [J]. Crit Rev Plant Sci, 36(4):257-290.
DUBOS C, LE GOURRIEREC JL, BAUDRY A, et al., 2008. MYBL2 is a new regulator of flavonoid biosynthesis in Arabidopsis thaliana [J]. Plant J, 55(6):940-953.
ESCARAY FJ, PASSERI V, PEREA-GARCIA A, et al., 2017. The R2R3-MYB TT2b and the bHLH TT8 genes are the major regulators of proanthocyanidin biosynthesis in the leaves of Lotus species [J]. Planta, 246(2):243-261.
FAN XP, FAN BH, WANG YX, et al., 2016. Anthocyanin accumulation enhanced in Lc-transgenic cotton under light and increased resistance to bollworm [J]. Plant Biotechnol Rep, 10:1-11.
FANG HC, DONG YH, YUE XX, et al., 2019. The B-box zinc finger protein MdBBX20 integrates anthocyanin accumulation in response to ultraviolet radiation and low temperature [J]. Plant Cell Environ, (1365-3040) (Electronic):T-aheadofprint.
FINKELSTEIN RR, 2006. Studies of abscisic acid perception finally flower [J]. Plant Cell, 18(4):786-791.
FUJII H, ZHU JK, 2009. Arabidopsis mutant deficient in 3 abscisic acid-activated protein kinases reveals critical roles in growth, reproduction, and stress [J]. Proc Natl Acad Sci USA, 106(20):8380-8385.
GAGNE S, CLUZET S, MERILLON JM, et al., 2011. ABA initiates anthocyanin production in grape cell cultures [J]. J Plant Growth Regul, 30 (1):1-10.
GONZALEZ A, ZHAO MZ, LEAVITT JM, et al., 2008. Regulation of the anthocyanin biosynthetic pathway by the TTG1/bHLH/Myb transcriptional complex in Arabidopsis seedlings [J]. Plant J, 53(5):814-827.
HIRATSUKA S, ONODERA H, KAWAI Y, et al., 2001. ABA and sugar effects on anthocyanin formation in grape berry cultured in vitro [J]. Sci Hortic, 90(1-2):121-130.
HU YR, YU DQ, 2014. Brassinosteroid insensitive 2 interacts with abscisic acid insensitive 5 to mediate the antagonism of brassinosteroids to abscisic acid during seed germination in Arabidopsis [J]. Plant Cell, 26(11):4394-4408.
JEONG ST, GOTO-YAMAMOTO N, KOBAYASHI S, et al., 2004. Effects of plant hormones and shading on the accumulation of anthocyanins and the expression of anthocyanin biosynthetic genes in grape berry skins [J]. Plant Sci, 167(2): 247-252.
JIA HF, CHAI YM, LI CL, et al., 2011. Abscisic acid plays an important role in the regulation of strawberry fruit ripening [J]. Plant Physiol, 157(1):188-199.
JIANG YM, JOYCE DC, 2003. ABA effects on ethylene production, PAL activity, anthocyanin and phenolic contents of strawberry fruit [J]. Plant Growth Regul, 39(2):171-174.
KOORNNEEF M, 1981. The complex syndrome of ttg mutanis [J]. Arabidopsis Inf Serv, 18(1981):45-51.
KOYAMA K, SADAMATSU K, GOTO-YAMAMOTO N, 2010. Abscisic acid stimulated ripening and gene expression in berry skins of the Cabernet sauvignon grape [J]. Funct Integr Genomics, 10(3):367-381.
LIANG J, HE JX, 2018. Protective role of anthocyanins in plants under low nitrogen stress [J]. Biochem Biophys Res Commun, 498(4):946-953.
LORETI E, POVERO G, NOVI G, et al., 2008. Gibberellins, jasmonate and abscisic acid modulate the sucrose-induced expression of anthocyanin biosynthetic genes in Arabidopsis [J]. New Phytol, 179(4):1004-1016.
MA D, CONSTABEL CP, 2019. MYB repressors as regulators of phenylpropanoid metabolism in plants [J]. Trends Plant Sci, 24(3):275-289.
MAIER A, SCHRADER A, KOKKELINK L, et al., 2013. Light and the E3 ubiquitin ligase COP1/SPA control the protein stability of the MYB transcription factors PAP1 and PAP2 involved in anthocyanin accumulation in Arabidopsis [J]. Plant J, 74(4):638-651.
NAKASHIMA K, YAMAGUCHI-SHINOZAKI K, 2013.ABA signaling in stress-response and seed development [J]. Plant Cell Rep, 32(7):959-970.
PAN JJ, WANG HP, HU YR, et al., 2018. Arabidopsis VQ18 and VQ26 proteins interact with ABI5 transcription factor to negatively modulate ABA response during seed germination [J]. Plant J Cell Mol Biol, 95(3):529-544.
PARK SY, FUNG P, NISHIMURA N, et al., 2009. Abscisic acid inhibits type 2C protein phosphatases via the PYR/PYL family of START proteins [J]. Science, 324(5930):1068-1071.
PEIFFER DS, WANG LS, ZIMMERMAN NP, et al., 2016. Dietary consumption of black raspberries or their anthocyanin constituents alters innate immune cell trafficking in esophageal cancer [J]. Cancer Immunol Res, 4(1):72-82.
PETRONI K, TONELLI C, 2011. Recent advances on the regulation of anthocyanin synthesis in reproductive organs [J]. Plant Sci, 181(3):219-229.
ROWAN DD,CAO MS, WANG KL, et al., 2009. Environmental regulation of leaf colour in red 35S:PAP1 Arabidopsis thaliana [J]. New Phytol, 182(1):102-115.
SHEN XJ, ZHAO K, LIU LL, et al., 2014. A role for PacMYBA in ABA-regulated anthocyanin biosynthesis in red-colored sweet cherry cv. Hong Deng (Prunus avium L.) [J]. Plant Cell Physiol, 55(5):862-880.
SHIN DH, CHO M, CHOI MG, et al., 2015. Identification of genes that may regulate the expression of the transcription factor production of anthocyanin pigment 1 PAP1/MYB75 involved in Arabidopsis anthocyanin biosynthesis [J]. Plant Cell Rep, 34(5):805-815.
TANAKA Y, SASAKI N, OHMIYA A, 2008. Biosynthesis of plant pigments:anthocyanins, betalains and carotenoids [J]. Plant J, 54(4):733-749.
WEI JY, WU HJ, ZHANG HQ, et al., 2018. Anthocyanins inhibit high glucose-induced renal tubular cell apoptosis caused by oxidative stress in db/db mice [J]. Int J Mol Med, 41(3):1608-1618.
XIE Y, TAN HJ, MA ZX, et al., 2016. DELLA proteins promote anthocyanin biosynthesis via sequestering MYBL2 and JAZ suppressors of the MYB/bHLH/WD40 complex in Arabidopsis thaliana [J]. Mol Plant, 9(5):711-721.
XU WJ, GRAIN D, BOBET S, et al., 2014. Complexity and robustness of the flavonoid transcriptional regulatory network revealed by comprehensive analyses of MYB-bHLH-WDR complexes and their targets in Arabidopsis seed [J]. New Phytol, 202(1):132-144.
YU FF, WU YR, XIE Q, 2015. Precise protein post-translational modifications modulate ABI5 activity [J]. Trends Plant Sci, 20(9):569-575.
YU FF, XIE Q, 2017. Non-26S proteasome endomembrane trafficking pathways in ABA signaling [J]. Trends Plant Sci, 22(11):976-985.
ZHANG BP, SCHRADER A, 2017.
Transparent Testa Glabra 1-dependent regulation of flavonoid biosynthesis [J]. Plants (Basel), 6(4):65.
ZHAO DQ, TAO J, 2015. Recent advances on the development and regulation of flower color in ornamental plants [J]. Front Plant Sci, 6:261.
(責任编辑 周翠鸣)
