栓皮栎根系解剖结构、水力特性及碳、氮含量研究
2020-10-20舒李祥席国荣李月娥王晓雪马闯王博琳
舒李祥 席国荣 李月娥 王晓雪 马闯 王博琳
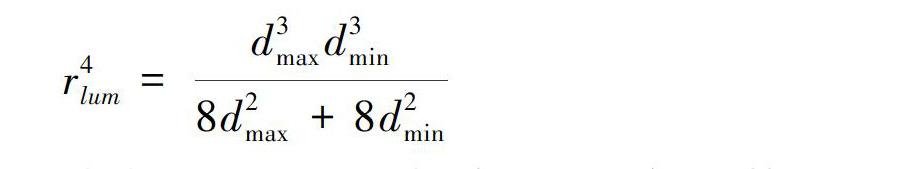
摘 要:為阐明栓皮栎根系随径级的变化规律,探究其细根的合理划分标准。以1年生栓皮栎幼苗为研究对象,将其根系分为1、1~
2、2~3、3~4 mm四个径级,分别制作石蜡切片观察解剖结构,比较木质部水力特性,测定碳氮含量及其比值,并采用主成分法对根系进行分类。结果表明:(1)随着径级增加,栓皮栎根系周皮、韧皮部和形成层组织厚度增加而占径比降低,木质部直径及其占径比均增加。(2)直径2 mm以上的栓皮栎根系木质部平均最大和最小导管直径、根比导水率和栓塞脆弱性指数增加显著;而导管密度显著下降,导管面积与木质部面积之比变化不显著。(3)直径2 mm以上栓皮栎根系碳含量表现出显著增加,随着径级增加,根系氮含量下降、碳氮比升高。(4)主成分分析表明,13项根系结构和元素含量指标降维后,前2个主分量方差贡献率达62%,PCA双序轴显示栓皮栎根系可划分为2 mm以下的吸收根群和2 mm以上的运输根群。综上认为,以2 mm作为栓皮栎细根划分的标准兼顾了形态和功能的特点,更具有准确性。
关键词:细根, 木质部, 比导水率, 栓塞脆弱性,碳氮比
中图分类号:Q945; S718. 41
文献标识码:A
文章编号:1000-3142(2020)08-1203-08
Abstract:To explore the dynamic of internal structure of Quercus variabilis roots with increasing diameter and detect the rational criteria for the division of its roots, the roots of one-year-old Q. variabilis seedlings were divided into four diameter classes:1 mm, 1-2 mm, 2-3 mm and 3-4 mm. These roots were made paraffin sections separately to observe anatomical structure and determine hydraulic traits of xylem. The carbon and nitrogen content were detected with carbon/nitrogen ratios. These roots were divided by principal component method. The results were as follows:(1) The thickness of periderm, phloem and cambium of Q. variabilis roots increased with the increase of diameter class, while their percentage decreased. The diameter and percentage of xylem showed the increasing trend. (2) The mean maximum and minimum vessel diameters, root specific hydraulic conductivity and embolism vulnerability index of xylem increased significantly in the roots with the diameter above 2 mm. The vessel density decreased and the percentage of vessel area to xylem area altered without significance. (3) The carbon content in the roots with the diameter above 2 mm increased significantly. With the increase of diameter class, the root nitrogen content decreased and the carbon/nitrogen ratio increased. (4) The principal component analysis showed that the variance contribution of the first two principal components reached 62% after dimensionality reduction of 13 root structure and element content indexes. PCA biplot indicated that the roots of Q. variabilis were divided into two groups:absorbing root group in diameter below 2 mm and transporting root group above 2 mm. It is concluded that 2 mm is the criterion for fine root classification of Q. variabilis, which is more accurate with both morphological and functional characteristics.
Key words:fine roots, xylem, specific hydraulic conductivity, embolism vulnerability, caron/nitrogen ratio
树木根系是由形态和生理功能高度异质性的个体根组成的集群(Wells & Eissenstat, 2002;Guo et al., 2004)。其中,细根占根系总生物量的3%~30%,却周转消耗了林分净生产力的10%~75% (Jackson et al., 1997)。细根的划分是研究其生理和生态功能的前提。Wang et al.(2006)采用根序法研究落叶松(Larix gmelinii)和水曲柳(Fraxinus mandshurica)的细根分支结构和形态,Xiao et al.(2008)采用径级法研究白桦(Betula platyphylla)细根生产力和周转速率。在栎类树种方面,张志铭等(2010)将宝天曼保护区栎林细根划分为4个径级,刘建军等(2002)采用5 mm对锐齿栎(Quercus aliena var. acuteserrata)细根进行划分。然而,这些划分仅依据着生位置或形态,缺乏对内部结构的差异性分析。因此,有必要从解剖结构和水力特性角度,探讨根系直径与功能的关系,进一步丰富植物细根的理论研究。
栓皮栎(Quercus variabilis)在我国分布广泛(99°—122°E,22°—42°N),不仅耐贫瘠、抗旱、抗风沙,是重要的造林树种,而且可用于生产软木、栲胶,是重要的经济树种(张文辉等, 2004;周建云等, 2010)。在栓皮栎根系研究方面,吴敏等(2014)测定了干旱胁迫下根系的保护酶活性,马闯等(2013)分析了不同地理分布栓皮栎幼苗根系形态的差异,而有关其根系解剖结构和水力特性的研究还未见报道。栓皮栎是我国落叶栎类的代表性树种,通过对其研究可以有效阐明栎类树种根系的结构特点和生长规律,指导造林实践。因此,本研究以栓皮栎为例,分析其前4级根系的解剖结构、水力特性以及碳氮含量,目的是探究栓皮栎根系的内部结构随直径变化规律,对理解木本植物根系发育特点具有重大意义。
1 材料与方法
1.1 样品采集
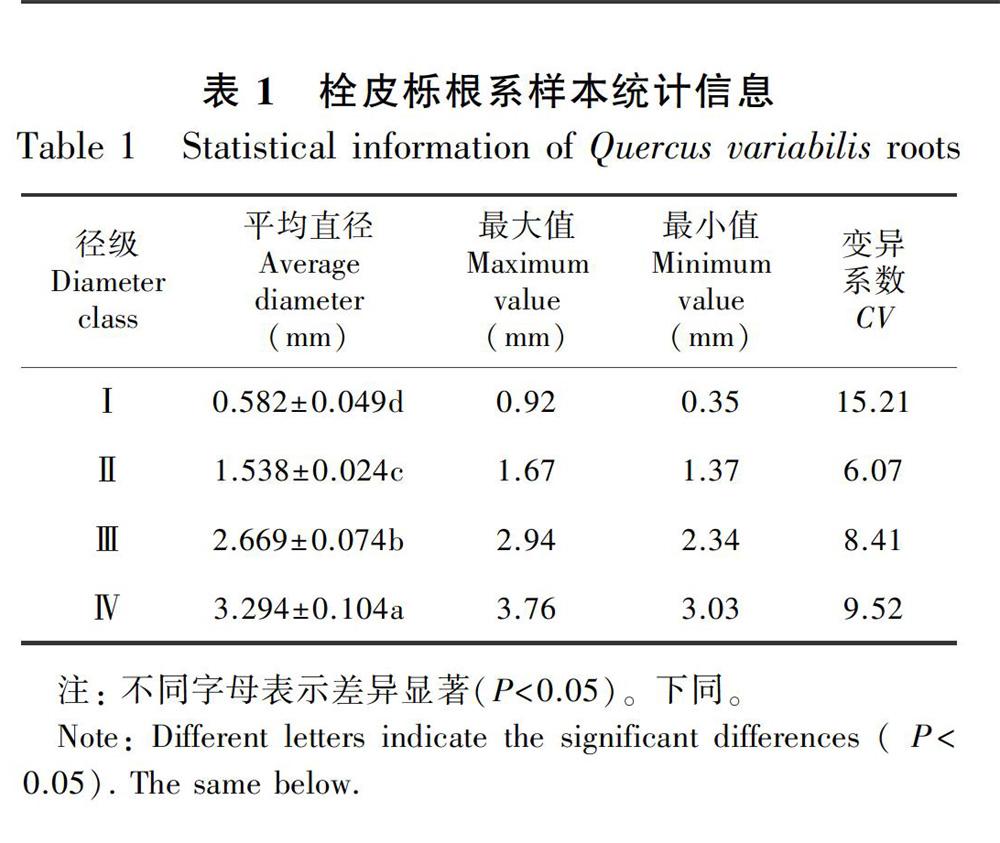
以盆栽1年生栓皮栎实生苗为材料。2017年4月,挑选饱满栓皮栎种子播种于大小一致花盆中,培养基质采用蛭石和营养土按1∶1比例混合。将幼苗置于天津农学院温室,受自然光照,昼夜平均温度21.2~28.9 ℃、平均湿度25.1%~30.8%。2017年9月,选择高度和地径一致的健康栓皮栎幼苗10株,将幼苗根系完整取出并冲洗干净,取较细的前端根系按1 mm径级距划分为Ⅰ≤1 mm、1<Ⅱ≤2 mm、2<Ⅲ≤3 mm、3<Ⅳ≤4 mm四个径级(表1),用于制作石蜡切片。另取不同径级根系样品杀青(70 ℃,5 min),低温保存,用于测定碳、氮含量。
1.2 石蜡切片制作
每个径级截取若干根段分别放入FAA固定液 (FAA:70 %酒精90 mL+乙酸5 mL+福尔马林5 mL) 中保存,后经苯胺番红整染、酒精脱水、二甲苯透明、浸蜡、透蜡、石蜡包埋等步骤(李和平,2009)。采用Leica RM2235 切片机切片,切片厚度为8 μm,经高浓度到低浓度的逐级乙醇复水、苯胺番红—固绿复染后脱水透明,最后用加拿大树胶封片,烘片后保存并观察(杨美玲等, 2015)。
1.3 解剖结构指标测定
采用Leica DM4000B生物显微镜观察,Leica DFC450 CCD数码成像系统拍照,使用Motic 3000 成像系统测量栓皮栎根的周皮、韧皮部、形成层和木质部等组织厚度。组织占径比为各组织的厚度与根直径的比值(张瑞群等, 2016)。
1.4 水力特性测定
采用I-mage软件对石蜡切片木质部水力特性指标分析,测定平均最大导管直径(dmax),平均最小导管直径(dmin)、导管密度(单位根木质部横截面积上的导管数,VD)、导管面积占整个根木质部横截面积的比例(Aves/Axyl,%)。根比导水率Khp (kg·m-1·s-1·MPa-1)利用Hagen-Poiseuille 公式(Tyree & Ewers, 1991)计算:
式中:ρ为水在 20 ℃时的密度(998.205 kg·m-3);η为水在20 ℃时的粘滞系数(1.002×10-9 MPa·s-1)。木质部导管横截面按近似椭圆形计算,其修正公式(Martre et al., 2010)如下:
1.5 碳、氮含量测定
取杀青后的根系样品放入FW100型高速万能粉碎机中粉碎,粉碎直径为100目。取10 mg粉碎后样品,放入VarioELⅢ型元素分析仪(德国Elementar公司)中测量样品的碳、氮含量(殷鸣放等, 2008)。
1.6 数据处理
采用SPSS18.0对不同径级根系解剖结构、水力特性及碳氮含量等指标进行一维方差检验(ANOVA Duncan α=0.05),使用Sigmaplot 13.0绘图。采用Canoco 5.0对反映根系结构和元素含量的13项指标进行主成分分析(PCA),并绘制双序图。
2 结果与分析
2.1 不同径级栓皮栎根系解剖结构
栓皮栎属典型的直根系树种,木质化程度高。观察发现,栓皮栎根系在0.3 ~0.7 mm之间表现出初生结构向次生结构的过渡现象,其表皮和皮层逐渐被周皮所取代,并随着根径级的增加而加厚(表2)。其中,與直径≤1 mm根系相比,直径1~2、2~3和3~4 mm根系的周皮厚度分别增加了80.65%、71.33%和116.21%,差异显著。周皮占径比在根系直径2 mm以上时表现出显著下降。周皮厚度增加有利于提高植物抵御不良环境和病虫害侵扰的能力,但阻碍了土壤与根系的物质交换。
植物根系维管柱由韧皮部、维管形成层和木质部组成。随着径级的增加,栓皮栎根系韧皮部厚度呈增加趋势,而占径比逐渐降低(表2)。与直径≤1 mm根系相比,直径1~2、2~3和3~4 mm根系的韧皮部平均厚度分别增加了60.03%、179.71%和181.76%,差异均显著。韧皮部占径比在3 mm以上根系中下降显著。栓皮栎根系木质部直径及其占径比均随着径级增加而增加(表2)。与直径≤1 mm根系相比,木质部直径分别增加了1.8倍、3.2倍和4.2倍,差异显著。栓皮栎根系维管形成层厚度在直径1 mm以上根中无差异。
2.2 不同径级栓皮栎根系水力特性
由图1:A,B可知,栓皮栎根系平均最大和最小导管直径随根径级增加而增加。与直径≤1 mm根系相比,直径1~2、2~3、3~4 mm根系平均最大导管直径分别增加了10.9%、23.4%和41.9%,差异显著。而径级2 mm以上的根系平均最小导管直径无差异。
导管密度随栓皮栎根系直径增加呈下降趋势(图1:C)。与直径≤1 mm根系相比,直径1~2 mm根系导管密度变化无差异,而直径2~3和3~4 mm根系分别下降了33.9%和27.8%。根系的导管面积与木质部面积之比在不同径级根系间无显著差异(图1:D)。
根比导水率是指单位根木质部面积单位压力梯度下的水流通量,反映了根木质部中的水分传输效率。随着根系径级增加,栓皮栎根比导水率和栓塞脆弱性指数均呈增加趋势(图1:E,F)。与直径≤1 mm根系相比,直径1~2、2~3、3~4 mm根比导水率分别增加了92.7%、230.8%和280.6%,而栓塞脆弱性指数分别增加了48.5%、76.2%和103.3%。说明随着根系的增粗,水分和矿质元素的输送能力增强。
2.3 不同径级栓皮栎根系碳、氮含量及碳氮比
碳、氮均是构建植物组织结构和生理代谢所需的大量元素。由表3可知,栓皮栎根系的碳含量随着根直径的增加而增加,但2 mm以下根系碳含量无显著差异。而根系中氮含量随直径增加呈下降趋势,且直径大于2 mm的根系氮含量无显著差异。栓皮栎根系的碳氮比随着根直径的增加而增加,与直径≤1 mm根系相比,直径1~2、2~3、3~4 mm根系碳氮比分别增加了30.1%、30.5%和49.5%,差异显著。说明不同径级的根系所需的元素含量有所区别。
2.4 主成分分析
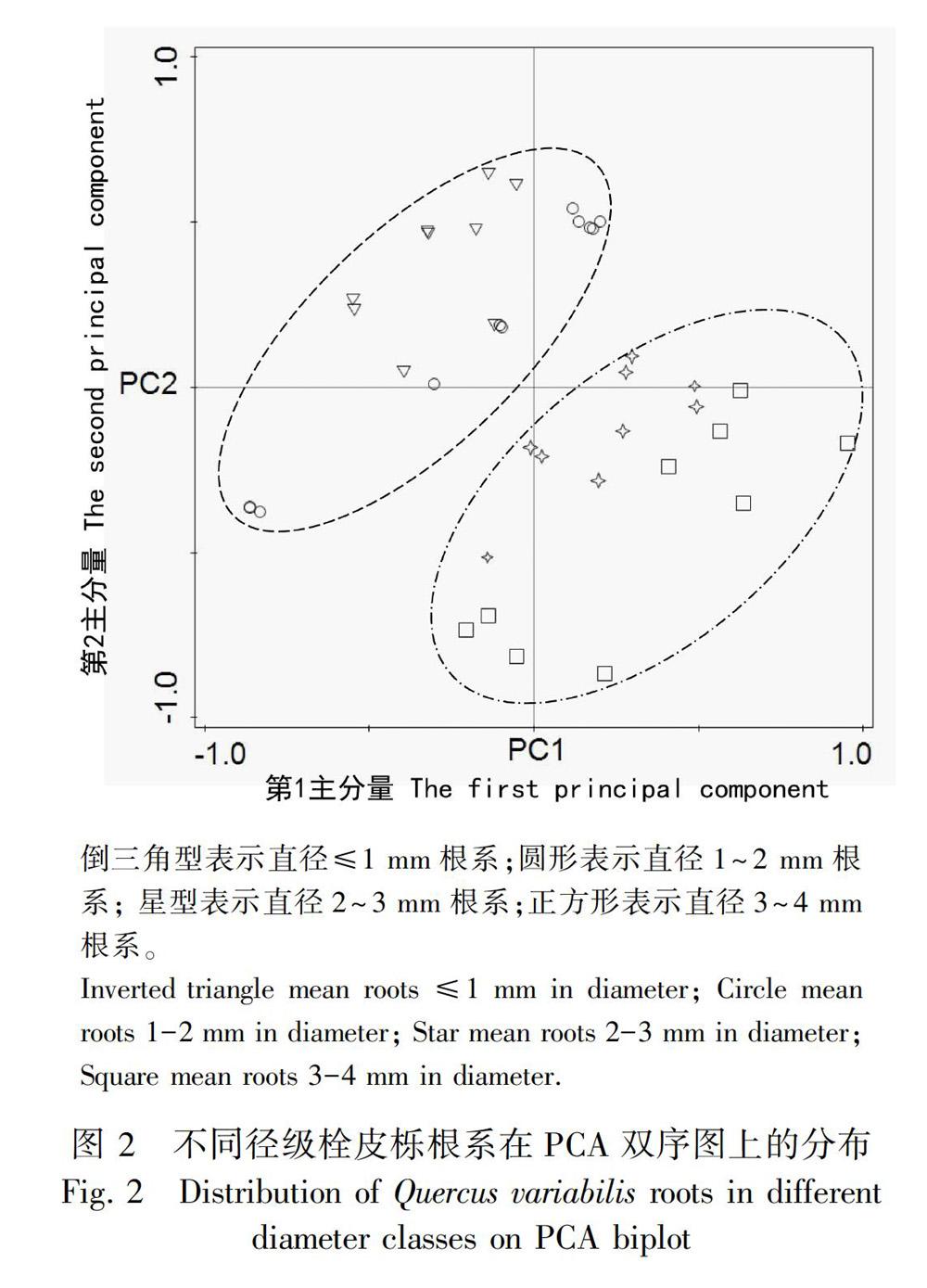
采用主成分的方法对反映栓皮栎根系结构和元素含量的13项指标降维,得出因子载荷的分布结果如表4所示。前2个主分量能够解释根系变异方差的62%。其中,根比导水率、最大导管直径、栓塞脆弱性指数以及木质部和韧皮部厚度对第1主分量贡献较大,反映了水分的轴向运输能力在根系功能中起主导作用。氮含量对第2主分量的贡献较大,且呈正相关,表明根系在该主分量得分越高,其呼吸代谢和吸收能力越强。
根据不同径级根系相关指标在前2主分量的得分绘制而成PCA双序图。由图2可知,直径≤1 mm和1~2 mm的根系主要分布在第2象限,第1、第3象限仅有少量分布,说明其组织结构有利于维持低的疏导能力和高的吸收能力。直径2~3和3~4 mm根系分布主要集中在第4象限,而第1、第3象限有少量分布,表明其结构更倾向提高水分在根系中的运输效率而降低生理代谢水平。
3 讨论与结论
3.1 栓皮栎根系解剖结构的差异分析
根系的内部結构决定了其功能的差异。一般认为,细根主要起吸收作用,而粗根负责水分和矿质元素的运输 (Pregitzer et al., 2002; 王向荣等, 2005)。在本研究中,根系各组织的厚度均随径级的增加而增加,但周皮、形成层和韧皮部对根系增粗的贡献比例逐渐下降,木质部的贡献比例增强。这种结构上的变化反映了根系功能上的转变。随着根系的增粗,更多的物质和能量分配给疏导组织,用于加强轴向的输送能力。卫星等(2008)研究黄波罗(Phellodendron amurense)细根时,也发现根系直径的大小与维管束直径的增加呈正相关。维管形成层与木栓形成层的活动是根系直径增加的主要因素,特别是前者的活跃程度决定了根系疏导组织的生长。然而,刘冠志等(2014)发现低级根的直径不仅与通道细胞数量有关,还与皮层细胞直径和层数有关。这可能与低级根的增粗主要与初生生长有关。因此,直径的变化能在一定程度上反映根系的发育水平。
3.2 不同径级栓皮栎根系水力特性的差异
木质部的水力特性,如导管内径、导管密度以及穿孔、纹孔的形态等,决定了水分和矿质元素在根系中的运输效率(Tyree & Ewers, 2010; Hacke et al., 2016)。本研究显示,随着径级的增加,栓皮栎根系中平均最大、 最小导管直径均呈显著增加趋势,而导管密度下降,表明栓皮栎根系轴向输水能力的提高是通过增加导管直径实现的,而非单位面积导管数量的增加。这种结构变化使导管克服了运输距离加长而产生的水流阻力(Gebauer & Volaí, 2013)。艾绍水等(2015)研究发现,为满足沙柳(Salix psammohila)高蒸腾作用对水分的需求,其根系的导管直径通常较大。在本研究中,2 mm以上的栓皮栎根系比导水率显著增加,说明该径级根系的水分运输功能强于2 mm以下。吴敏等(2014)研究也证明,直径越粗的栓皮栎根系相对含水量越高。然而,本研究发现,随着径级增加,根系栓塞脆弱性指数也呈增加趋势,说明为维持木质部较高的导水能力,根系发生栓塞的风险逐渐增加(徐茜和陈亚宁, 2012)。这可能与导管内径增大有关(Hargrave et al., 2010)。
3.3 不同径级栓皮栎根系碳、氮含量及碳氮比的差异
根系的生理功能除与组织结构有关外,还受碳、氮等元素含量的影响(Chen et al., 2017)。本研究发现,随着径级增加,栓皮栎根系氮含量下降,而碳含量和碳氮比升高。氮素是根细胞膜构建及生理代谢的基础物质,也为离子同化和运输提供载体(赵妍丽等, 2011)。根系中氮素含量的降低,使其吸收功能减弱、周转速率降低(贾淑霞等, 2010)。而水分和养分在木质部的轴向运输主要依靠蒸腾拉力和水分子的内聚力(申卫军, 1999),因此较粗的根系需要更多的碳构建疏导组织。许旸等(2011)也发现高维根比的根系往往具有较大的碳含量。
细根的功能是多种因素的综合影响的结果,单纯以形态或着生位置来划分细根具有局限性(谷加存等, 2016)。本研究采用主成分的方法对多个指标降维,发现采集的根系样品可划分为吸收根群和运输根群两类。前者多为2 mm以下根系,其组织结构和元素含量保障了较高的吸收能力,而后者多为2 mm以上根系,其内部结构更倾向于提高水分疏导效率。以往也有学者在对辽东栎(Quercus liaotungensis)(邓磊等, 2018)、蒙古栎(Q. mongolicus)(张云鹏和崔建国, 2007)、麻栎(Q. acutissima)(赵文瑞等, 2017)等成年栎树的研究中多以2 mm作为划分细根的标准,这与本研究结论一致。该研究采用基于功能的细根划分方法,既考虑了形态指标,又顾及到树木根系的内在结构功能的异质性,为细根划分提供了可行的方法(McCormack et al., 2015)。然而,本研究以栓皮栎盆栽苗为材料,物种单一,今后还将在不同年龄和树种间以及不同立地条件下开展研究,进一步完善细根划分的理论研究。
参考文献:
AI SS, LI YY, CHEN JC, et al., 2015. Root anatomical structure and hydraulic traits of three typical shrubs on the sandy lands of northern Shaanxi Province, China [J]. Chin J Appl Ecol, 26(11):3277-3284. [艾绍水, 李秧秧, 陈佳村, 等, 2015. 陕北沙地3种典型灌木根木质部解剖结构及水力特性 [J]. 应用生态学报, 26(11):3277-3284.]
CHEN H, DONG Y, XU T, et al., 2017. Root order-dependent seasonal dynamics in the carbon and nitrogen chemistry of poplar fine roots [J]. New For, 48(5):587-607.
DENG L, GUAN JH, GAO WL, et al., 2018. Effects of species diversity and environmental gradients on fine root biomass of Quercus liaotungensis forest in the Loess Region [J]. J NW For Univ, 33(5):22-28. [邓磊, 关晋宏, 高万里, 等, 2018. 黄土区辽东栎群落细根生物量对物种多样性及气候的响应 [J]. 西北林学院学报, 33(5):22-28.]
GEBAUER R, VOLAI'K D, 2013. Root hydraulic conductivity and vessel structure modification with increasing soil depth of two oak species:Quercus pubescens and Quercus robur [J]. Trees-Struct Funct, 27(3):523-531.
GU JC, WANG DN, XIA XX, et al., 2016. Applications of functional classification methods for tree fine root biomass estimation:Advancements and synthesis [J]. Chin J Plant Ecol, 40(12):1344-1351. [谷加存, 王东男, 夏秀雪, 等, 2016. 功能划分方法在树木细根生物量研究中的应用:进展与评述 [J]. 植物生态学报, 40(12):1344-1351.]
GUO DL, MITCHELL RJ, HENDRICKS JJ, 2004. Fine root branch orders respond differentially to carbon source-sink manipulations in a longleaf pine forest [J]. Oecologia, 140(3): 450-457.
HACKE UG, SPICER R, SCHREIBER SG, et al., 2016. An ecophysiological and developmental perspective on variation in vessel diameter [J]. Plant Cell Environ, 40(6):831-845.
HARGRAVE KR, KOLB KJ, EWERS FW, et al., 2010. Conduit diameter and drought-induced embolism in Salvia mellifera Greene (Labiatae) [J]. New Phytol, 126(4):695-705.
JACKSON RB, MOONEY HA, SCHULZE ED, 1997. A global budget for fine root biomass, surface area, and nutrient contents [J]. Proc Natl Acad Sci USA, 94(14):7362-7366.
JIA SX, ZHAO YL, DING GQ, et al., 2010. Relationship among fine-root morphology, anatomy, tissue nitrogen concentration and respiration in different branch root orders in Larix gmelinii and Fraxinus mandshurica [J]. Bull Bot, 45(2):174-181. [賈淑霞, 赵妍丽, 丁国泉, 等, 2010. 落叶松和水曲柳不同根序细根形态结构、组织氮浓度与根呼吸的关系 [J]. 植物学报, 45(2):174-181.]
LI HP, 2009. Plant microscopic technology [M]. Beijing:Higher Education Press:9-39. [李和平, 2009. 植物显微技术 [M]. 北京:高等教育出版社:9-39.]
LIU GZ, LIU GH, XIAO H, et al., 2014. Anatomical characteristics of roots with different orders and fine root of Salix gordejevii [J]. Acta Bot Boreal-Occident Sin, 34(5):932-937. [刘冠志, 刘果厚, 晓贺, 等, 2014. 黄柳不同级序根的解剖结构及其细根的研究 [J]. 西北植物学报, 34(5):932-937.]
LIU JJ, WANG DX, LEI RD, et al., 2002. Turnover process and energy change of fine roots of Pinus tabulaeformis and Quercus aliena var. acuteserrata natural forests in Qinling Mountains [J]. Sci Silv Sin, 38(4):1-6. [刘建军, 王得祥, 雷瑞德, 等, 2002. 秦岭林区天然油松、锐齿栎林细根周转过程与能态变化 [J]. 林业科学, 38(4):1-6.]
MA C, ZHANG WH, WU M, et al., 2013. Root growth of Quercus variabilis seedlings in response to the environmental heterogeneity [J]. Sci Silv Sin, 49(10):58-65. [马闯, 张文辉, 吴敏, 等, 2013. 栓皮栎幼苗根系发育对环境异质性的响应 [J]. 林业科学, 49(10):58-65.]
MARTRE P, DURAND JL, COCHARD H, 2010. Changes in axial hydraulic conductivity along elongating leaf blades in relation to xylem maturation in tall fescue [J]. New Phytol, 146(2):235-247.
MCCORMACK ML, DICKIE IA, EISSENSTAT DM, et al., 2015. Redefining fine roots improves understanding of below-ground contributions to terrestrial biosphere processes [J]. New Phytol, 207(3):505-518.
PATE JS, JESCHKE WD, AYLWARD MJ, 1995. Hydraulic architecture and xylem structure of the dimorphic root systems of South-West Australian species of Proteaceae [J]. J Exp Bot, 46(289):907-915.
PREGITZER KS, DEFOREST JL, BURTON AJ, et al., 2002. Fine root architecture of nine North American trees [J]. Ecol Monogr, 72(2):293-309.
SHEN WJ, 1999. Xylem cavitation and embolization in woody plants [J]. J Trop Subtrop Bot, 3(3):257-266. [申衛军, 1999. 木本植物木质部空穴和栓塞化研究 [J]. 热带亚热带植物学报, 3(3):257-266.]
WANG XR, WANG ZQ, HAN YZ, 2005. Variations of fine roots diameter with root order in Manchurian ash and Dahurian larch plantations [J]. Acta Phytoecol Sin, 29(6):871-877. [王向荣, 王政权, 韩有志, 2005. 水曲柳和落叶松不同根序之间细根直径的变异研究 [J]. 植物生态学报, 29(6):871-877.]
WANG ZQ, GUO DL, WANG XR,et al., 2006. Fine root architecture, morphology, and biomass of different branch orders of two Chinese temperate tree species [J]. Plant Soil, 288(1-2):155-171.
WEI X, LIU Y, CHEN HB, 2008. Anatomical and functional heterogeneity among different root orders of Phellodendron amurense [J]. Acta Phytoecol Sin, 32(6):1238-1247. [卫星, 刘颖, 陈海波, 2008. 黄波罗不同根序的解剖结构及其功能异质性 [J]. 植物生态学报, 32(6):1238-1247.]
WELLS CE, EISSENSTAT DM, 2002. Beyond the roots of young seedlings:The influence of age and order on fine root physiology [J]. J Plant Growth Regul, 21(4):324-334.
WU M, ZHANG WH, ZHOU JY, et al., 2014. Effects of drought stress on growth, physiological and biochemical parameters in fine roots of Quercus variabilis Bl.seedlings [J]. Acta Ecol Sin, 34(15):4223-4233. [吴敏, 张文辉, 周建云, 等, 2014. 干旱胁迫对栓皮栎幼苗细根的生长与生理生化指标的影响 [J]. 生态学报, 34(15):4223-4233.]
XIAO CW, SANG WG, WANG RZ, 2008. Fine root dynamics and turnover rate in an Asia white birch forest of Donglingshan Mountain, China [J]. Forest Ecol Manage, 255(3-4):765-773.
XU C, GU JC, DONG XY, et al., 2011. Fine root morphology, anatomy and tissue nitrogen and carbon contents of the first five orders in four tropical hardwood species in Hainan Island, China [J]. Acta Phytoecol Sin, 35(9):955-964. [许旸, 谷加存, 董雪云, 等, 2011. 海南岛4个热带阔叶树种前5级细根的形态、解剖结构和组织碳氮含量 [J]. 植物生态学报, 35(9):955-964.]
XU Q, CHEN YN, 2012. Response of anatomy and hydraulic characteristics of xylem stem of Populus euphratica Oliv.to drought stress [J]. Chin J Eco-Agric, 20(8):1059-1065. [徐茜, 陈亚宁, 2012. 胡杨茎木质部解剖结构和水力特性对干旱胁迫处理的响应 [J]. 中国农业生态学报, 20(8):1059-1065.]
YANG ML, YAN XN, YU WW, et al., 2015. Characteristics of leaf anatomical structure of Malus sieversii in different geographical distribution and plant age [J]. Bull Bot Res, 35(4):509-514. [杨美玲, 闫秀娜, 于玮玮, 等, 2015. 新疆野苹果不同地理分布与树龄的叶片解剖结构特征 [J]. 植物研究, 35(4):509-514.]
YIN MF, ZHAO L, CHEN XF, et al., 2008. Carbon storage maturity age of Larix olgenisis and L. kaempferi [J]. Chin Appl Ecol, 19(12):2567-2571. [殷鸣放, 赵林, 陈晓非, 等, 2008. 长白落叶松与日本落叶松的碳储量成熟龄 [J]. 应用生态学报, 19(12):2567-2571.]
ZHANG RQ, MA XD, L HH, 2016. Response of growth and anatomical structure of roots of Tamarix ramosissima seedlings to salinity and water stress [J]. Pratac Sci, 33(6):1164-1173. [张瑞群, 马晓东, 吕豪豪, 2016. 多枝柽柳幼苗生长及其根系解剖结构对水盐胁迫的响应 [J]. 草业科学, 33(6):1164-1173.]
ZHANG WH, DUAN BL, ZHOU JY, et al., 2004. Water relations and activity of cell defense enzymes to water stress in seedling leaves of different provenances of Quercus variabilis [J]. Chin J Plant Ecol, 28(4):483-490. [张文辉, 段宝利, 周建云, 等, 2004. 不同种源栓皮栎幼苗叶片水分关系和保护酶活性对干旱胁迫的响应 [J]. 植物生态学报, 28(4):483-490.]
ZHANG YP, CUI JG, 2007. Study on fine root biomass and nutrient status in mixed plantation of Quercus mongolicus and Pinus tabulaeformis [J]. J Zhejiang For Sci Technol, 27(5):16-20. [张云鹏, 崔建国, 2007. 油松蒙古栎混交林细根生物量及养分现存量研究 [J]. 浙江林业科技, 27(5): 16-20.]
ZHANG ZM, ZHU XL, YE YZ, et al., 2010. Studies on fine root biomass of the Quercus communities in Baotianman National Nature Reserve [J]. J Henan Agric Univ, 44(2):210-216. [张志铭, 朱学灵, 叶永忠, 等, 2010. 宝天曼自然保护区栎类群落细根生物量的研究 [J]. 河南农业大学学报, 44(2):210-216.]
ZHAO WR, LIU X, ZHANG JC, et al., 2017. Effects of different acidities and sulfur to nitrogen ratios of added acid rain on the growth of fine roots of Quercus acutissima [J]. Sci Silv Sin, 53(4):158-165. [赵文瑞, 刘鑫, 张金池, 等, 2017. 添加酸雨酸度和硫氮比对麻栎林细根生长的影响 [J]. 林业科学, 53(4):158-165.]
ZHAO YL, XU C, GU JC, et al, 2011. Seasonal dynamics of carbon and nitrogen concentrations in Phellodendron amurense fine roots [J]. Chin J Appl Ecol, 22(10):2546-2552. [趙妍丽, 许旸, 谷加存, 等, 2011. 黄波罗细根碳、氮的季节变化 [J]. 应用生态学报, 22(10):2546-2552.]
ZHOU JY, LIN J, HE JF, et al., 2010. Review and perspective on Quercus variabilis research [J]. J NW For Univ, 25(3):43-49. [周建云, 林军, 何景峰, 等, 2010. 栓皮栎研究进展与未来展望 [J]. 西北林学院学报, 25(3):43-49.]
(责任编辑 周翠鸣)
