被子植物性系统及其可塑性
2020-10-20刘美黎云祥陈艳
刘美 黎云祥 陈艳
摘 要:繁殖是生物适合度的最终表现,有性繁殖相关性状的多态性极大地促进了物种分化和生物多样性的维持,并影响着植物对环境变化的响应。在种群水平上,被子植物的花有雌花、雄花和两性花三种性表型,三种性表型在种群中的分布和频率即定义了种群的性系统。被子植物的性系统包含植物影响性分配和交配的相关特性,决定着雌配子、雄配子在种群中的频率、交配机会及交配方式,是有性繁殖的关键性状,在被子植物中表现出丰富的多态性,在种群水平上分为性单态和性多态两大类。性单态为被子植物的古老性状,而性多态在100多个被子植物科中独立进化产生。被子植物性系统多态性及其变化机理一直是进化生物学与生态学的热点问题之一。该文以种群水平的性多态为对象,总结了被子植物性系统的类型、表达的遗传基础、分布频率,以及遗传因子、非生物环境和交配环境对性系统表达和性分配的影响。
关键词:被子植物, 有性繁殖, 非生物环境, 交配环境, 遗传因子
中图分类号:Q943
文献标识码:A
文章编号:1000-3142(2020)08-1211-10
Abstract:Reproduction defines the fitness of organisms. Surviving and successful adaptation by angiosperms to our changing world depends on their sexual reproduction. Three sexual phenotypes are found in angiosperms at population level, i.e. female flower, male flower and hermaphrodite. The composition and frequency of these three sexual phenotypes in population define the population sexual system. Variation and evolutionary flexibility of key traits associated with sexual systems are also often regarded as major drivers of the divergence of plant lineages and the maintenance of biodiversity, which shape mating chances and mating patterns of male and female gametes in plant populations. Intraspecific sexual system diversity is common in angiosperms, and can be found among flowers or populations. Sexual systems in angiosperms can be divided into two classes, i.e. gender monomorphism and gender polymorphism at population level. Gender monomorphism is an ancient trait,however gender polymorphism has evolved independently in more than 100 angiosperm families. It is believed that sexual systems and sex allocation are highly sensitive to environmental changes and the ways that sexual expression responds to changes in abiotic and biotic environments is a major current theme in evolutionary biology and ecology. Here, we discuss within-population polymorphisms in sexual systems and review the frequencies of different sexual systems in angiosperms from the perspective of how sexual expression and sex allocation respond to genetic constrains, abiotic environments and mating environments, aiming to encourage more studies in this area.
Key words:angiosperms, sexual reproduction, abiotic environment, mating environment, genetic factors
繁殖是生物適合度的最终表现,其相关性状的多态性促进了物种的分化和形成,如有性繁殖相关基因的分化、有性繁殖性状多态性与环境(包括生物和非生物环境)的相互作用已被证实在植物家系的分化中起到了重要作用(何亚平和刘建全, 2003; Barrett, 2013; Pauw, 2013)。同时,有性繁殖性状对环境变化极为敏感,物种能否适应环境的变化在很大程度上取决于其有性繁殖对环境变化的响应速度(Hedhly et al., 2009; Eckert et al., 2010; Shimizu et al., 2011),在全球环境快速且剧烈变化的背景下,有性繁殖性状多态性及其变化机理一直是生态学和进化生物学的热点问题。
被子植物性系统(sexual systems)包含植物性分配和交配的相关特征,如花部雌器官、雄器官(雌蕊、雄蕊)的组成和分布,雌配子、雄配子在种群中的频率、交配机会和交配方式,是有性繁殖的关键决定性状(Barrett, 2002; Pannell, 2017)。在花序、个体和种群水平上,两性花和单性花可有不同组合,进而在种群水平上呈现出不同的性系统(Yakimowski & Barrett, 2014)。在花水平上,性系统不仅包括雌蕊、雄蕊的组成差异,形成三种性表型(sexual phenotype),即雌花(female flower)、雄花(male flower)和两性花(hermaphrodite),而且还包括雌蕊、雄蕊成熟时间差异(即雌雄蕊异熟)(陆婷和谭敦炎, 2007)、相对位置差异(即雌雄蕊异位,如柱高二态、异型花柱、镜像花柱)(张大勇等, 2004; 周伟和王红, 2009)等。在种群水平上,被子植物的花有三种性表型,即雌花、雄花和两性花,这三种性表型在种群中的分布和频率定义了植物的性系统(Yakimowski & Barrett, 2014)。被子植物的性系统表现出极高的多样性,不同类群、不同世系(lineage)、不同种群受到的选择压力不同,表现出多样的调控网络和机制(Goldberg et al., 2017; Pannell, 2017)。种群水平的性系统研究有助于揭示性分配、性表达的机理及影响因素(Goldberg et al., 2017)。因此,本研究将针对种群水平的性系统展开。
1 被子植物的性系统类型及分布
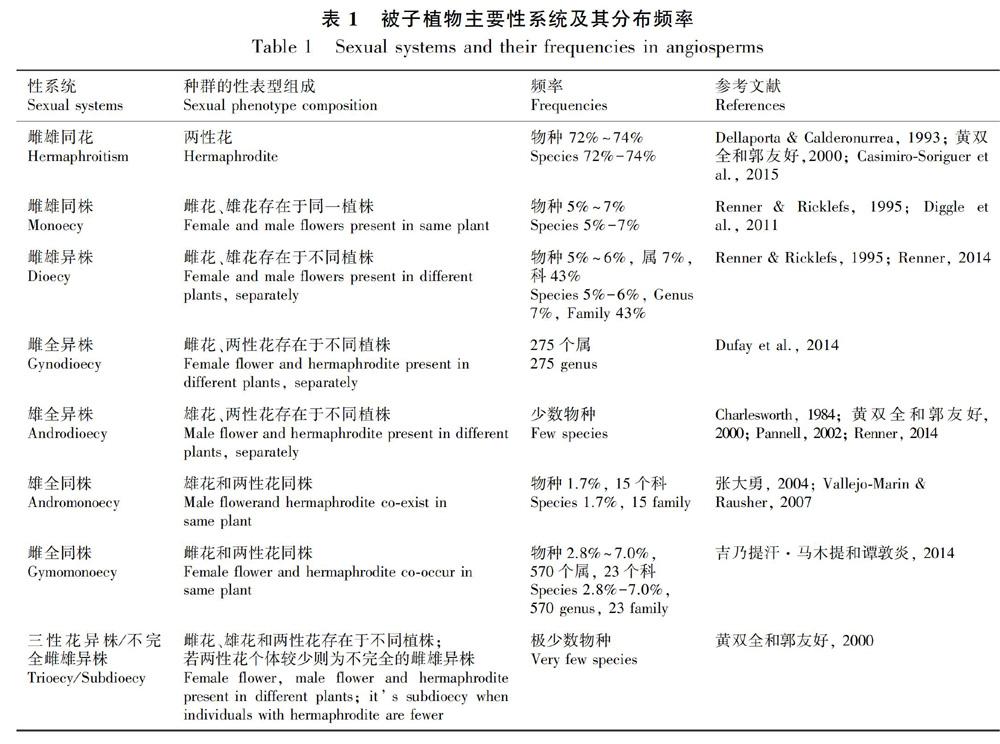
早在1753年,林奈就把被子植物花部性器官的组成和排列作为植物分类的关键性状,并依据花部特征将被子植物分为23个类群(class)(Bremer, 2007)。根据植物雌器官、雄器官是否存在于同一植株,被子植物在种群水平的性系统可分为性单态(gender monomorphism)和性多态(gender polymorphism)。性单态较为古老,主要有雌雄同花/两性花(hermaphroditism)、雌雄(异花)同株(monoecy)、雄全同株(andromonoecy)和雌全同株(gymomonoecy)四种类型。性多态类型较多,较为常见的有雌雄异株(dioecy)、雌全异株(gynodioecy)和雄全异株(androdioecy)(张大勇, 2004; 吉乃提汗·马木提和谭敦炎, 2014)。
被子植物花的主要功能是保证交配和繁殖,其性系统表现出无以伦比的多态性(Goldberg et al., 2017; Pannell, 2017)。性多态性在100多个科中独立进化形成(Karron et al., 2012)。不同的性系统在被子植物中出现的频率不同(表1)。从表1可以看出,以祖先性状的雌雄同花最为常见(Pannell, 2017),占被子植物物种的72%~74%;性多态中以雌雄异株最为常见,尽管仅占物种的6%,但在被子植物科中的分布达到43%;三性花异株(trioecy)或不完全的雌雄异株(subdioecy)仅在少数物种的自然种群中被观察到。不完全雌雄异株被认为是不稳定的性系统(Vaughton & Ramsey, 2012),能否被观察到可能受环境条件、观察时间等的限制,如杨属植物Populus deltoides var. wislizenii一般被判定为雌雄异株。但是,Rowland et al.(2002)培养该变种的雄株枝条,观察到部分雄株枝条在雄花和花粉产生后可形成雌花,在该变种的自然种群中也观察到成熟“雄株”形成种子的现象。因此,他们认为该变种的性系统实际为不完全的雌雄异株,观测时间的差异导致了部分植株性别的年际变化。
性系统的多态性表现为不同的分类等级。性系统的独立进化和转换在许多被子植物科、属中出现,如坛罐花科(Siparunaceae)(Renner & Won, 2001)、蝇子草属(Silene)(Casimiro-Soriguer et al., 2015)、苦瓜属(Momordica)(Schaefer & Renner, 2010)。被子植物有1.4%的属同时拥有雌雄同株和雌雄异株的物种(Renner, 2014)。性系统的多态性可出现在种群水平上,如Yakimowski & Barrett(2014)调查了弯喙慈姑(Sagittaria latifolia)116个北美种群的性比,发现种群的性表型随纬度连续变化,从南到北依次呈现出雌雄同株、雌雄异株、不完全雌雄异株、雌全异株、雄全异株五种性系统,随着纬度增加,雌株比例和雌株产生的花朵数量逐渐降低。一年生植物山靛(Mercurialis annua)在其不同分布区域呈现出雌雄同株、雌雄异株和雄全异株三种性系统。过去认为,山靛性系统的变化来源于染色体组的加倍和杂交(Pannell et al., 2004; Obbard et al., 2006),而Pannell et al.(2008)对山靛欧洲种群的调查显示,其性系统的转换可发生在相同的染色体倍性水平上。
2 被子植物性系统表达的遗传基礎
性单态在被子植物中为祖先性状(Charlesworth, 2002; Zhang et al., 2006),而性多态尽管在物种中所占比例不高,但在许多科属中却多次独立进化产生,如雌雄异株和雌全异株在被子植物约10%的物种和约一半的科中出现,故单性个体的遗传基础成为解读被子植物性系统进化的关键(Grant et al., 1994; Lebel-Hardenack & Grant, 1997)。关于单性个体的进化,最具影响力的假说是Charlesworth & Charlesworth(1978)提出的,他们认为单性个体的产生是三类突变顺序产生的结果,即雌性不育(female-sterility)、雄性不育(male-sterility)突变以及阻止不育位点重组的突变依次产生(Charlesworth, 2002),从而形成了雄株或雌株。
被子植物性别的遗传决定机制非常多样,可以是常染色体的单个位点,也可以是连锁/不连锁的多个位点(Charlesworth, 2013; Billiard et al., 2015; Heikrujam et al., 2015)。如二倍体山靛的性别仅由一个位点决定,其中雄性由显性等位基因控制(Pannell, 1997a; Russell & Pannell, 2015),而菠菜(Spinacia oleracea)的性表达却由紧密连锁的多个位点共同控制(Onodera et al., 2011)。
不同性别决定基因的紧密连锁和交互显性使被子植物的性别稳定表达,进而导致性染色体的进化(Charlesworth, 2013; Heikrujam et al., 2015)。被子植物性染色体有同型(homomorphic sex chromosomes)和异型(heteromorphic sex chromosomes)两种,前者无法从形态上区分不同的性染色体,甚至难以与常染色体相区别,后者不同的性染色体在形态上有明显差异。已在4个科19个物种中观察到异型性染色体,而同型染色体在13个科20个物种中被分子标记鉴定到(Renner, 2014)。被子植物性染色体有XY和ZW两种系统,XY系统中雄性为杂合子,而ZW系统中雌性为杂合子,其中XY系统较为常见(物种列表详见Ming et al., 2011)。目前,被子植物中仅有0.01%的物种(隶属20个科)观测到性染色体,性染色体的分布未表现出系统发育地位和生活型的限制(Ming et al., 2011; Heikrujam et al., 2015)。
近年来,性器官如胚珠(Skinner et al., 2004; Mathews & Kramer, 2012)、花药和花粉(Song et al., 2013; Zhang & Yang, 2014; Shi et al., 2015)表达的关键基因正逐步受到重视,雌蕊、雄蕊发育的关键决定基因及调控因子在一些植物中被揭示(Chuck, 2010),一些植物激素在性器官关键基因的表达和调控中起到了重要作用,如生长素、赤霉素、细胞分裂素、乙烯、脱落酸、茉莉酮酸酯、油菜素甾醇等。这些植物激素对性器官表达的调控方向在不同的植物中会不同,使许多植物在环境变化时表现出性表达和分配的可塑性(Golenberg & West, 2013; Pannel, 2017)。
3 被子植物性系统的可塑性
表型可塑性在自然界普遍存在,且常常为适应性的,对生物的分化和进化具有重要作用(Thibert-Plante & Hendry, 2011)。有研究者提出植物的性别决定从根本上来说可能是数量性状,尽管植物性别的表达和分配具有很强的遗传基础,但个体仍可依据环境依赖的性表达机会和代价来调节性别的表达,以实现个体适合度的最大化(Renner, 2014; Pannell, 2017)。性表达的可塑性(plasticity)或弹性(lability)指植物在不同环境或生活史周期中雌器官、雄器官表达的适应性变化(Renner, 2014)。性表达的可塑性即使在有完善的性染色体的植物中也可能出现(Pannell, 2017)。性表達的可塑性可能导致性系统的变化,如弯喙慈姑北美种群随纬度的增加,雄性器官的表达增加而雌性器官的表达却降低,从而导致五种性系统的依次更替(Yakimowski & Barrett, 2014)。模型模拟显示,植物性表达和分配在时间和空间上的可塑性可以稳定存在(Crossman & Charlesworth, 2014),而环境导致的性器官比例变化增加了植物后代的总体产出,具有适应性意义(黄双全和郭友好, 2000; Golenberg & West, 2013)。性表达的可塑性在许多植物类群中都存在(Korpelainen, 1998),非生物环境和交配环境的变化都可能导致植物性系统的变化。
3.1 性系统表达和性分配对非生物环境的适应性变化
许多植物类群中都表现出多种性系统的共存,但不同性系统的物种/种群往往显示出生境特征差异,如加拿大安大略湖,弯喙慈姑的自然种群中雌雄异株、雌雄同株两种性系统均存在,但雌雄异株往往分布在稳定的湿地环境,而雌雄同株往往分布在水生群落边缘和环境条件波动较大的生境中(Dorken & Barrett, 2003)。坛罐花科呈现出雌雄同株和雌雄异株的多次进化和反转,Siparuna属在新热带地区有65个物种,其雌雄同株物种的分布都局限在亚马逊盆地和美国中南部低海拔地区,雌雄异株物种则分布于安第斯山脉。Renner & Won(2001)研究显示,温度和降水在不同性系统的分布中起重要作用。牻牛儿苗科植物Geranium maculatum,雌全同株种群较两性花种群分布于更为干燥的地区(Van Etten & Chang, 2009)。
非生物环境对植物性表达和分配的影响可能来源于雌器官、雄器官发育的资源需求差异,因胚珠和种子的发育比花粉发育需要更多的营养,所以在资源不足时植物往往会权衡雌器官、雄器官的投入(张大勇和姜新华, 2001)。在资源胁迫条件下,植物一般会减少雌性器官的投入(资源分配理论,resource allocation theory),因此不利的环境条件促进了性多态的进化和维持(Spigler & Ashman, 2012),如百合科的Wurmbea属植物在澳大利亚随着环境干旱程度的增加,性二型的程度也增加(Barrett & Case, 2006)。干旱导致的植物性表达分异在其他植物类群和其他地区被观察到,如喷瓜(Ecballium elaterium)在伊比利亚呈现出性系统的地理梯度差异(Costich, 1995),Buxus balearica在巴利阿里群岛显示出大陆和岛屿种群的差异(Lazaro & Mendez, 2007),随干旱程度的增加植物对雄性的投入增加。Delph & Wolf (2005)综述了非生物环境条件对性表达的影响,发现雄株的性表达可塑性高于雌株,在许多物种中表现为不稳定的雄株(inconstant male)。在较好的环境条件下这些植株可以结实,如Wurmbea dioica自然种群在经历了冬季充足降水后,30%的被标记雄株产生雌花并孕育果实,显示出两性花植株的特征(Dorken & Barrett, 2003);适宜条件下人工栽培三年后,该物种71%的雄性个体发育为两性花植株(Ramsey & Vaughton, 2001),而无论在野外还是人工栽培条件下雌株均未显示性表达的变化。
环境诱导的性表达可塑性受花粉与种子相对扩散能力的影响。Charnov & Bull(1977)首先提出并证实,如果非生物环境条件的变化更有利于植物的某一个性别时,生境依赖的性分配将被选择(Bull, 1981)。模型模拟显示,如果同时考虑植物雌配子、雄配子相对扩散能力和生境质量,环境变化将导致两种完全不同的性分配策略。一种是在高质量的生境中产生更多的花粉,以平衡花粉被传播出去以后的二次性比;另一种是在高质量的生境中产生更多的胚珠,以提高后代产生于有利生境的概率(Guillon et al., 2006)。当花粉扩散距离大于种子扩散距离时,植物将在不良生境中增加对雄性功能的投入,此时花粉进入适应生境的概率高于种子。在被子植物中,花粉扩散能力往往大于种子的扩散能力(Willson, 1993; Ghazoul, 2005),雌性在不良生境中難以发育成种子与果实(张大勇和姜新华,2001),故不良生境中偏雄的性投入在被子植物中更为常见(Freeman & Vitale, 1985; Guillon et al., 2006)。花粉与种子扩散与非生物环境的交互作用,说明传粉系统等生物环境对性系统表达和性分配同样具有重要意义。
3.2 性系统表达和性分配对交配环境的适应性变化
交配环境不仅包括种群中可交配对象的数量、分布等特征,而且还包括传粉系统的特征。交配环境决定了种群内雌配子、雄配子相遇和交配的机会,但交配环境对性系统的影响直到最近才被关注(Ehlers & Bataillon, 2007)。
雌配子、雄配子相遇和交配的概率取决于种群水平的花粉和胚珠的相对供应量,一般用花粉胚珠比(pollen to ovule ratio, P/O ratio)来衡量。在植物性系统的进化与转换中,花粉限制(pollen limitation)具有重要的驱动作用(Ashman et al., 2004; Ehlers & Bataillon, 2007; Hesse & Pannell, 2011),花粉限制程度的时间和空间变化影响着植物的性表达和性分配(Brunet & Charlesworth, 1995),其作用表现在进化水平和生态尺度上。Schaefer & Renner(2010)构建了苦瓜属(Momordica)47个非洲物种的系统进化树,并将各物种的性系统投射到系统发生树上,该属物种有7次从雌雄异株到雌雄同株的独立进化,这些转换事件均发生在进入稀树干草原生境时。在稀树干草原生境中,种群密度很低,雌株可获得的花粉量很低,花粉限制程度很高,导致了该属物种从雌雄异株到雌雄同株的进化。山靛在西班牙西南部呈现出雄全异株的性系统,其雄株的比例和两性花个体对雌雄功能的投入呈现出较大的年际变化。密度种植实验显示,雄株的比例随种群密度的增加而增加(Pannell, 1997b);将其两性花个体种植在没有雄株的环境中,其对雄性功能的投入将增加(Dorken & Pannell, 2009)。类似变化在雌全异株的物种中能观察到,两性花个体对雄性功能的投入表现出雌株频率依赖性,种群中雌株的比例增高时,两性花个体将增加对雄性功能的投入,表现出性器官投入的时空差异(Mccauley & Brock, 1998; Ehlers & Thompson, 2004)。仙人掌科的Pahaycereus pringlei依靠蝙蝠传粉,在墨西哥有雌全异株种群、不完全雌雄异株种群(即雌株、雄株、两性花共存),花粉限制程度可以解释其性系统的变化(Fleming et al., 1994; Ehlers & Bataillon, 2007)。模型模拟证实,雌株、雄株、两性花共存在一般条件下并不稳定,只有在花粉限制条件下才可稳定存在,在强烈花粉限制的条件下,两性花个体可能提供的繁殖保障使其具有较高的适合度(Maurice & Fleming, 1995; Wang et al., 2015),如Humeau et al.(1999, 2010)比较了留尼汪海岛上Dombeya属不同物种的性系统,无论是种间还是部分物种内部都呈现出从严格的雌雄异株到不完全雌雄异株的变化。对不同性系统分布区域的调查显示,严格的雌雄异株出现在高海拔干扰较小的森林,而不完全雌雄异株则分布于低地片断化的小种群中。低地片断化小种群具有较高程度的花粉限制,这可能导致对繁殖保障的选择。
植物的两性交配机会不仅仅是取决于种群水平的花粉和胚珠供应量,传粉者及其传粉效率也是重要的影响因素(黄双全和郭友好, 2000; Devaux et al., 2014)。不同传粉者的传粉效率不同,对一些物种而言,不同地域传粉者类群的变化可以解释种群间的花粉限制强度的差异(Gómez et al., 2010; Lazaro et al., 2015),进而影响种群的性表达,如被子植物的花粉胚珠比是其交配系统的良好指示,异交植物的花粉胚珠比显著高于自交植物(Cruden, 2000)。但是,相同交配系统的植物,其花药胚珠比可能有很大差异,这种变化往往与传粉者组成、丰度及传粉效率相对应(Cruden, 2000)。Corokia cotoneaster自交不亲和,依赖昆虫传粉,Webb(1994)对新西兰该物种两个自然种群的调查显示,两种群的花粉胚珠比具有很大差异(19 762∶1,13 634∶1),这种差异由主要传粉类群的变化导致,前者主要依赖蝇类传粉,后者主要依赖传粉效率更高的蜂类传粉。榕属(Ficus)为专性异交的植物,依赖专一性的传粉榕小蜂为其传粉,传粉榕小蜂的传粉行为不同,有主动和被动两种传粉模式。主动传粉小蜂在出飞时会主动收集花粉并储存于其花粉筐中,进入接受期榕果时,又会主动将花粉从花粉筐中刷出、并授于柱头之上,极大地降低了宿主花粉在传递过程中的损失,具有很高的传粉效率。被动传粉的榕小蜂没有此类行为,宿主花粉靠粘附于小蜂的体表传递,花粉损失量较大,传粉效率较低。对应与主动、被动传粉小蜂传粉效率的差异,榕属物种的花药胚珠比(anther-to-ovule ratio,在榕属物种中被广泛使用,与其他类群中使用的花粉胚珠比相对应)发生了显著的分化,主动传粉模式的榕属物种其花药胚珠比大多小于0.16,而被动传粉模式的榕属物种的花药胚珠比大多大于0.23,且物种内花药胚珠比很稳定(Kjellberg et al., 2001; Cook et al., 2004)。目前,在榕属物种的自然种群中,仅发现地果(Ficus tikoua)的花药胚珠比表现出巨大的变幅(Deng et al., 2016)。
与非生物传粉相比较,生物传粉的不确定性和波动性更大。对性系统可塑性与传粉方式关系的比较显示,性系统表达的高可塑性往往与生物传粉相联系,如生物传粉在不完全雌雄异株物种中的比例(79%)高于雌雄异株物种中的(61%)(Ehlers & Bataillon, 2007)。
交配机会波动导致的性表达和分配可塑性可能通过亲本效应传递给后代(Uller, 2008)。栽培试验显示,一些植物的两性花个体性表达的可塑性与其来源种群的交配环境有关,如山靛的两性花个体在栽培条件变化时表现出不同的性分配可塑性。这与两性花个体来源种群的交配环境有关,与只有两性花个体的源种群相比,如果源种群中具有雄性个体,那么其两性花个体表现出更高的性分配可塑性(Vilas & Pannell, 2014)。
3.3 性系統表达和性分配可塑性的遗传和系统发育限制
性系统表达和分配的可塑性不是没有限制的,而是进化中不同性系统间的转换往往表现出很强的方向性(Barrett, 2013; Castric et al., 2014)。这说明植物性表达和分配的可塑性可能具有一定的遗传限制。性染色体的存在使植株性别稳定表达,降低了性表达的可塑性,如具有性染色体的雌雄异株植物显示出严格的性别决定系统,性表达几乎没有、或仅有很小的可塑性(Ainsworth, 2000)。性表达的可塑性受到系统发生地位的限制。Renneret et al.(2007)对槭属(Acer)在北半球的124个物种的性系统和系统发生关系进行匹配发现,具有性表达可塑性物种在系统发生树中聚在一起,说明该属中性表达的可塑性具有遗传基础。Diggle & Miller(2013)对茄亚属(Leptostemonum)的研究显示,性表达可塑性在该亚属为古老性状,但在Lasiocarpa组中,遗传同化效应使该组物种丧失了性表达的可塑性。性表达可塑性还表现出基因型依赖性,对具有不稳定雄株物种的调查显示,不稳定雄株产生种子的概率在不同的基因型间有很大差异(Ehlers & Bataillon, 2007),如Delph & Lloyd(1991)调查了亚高山长阶花(Hebe subalpina)不同雄株在野生条件下产生种子的平均概率(四年平均),并在相同的条件下种植这些雄株的克隆,结果显示不同克隆在栽培条件下产生种子的比率有很大差异,各克隆在栽培条件下产生种子的比例与克隆在自然条件下产生种子的平均概率成极显著的正相关关系,说明基因型是决定雄株能否产生种子的重要因素。
4 结论及未来发展趋势
性系统是有性繁殖的关键性状,在被子植物中表现出极高的多态性。在种群水平上,根据雌器官、雄器官是否分布于同一植株,可分为性单态和性多态。性单态为被子植物的古老性状,其中两性花最为常见,超过70%的被子植物物种为两性花性系统。性多态尽管在物种中所占的比例不大,但在100多个科中独立进化产生,表现出被子植物对环境变化具有一定适应能力。
性系统的表达和性分配受到遗传因素的影响,性别决定基因既是单位点基因也是多个位点的连锁或不连锁基因。多个性别基因的紧密连锁构成了性染色体,性染色体和性表达关键决定基因已在许多植物中被揭示。这些关键基因的表达受到植物激素的调控,表现出性表达和性分配的可塑性,后者提高了植物在不同环境中的后代产出,具有适应性意义。
许多植物都表现出多种性系统的共存,其性系统的分布和植株对雌雄功能的投入受到非生物环境和交配环境的共同作用。在不良的环境中,植物往往增加对雄性功能的投入,这与雌器官、雄器官发育中所需的营养差异有关,也与花粉扩散能力大于种子扩散能力有关。交配环境决定了雌配子、雄配子在种群中相遇的机会,其对性系统表达和性分配的影响在近年来才被重视。花粉限制是性系统进化和性表达差异的重要驱动力,而传粉者类群、传粉者行为等通过影响花粉限制水平,进而影响植物性系统的表达和性分配。
被子植物的繁育特征已有100多年的研究历史,但其性系统的多态性及其变化机理还远未解决。在性多态及其与环境变化关系的研究中,以下问题仍是热点:
(1) 性别决定的遗传机制,特别是性器官表达和分化的关键基因;(2) 交配环境,特别是传粉者类群变化、行为变化对性系统进化和可塑性的影响;(3) 野外观测与控制实验相结合,探讨性系统表达和性分配对环境变化的响应;(4) 不同研究尺度的结合,即研究中包含更多的植物,以探讨系统发生尺度上植物性系统的进化,同时不能忽视种群水平的实验,以揭示植物性系统差异的进化和维持机理。
参考文献:
AINSWORTH C, 2000. Boys and girls come out to play:the molecular biology of dioecious plants [J]. Ann Bot, 86(2):211-221.
ASHMAN TL, KNIGT TM, STEETS JA, et al., 2004. Pollen limitation of plant reproduction:ecological and evolutionary causes and consequences [J]. Ecology, 85(9):2408-2421.
BARRETT SCH, 2002. The evolution of plant sexual diversity [J]. Nat Rev Genet, 3(4):274-284.
BARRETT SCH, 2010. Darwins legacy:The forms, function and sexual diversity of flowers [J]. Phil Trans Roy Soc B-Biol Sci, 365(1539):351-368.
DELPH LF, WOLF DE, 2005. Evolutionary consequences of gender plasticity in genetically dimorphic breeding systems [J]. New Phytol, 166(1):119-128.
DENG JY, FU RH, COMPTON SG, et al., 2016. Extremely high proportions of male flowers and geographic variation in floral ratios within male figs of Ficus tikoua despite pollinators displaying active pollen collection [J]. Ecol Evol, 6(2):607-619.
DEVAUX C, LEPERS C, PORCHER E, 2014. Constraints imposed by pollinator behaviour on the ecology and evolution of plant mating systems [J]. J Evol Biol, 27(7):1413-1430.
DIGGLE PK, STILIO VSD, GSCHWEND AR, et al., 2011. Multiple developmental processes underlie sex differentiation in angiosperms [J]. Trends Genet, 27(9):368-376.
DIGGLE PK, MILLER JS, 2013. Development plasticity, genetic assimilation, and the evolutionary diversification of sex expression in Solanum [J]. Am J Bot, 100(6):1050-1060.
DORKEN ME, BARRETT SCH, 2003. Life-history differentiation and the maintenance of monoecy and dioecy in Sagittaria latifolia (Alis mataceae) [J]. Evolution, 57(9):1973-1988.
DORKEN ME, PANNELL JR, 2009. Hermaphroditic sex allocation evolves when mating opportunities change [J]. Curr Biol, 19(6):514-517.
DUFAY M, CHAMPELOVIER P, KFER J, et al., 2014. An angiosperm-wide analysis of the gynodioecy-dioecy pathway [J]. Ann Bot, 114(3):539-548.
ECKERT CG, KALISZ S, GEBER MA, et al., 2010. Plant mating systems in a changing world [J]. Trend Ecol Evol, 25(1): 35-43.
EHLERS BK, BATAILLON T, 2007. ‘Inconstant males and the maintenance of labile sex expression in subdioecious plants [J]. New Phytol, 174(1):194-211.
EHLERS BK, THOMPSON JD, 2004. Temporal variation in sex allocation in hermaphrodites of gynodioecious Thymus vulgaris L. [J]. J Ecol, 92(1):15-23.
FLEMING TH, MAURICE S, BUCHMANN SL, et al., 1994. Reproductive biology and relative male and female fitness in a trioecious cactua, Pachycereus pringlei (Cactaceae) [J]. Am J Bot, 81(7):858-867.
FREEMAN DC, VITALE JJ, 1985. The influence of environment on the sex ratio and fitness of spinach [J]. Bot Gaz, 146(1):137-142.
GHAZOUL J, 2005. Pollen and seed dispersal among dispersed plants [J]. Biol Rev, 80(3):413-443.
GOLDBERG EE, OTTO SP, VAMOSI JC, et al., 2017. Macroevolutionary synthesis of flowering plant sexual systems [J]. Evolution, 71(4):898-912.
GOLENBERG EM, WEST NW, 2013. Hormonal interactions and gene regulation can link monoecy and environmental plasticity to the evolution of dioecy in plants [J]. Am J Bot, 100(6): 1022-1037.
GMEZ JM, ABDELAZIZ M, LORITE J, et al., 2010. Changes in pollinator fauna cause spatial variation in pollen limitation [J]. J Ecol, 98(5):1243-1252.
GRANT S, HOUBEN A, VYSKOT B, et al., 1994. Gnetic of sex determination in flowering plants [J]. Dev Gene, 15(3):214-230.
GUILLON JM, JULLIARD R, LETURQUE H, 2006. Evolution of habitat-dependent sex allocation in plants:Superficially similar to, but intrinsically different from animals [J]. J Evol Biol, 19(2):500-512.
HE YP, LIU JQ, 2003. A review on recent adcances in the studies of plant breeding system [J]. Acta Phytoecol Sin, 27(2): 151-163. [何亚平, 刘建全, 2003. 植物繁育系统研究的最新进展和评述 [J]. 植物生态学报, 27(2):151-163.]
HEDHLY A, HORMAZA JI, HERRERO M, 2009. Global warming and sexual plant reproduction [J]. Trends Plant Sci, 14(1): 30-36.
HEIKRUJAM M, SHARMA K, PRASAD M, et al., 2015. Review on different mechanisms of sex determination and sex-linked molecular markers in dioecious crops:A current update [J]. Euphytica, 201(2):161-194.
HESSE E, PANNELL JR, 2011. Density-dependent pollen limitation and reproductive assurance in a wind-pollinated herb with contrasting sexual systems [J]. J Ecol, 99(6):1531-1539.
HUANG SQ, GUO YH, 2000. Advances in pollination biology [J]. Chin Sci Bull, 45(3):225-237. [黄双全, 郭友好, 2000. 传粉生物学的研究进展 [J]. 科学通报, 45(3):225-237.]
HUMEAU L, PAILLER T, THOMPSON JD, 1999. Variation in the breeding system of two sympatric Dombeya species on La Réunion Island [J]. Plant Syst Evol, 218(1):77-87.
HUMEAU L, PAILLER T, THOMPSON JD, 2010. Variation in gender and flower-size dimorphism in the dioecious tree Dombeya ciliata, an endemic to La Réunion Island [J]. Biotropica, 32(3):463-472.
JANNATHAN MUT, TAN DY, 2014. Gynomonoecy in angiosperms:Phylogeny, sex expression and evolutionary significance [J]. Chin J Plant Ecol, 38(1):76-90. [吉乃提汗·馬木提, 谭敦炎, 2014. 被子植物雌全同株性系统:系统演化、性表达与进化意义 [J]. 植物生态学报, 38(1):76-90.]
KARRON JD, IVEY CT, MITCHELL RJ, et al., 2012. New perspectives on the evolution of plant mating systems [J]. Ann Bot, 109(3):493-503.
KJELLBERG F, JOUSSELIN E, BRONSTEIN JL, et al., 2001. Pollination mode in fig wasps:The predictive power of correlated traits [J]. Proc Roy Soc London Ser B, 268(1472):1113-1121.
KORPELAINEN H, 1998. Labile sex expression in plants [J]. Biol Rev, 73(2):157-180.
LAZARO A, LUNDGREN R, TOTLAND O, 2015. Pollen limitation, species floral traits and pollinator visitation:Different relationships in contrasting communities [J]. Oikos, 124(2):174-186.
LAZARO A, MENDEZ M, 2007. Variation in sexual expression in the monoecious shrub Buxus balearica at different scales [J]. Plant Biol, 9(6):736-744.
LU T, TAN DY, 2007. Evolutionary implications of pollen presentation schedules in animal pollinated plants [J]. Biodivers Sci, 15(6):673-679. [陸婷, 谭敦炎, 2007. 动物传粉植物花粉呈现时序的进化意义 [J]. 生物多样性, 15(6):673-679.]
MATHEWS S, KRAMER EM, 2012. The evolution of reproductive structures in seed plants:A re-examination based on insights from developmental genetics [J]. New Phytol, 194(4): 910-923.
MAURICE S, FLEMING TH, 1995. The effect of pollen limitation on the plant reproductive system and the maintenance of sexual polymorphisms [J]. Oikos, 74(1):55-60.
MCCAULEY DE, BROCK MT, 1998. Frequency-dependent fitness in Silene vulgaris, a gynodioecious plant [J]. Evolution, 52(1):30-36.
MING R, BENDAHMANE A, RENNER SS, 2011. Sex chromosomes in land plants [J]. Ann Review Plant Biol, 62(1): 485-514.
OBBARD DJ, HARRIS SA, BUGGS RJA, et al., 2006. Hybridization, polyploidy, and the evolution of sexual systems in Mercurialis (Euphorbiaceae) [J]. Evolution, 60(9):1801-1815.
ONODERA Y, YONAHA I, MASUMO H, et al., 2011. Mapping of the genes for dioecism and monoecism in Spinacia oleracea L.:Evidence that both genes are closely linked [J]. Plant Cell Rep, 30(6):965-971.
PANNELL JR, 1997a. Mixed genetic and environmental sex determination in an androdioecious population of Mercurialis annua [J]. Heredity, 78(1):50-56.
PANNELL JR, 1997b. Variation in sex ratios and sex allocation in androdioecious Mercurialis annua [J]. J Ecol, 85(1):57-69.
PANNELL JR, 2002. The evolution and maintenance of androdioecy [J]. Ann Rev Ecol Syst, 33:397-425.
PANNELL JR, 2017. Plant sex determination [J]. Curr Biol, 27:191-197.
PANNELL JR, DORKEN ME, PUJOL B, et al., 2008. Gender variation and transitions between sexual systems in Mercurialis annua (Euphorbiaceae) [J]. Int J Plant Sci, 169(1):129-139.
PANNELL JR, OBBARD DJ, BUGGS RJA, 2004. Polyploidy and the sexual system:What can we learn from Mercurialis annua? [J]. Biol J Linn Soc, 82(4):547-560.
PAUW A, 2013. Can pollination niches facilitate plant coexistence? [J]. Trend Ecol Evol, 28(1):30-37.
RAMSEY M, VAUGHTON G, 2001. Sex expression and sexual dimorphism in subdioecious Wurmbea dioica (Colchicaceae) [J]. Int J Plant Sci, 162(3):589-597.
RENNER SS, 2014. The relative and absolute frequencies of angiosperm sexual systems:Dioecy, monoecy, gynodioecy, and an updated online database [J]. Am J Bot, 101(10):1588-1596.
RENNER SS, BEENKEN L, GRIMM GW, et al., 2007. The evolution of dioecy, heterodichogamy, and labile sex expression in Acer [J]. Evolution, 61(11):2701-2719.
RENNER SS, RICKLEFS RE, 1995. Dioecy and its correlates in the flowering plants [J]. Am J Bot, 82(5):596-606.
RENNER SS, WON HS, 2001. Repeated evolution of dioecy from monoecy in Siparunaceae (Laurales) [J]. Syst Biol, 50(5): 700-712.
ROWLAND DL, GARNER R, JESPERSEN M, 2002. A rare occurrence of seed formation on male branches of the dioecious tree, Populus deltoides [J]. Am Midland Nat, 147(1): 185-187.
RUSSELL JRW, PANNELL JR, 2015. Sex determination in dioecious Mercurialis annua and its close diploid and polyploid relatives [J]. Heredity, 114(3):262-271.
SCHAEFER H, RENNER SS, 2010. A three-genome phylogeny of Momordica (Cucurbitaceae) suggests seven returns from dioecy to monoecy and recent long-distance dispersal to Asia [J]. Mol Phylogenet Evol, 54(2):553-560.
SHI J, CUI M, YANG L, et al., 2015. Genetic and biochemical mechanisms of pollen wall development [J]. Trends Plant Sci, 20(11):741-753.
SHIMIZU KK, KUDOH H, KOBAYASHI MJ, 2011. Plant sexual reproduction during climate change:gene function in natura studied by ecological and evolutionary systems biology [J]. Ann Bot, 108(4):777-787.
SKINNER DJ, HILL TA, GASSER CS, 2004. Regulation of ovule development [J]. Plant Cell, 16(Suppl_1):S32-45.
SONG S, QI T, HUANG H, et al., 2013. Regulation of stamen development by coordinated actions of jasmonate, auxin, and gibberellin in Arabidopsis [J]. Mol Plant, 6(4):1065-1073.
SPIGLER RB, ASHMAN TL, 2012. Gynodioecy to dioecy:are we there yet? [J]. Ann Bot, 109(3):531-543.
THIBERT-PLANTE X, HENDRY AP, 2011. The consequences of phenotypic plasticity for ecological speciation [J]. J Evol Biol, 24(2):326-342.
ULLER T, 2008. Developmental plasticity and the evolution of parental effects [J]. Trend Ecol Evol, 23(8):432-438.
VALLEJO-MARIN M, RAUSHER MD, 2007. Selection through female fitness helps to explain the maintenance of male flowers [J]. Am Nat, 169(5):563-568.
VAN ETTEN ML, CHANG SM, 2009. Effects of environmental heterogeneity on the distribution of sexes within and among populations in a gynodioecious species, Geranium maculatum [J]. New Phytol, 183(3):649-660.
VAUGHTON G, RAMSEY M, 2012. Gender plasticity and sexual system stability in Wurmbea [J]. Ann Bot, 109(3):521-530.
VILAS JS, PANNELL JR, 2014. Plasticity in sex allocation in the plant Mercurialis annua is greater for hermaphrodites sampled from dimorphic than from monomorphic populations [J]. J Evol Biol, 27(9):1939-1947.
WANG H, MATSUSHITA M, TOMARU N, et al., 2015. Differences in female reproductive success between female and hermaphrodite individuals in the subdioecious shrub Eurya japonica (Theaceae) [J]. Plant Biol, 17(1):194-200.
WEBB CJ, 1994. Pollination, self-incompatibility, and fruit production in Corokia cotoneaster (Escalloniaceae) [J]. N Z J Bot, 32(3):385-392.
WILLSON MF, 1993. Dispersal mode, seed shadows, and colonization patterns [J]. Vegetatio, 107-108(1):260-280.
YAKIMOWSKI SB, BARRETT SCH, 2014. Variation and evolution of sex ratios at the northern range limit of a sexually polymorphic plant [J]. J Evol Biol, 27(7):1454-1466.
ZHANG DB, YANG L, 2014. Specification of tapetum and
microsporocyte cells within the anther [J]. Curr Opin Plant Biol, 17:49-55.
ZHANG DY, 2004. Plant life history evolution and reproductive ecology [M]. Beijing:Science Press. [張大勇, 2004. 植物生活史进化与繁殖生态学 [M]. 北京:科学出版社.]
ZHANG DY, JIANG XH, 2001. Mating system evolution, resource allocation, and genetic diversity in plants [J]. Acta Phytoecol Sin, 25(2):130-143. [张大勇, 姜新华, 2001. 植物交配系统的进化, 资源分配对策与遗传多样性 [J]. 植物生态学报, 25(2):130-143.]
ZHANG LB, SIMMONS MP, KOCYAN A, et al., 2006. Phylogeny of the Cucurbitales based on DNA sequences of nine loci from three genomes:Implications for morphological and sexual system evolution [J]. Mol Phylogenet Evol, 39(2): 305-322.
ZHOU W, WANG H, 2009. Heterostyly in angiosperms and its evolutionary significance [J]. Chin Bull Bot, 44 (6):742-751. [周伟, 王红, 2009. 被子植物异型花柱及其进化意义 [J]. 植物学报, 44(6):742-751.]
(责任编辑 蒋巧媛)
