长春花茉莉酸-异亮氨酸合成酶CrJAR1生物信息学分析与原核表达
2020-10-20林颖王燕燕于放
林颖 王燕燕 于放


摘 要:长春花(Catharanthus roseus)可以产生多种萜类吲哚生物碱,其中包括多种天然的抗癌药物,但合成含量很低,茉莉酸信号通路可以调控这些萜类吲哚生物碱的生物合成,茉莉酸-异亮氨酸合成酶为茉莉酸信号通路中的关键元件。为了研究其功能,该文以长春花叶片为材料,分析了CrJAR1基因所编码的氨基酸序列,并进行原核表达。结果表明:CrJAR1基因编码了585个氨基酸,该蛋白不存在跨膜区域,定位于细胞质中,且该蛋白不含有信号肽;进一步系统进化树分析表明, 长春花CrJAR1与笋瓜和番木瓜的JAR1同源性最高;对二级、三级结构进行预测,发现CrJAR1蛋白主要由α-螺旋构成;同时,成功构建了pET-30b-CrJAR1重组表达质粒,并经IPTG诱导后在大肠杆菌BL21中异源表达,经16、37 ℃分别诱导至16 h后,均显示出最高的表达量。综上结果,对长春花中CrJAR1蛋白进行生物信息学分析,并成功在大肠杆菌中进行异源表达,这对体外该蛋白功能的研究具有深远影响,为调节茉莉酸信号通路甚至调控长春花中次级代谢产物的生物合成提供了指导。
关键词:长春花, 茉莉酸-异亮氨酸合成酶, 序列分析, 三级结构预测, 原核表达
中图分类号:Q943
文献标识码:A
文章编号:1000-3142(2020)08-1181-07
Abstract:Catharanthus roseus can produce a variety of terpeniod indole alkaloids, including a variety of natural anti-cancer, but the biosynthesis content is very low. The jasmonic acid signaling pathway regulates the biosynthesis of these terpeniod indole alkaloids. The jasmonic acid-isoleucine synthase is a key component in the jasmonic acid signaling pathway. In order to study its function, the amino acid sequence of CrJAR1 was analyzed, and prokaryotic expression was performed. Results had shown that the CrJAR1 gene encoded 585 amino acids, and the protein did not contain transmembrane structure. The subcellular localization analysis showed that the protein might be localized in the cytoplasm, and the protein did not contain signal peptide. Further phylogenetic tree analysis showed that the CrJAR1 had the highest homology with the JAR1 of the Cucurbita maxima and Carica papaya. The secondary and tertiary structures were predicted, and it was found that the CrJAR1 protein was mainly composed of α-helix. In addition, the recombinant expression plasmid pET-30b-CrJAR1 was constructed and successfully expressed in Escherichia coli BL21 after induction by IPTG. Induction at 16 and 37 ℃ after 16 hours, both showed the highest expression levels. In this paper, the bioinformatics analysis of CrJAR1 protein in Catharanthus roseus was successfully carried out and heterologously expressed in Escherichia coli. The study will have deep effect on research of CrJAR1 protein function in vitro, and provide instructive revelation for regulation of jasmonic acid signaling pathway, and even the regulation of the biosynthesis of secondary metabolites in Catharanthus roseus.
Key words: Catharanthus roseus, jasmonic acid-isoleucine synthase (JAR1), sequence analysis, prediction of tertiary structure, prokaryotic expression
茉莉酸(jasmonic acid,JA)是一種植物激素,它在植物体内广泛存在,是植物的生长调节物质。在植物中,茉莉酸类物质可以作为调节信号,通过积累次级代谢产物,从而调节植物的防御应答反应(杜红梅等,2009)。茉莉酸及其衍生物能够影响生物体内多个基因的表达,从而影响植物次级代谢产物的积累(Vom et al., 2007)。当植物受到外源胁迫或内源影响时,会产生相应的信号,这些信号可以促进植物体内JA的生成,JA从过氧化物酶体中生成,而后被运送到细胞质中,由茉莉酸-异亮氨酸合成酶(JAR1)作用形成茉莉酸-异亮氨酸(JA-Ile)。JA-Ile促进泛素连接酶复合物(SCFCOI1)与茉莉素ZIM结构域蛋白(JAZ)形成复合物,当形成复合物后,26S蛋白酶就会把JAZ蛋白水解掉。JAZ蛋白被水解后,之前被抑制活性的转录因子MYC2就会被释放出来,可以和下游靶基因的 G-box相结合,从而影响下游基因的表达,进而影响不同的次级代谢途径,生成一系列次级代谢产物(Wasternack & Strnad,2015;Wasternack & Song,2016)。
长春花(Catharanthus roseus)是夹竹桃科长春花属植物,其自身能够产生超过130种萜类吲哚生物碱(terpeniod indole alkaloids,TIAs),其中包括目前应用最广泛的天然植物抗肿瘤药物长春碱(vinblastine)和长春新碱(vincristine),它们可用于治疗恶性淋巴肿瘤、急性白血病等疾病,此外,长春花中的阿玛碱(ajmalicine)可以起到降低血压以及治疗心脏等病症(Li et al., 2013),而蛇根碱(serpentine)能够止疼。长春质碱(catharanthine)可以使血糖降低,并且还能够消毒止血,同时还有利尿的功能,长春质碱还是合成长春碱、长春新碱等生物碱的前体化合物(向蓓蓓等,2010)。但是由于这些萜类吲哚生物碱分布于长春花的不同组织器官中(Rischer et al., 2006),且含量很少,导致提取困难,且因结构复杂,合成难度非常大,因此许多研究者是通过利用基因工程的手段来提高TIAs的产量(杨致荣等,2005)。而在长春花的茉莉酸信号通路中,螺旋-环-螺旋(bHLH)、AP2/ERFs和WRKY三个家族的转录因子都参与调控了TIAs的生物合成,其中,CrMYC2是通过与AP2/ERFs转录因子家族中的ORCA2/3启动子上的 G-box 相似元件相结合,从而激活了转录因子基因的表达,进而调控了大多数TIAs的生物合成途径(Zhang et al., 2011)。
JAR1作为茉莉酸信号的重要元件,它能够形成JA-Ile,在植物次生代谢调节方面具有非常重要的作用,但是目前对于长春花中CrJAR1蛋白的研究还很少。本课题组在前期工作中成功地克隆了长春花中的JAR1基因(徐岩等,2017),即CrJAR1,并且在长春花叶片中过表达了CrJAR1,发现显著提高了合成长春质碱和文多灵途径中相关关键酶基因的表达量,并且促进了文多灵和长春质碱的积累。为了进一步研究长春花中CrJAR1蛋白在茉莉酸信号通路中的功能以及对下游TIAs的生物合成的影响,本研究将CrJAR1进行原核细胞表达,初步确定了表达条件,并对该蛋白的氨基酸序列以及其结构进行了分析。这为体外研究JAR1功能、深入研究茉莉酸信号通路调控次级代谢产物的生成具有重要意义。
1 材料与方法
1.1 材料和试剂
采取野生型长春花叶片为材料。pET-30b载体和大肠杆菌BL21(DE3)感受态细胞均为本实验室保藏。TRNzol Reagent 试剂、RNase free DNase I、TIAN Script M-MLV 反转录酶、pGM-T 载体、普通琼脂糖凝胶 DNA 回收试剂盒购自天根生化科技有限公司;Prime STAR酶、ExTaq 酶、限制性核酸内切酶(Kpn I、Sac I)、T4 DNA 连接酶购自 Takara 公司;琼脂糖凝胶购自美国 Promega 公司;其他试剂如乙醇、氯仿、异丙醇等均购自北京化工厂。
1.2 长春花CrJAR1蛋白的氨基酸序列分析
长春花CrJAR1基因的克隆在本实验室的前期已经完成(徐岩等,2017)。通过 ExPASy Protemics Server提供的在线软件 ProtParam(https://web.expasy.org/cgi-bin/protparam/)分析CrJAR1蛋白的氨基酸组成,并且预测CrJAR1基因编码的蛋白质的理化性质,通过InterPro Scan (http:/ /www.ebi.ac.uk/ interpro/) 来分析蛋白质的保守区域。分别使用 TargetP 1.1 Server (http://www.cbs.dtu.dk/services/TargetP/)和SignalP 4.1 server(http:/ /www.cbs.dtu.dk/services/ SignalP /)及TMHMM (http:/ /www.cbs.dtu.dk/services/TMHMM/) 分析长春花CrJAR1蛋白的亚细胞定位、是否含有信号肽以及跨膜区域,通过MEGA 5.1 软件的UPGMA法构建系统进化树,使用在线软件SOPMA(https://npsa-prabi.ibcp.fr/cgi-bin/secpred_sopma.pl)预测CrJAR1蛋白的二级结构,使用SWISS-MODEL(https://swissmodel.expasy.org/ interactive/RR9Bez/models/)预测三级结构。
1.3 pET-30b-CrJAR1重组质粒的构建
利用限制性核酸内切酶Kpn I和Sac I对pGM-T- CrJAR1质粒和pET-30b载体进行双酶切,37 ℃恒温培养3 h,使用1%的琼脂糖凝胶电泳进行分离。将酶切后的CrJAR1基因片段和pET-30b载体进行胶回收,通过T4 DNA 连接酶连接,连接体系:10×T4 DNA Ligantion Buffer 1 μL,回收的pET-30b载体3 μL,酶切后的CrJAR1 5 μL,T4 DNA Ligase 1 μL。在4 ℃连接24 h。将连接产物pET-30b-CrJAR1转化到大肠杆菌XL-10Gold超级感受态细胞中。将连接产物pET-30b-CrJAR1加入到大肠杆菌XL-10Gold超级感受态细胞中,冰上放置5 min,42 ℃水浴30 s,冰上放置10 min,加入700 μL新鲜LB培养基,180 r·min-1 37 ℃震荡1 h后,4 000 r·min-1离心3 min,涂布于平板上。挑取单菌落,并利用CrJAR1引物进行菌落PCR验证,确定阳性克隆,并将正确的样品进行測序验证。
1.4 蛋白的诱导表达与SDS-PAGE检测
将测序正确的阳性克隆接入50 mL LB培养基中,37 ℃复苏,并以2%的接入量接入200 mL LB培养基中,37 ℃震荡培养至OD600为0.6左右时,加入IPTG,终浓度分别为0.4、1 mmol·L-1,分别在16、37 ℃下诱导培养,分别收集不同时间的表达产物(0、2、4、8、16 h)。分别配制分离胶和浓缩胶,首先配制浓度为10% 的分离胶,再配制浓度为5%的浓缩胶,进行电泳时,在浓缩胶部分,首先保持电压为80 V,当到达分离胶以后,调整电压,使电压保持在120 V,当样品至分离胶底部时,关闭电源,将分离胶取出,用考马斯亮蓝进行染色,脱色后检验。
2 结果与分析
2.1 长春花CrJAR1氨基酸序列分析
长春花CrJAR1基因编码585个氨基酸(图1),通过 ExPASy Protemics Server提供的在线软件 ProtParam預测分析CrJAR1基因所编码的蛋白质的一些基本理化性质,推测CrJAR1蛋白的分子量为65.95 kD,等电点pI为5.73,分子式为C2959H4614N772O880S27,带正电荷的残基(Arg+Lys)总数为65,带负电荷的残基(Asp+Glu)总数为75,脂肪指数为83.97,亲水性为-0.254,不稳定指数为40.02,这将CrJAR1蛋白归类为不稳定蛋白。通过使用InterPro Scan分析 CrJAR1蛋白,其结果显示 CrJAR1蛋白含有保守结构域,位于第19~560氨基酸处(茉莉酸酰胺合成酶,IPR031110),并且CrJAR1蛋白属于GH3家族。
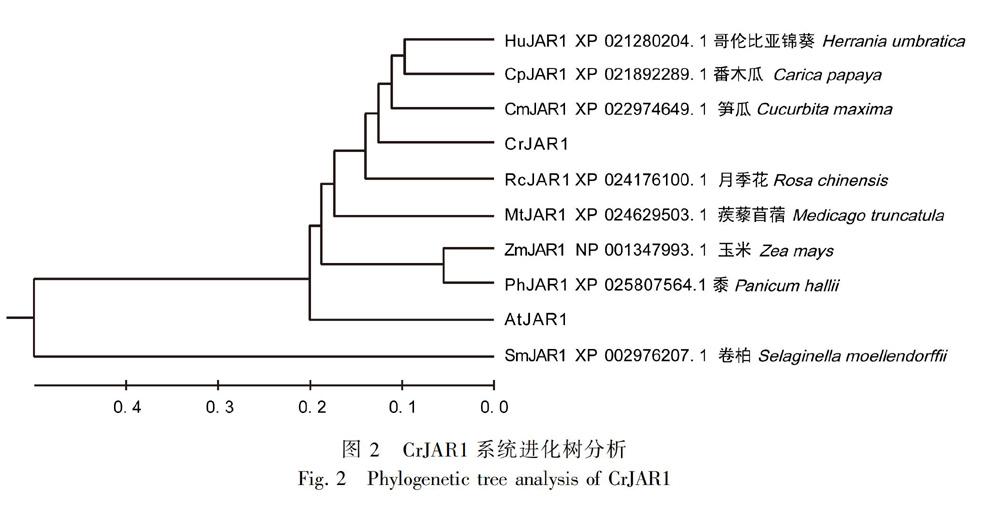
JAR1系统进化树分析结果如图2所示。从图2可以看出,长春花与笋瓜和番木瓜的JAR1蛋白的亲缘关系比较近。SignalP 4.1 server预测结果表明CrJAR1蛋白不含有信号肽,且不存在跨膜区域。通过使用TargetP 1.1 Server分析长春花CrJAR1蛋白的亚细胞定位,其中叶绿体的定位系数为0.124,线粒体的定位系数为0.086,其他位置为0.912,因此该蛋白可能位于细胞质中。进一步利用SOPMA预测,发现α-螺旋占41.88%,不规则卷曲占38.8%,表明它们构成了蛋白的主要结构,其次还包括部分延伸链(14.36%)和少部分β-转角(4.96%)分散在蛋白质中。SWISS-MODEL预测CrJAR1蛋白的三级结构,如图3所示,以CrJAR1蛋白的同源模型5ech.2.A,在第10~584位氨基酸建模,其模型覆盖率为 64.51%。
2.2 原核表达载体重组质粒的构建
通过Kpn I和Sac I对测序正确的pGM-T- CrJAR1质粒和pET-30b载体进行双酶切,分别回收载体片段和CrJAR1片段,通过T4 DNA 连接酶进行连接,构建pET-30b-CrJAR1原核表达载体,并转化到大肠杆菌XL-10Gold超级感受态细胞中。挑取单克隆菌落,经过PCR验证后,在1 700 bp左右存在明显条带。提取质粒后,用Kpn I和Sac I进行双酶切,其结果如图4所示,结果正确。将该菌液送至北京华大基因进行测序,测序结果与前期克隆CrJAR1基因的结果一致,证明pET-30b-CrJAR1原核表达载体构建成功。
2.3 重组蛋白的原核表达与SDS-PAGE 分析
将pET-30b-CrJAR1转入BL21表达宿主中,复苏后扩大培养至200 mL LB培养基中,待OD600为0.6左右时,取出2 mL菌液作为0 h样品,然后分别加入终浓度0.4、1 mmol·L-1 IPTG在16、37 ℃诱导条件诱导表达,并且在2、4、8、16 h四个时间点分别收集菌液。通过SDS-PAGE分析蛋白表达情况。如图5所示,在70和50 kD 之间有明显条带,与CrJAR1蛋白的分子量65.95 kD相近,并且在16、37 ℃两种温度诱导条件下,随着诱导时间的增加,条带明显加深,表明随着诱导时间的增加,CrJAR1蛋白的表达量越来越多。上述研究为后续纯化以及体外研究提供一定依据。
3 讨论与结论
茉莉酸-异亮氨酸合成酶 (JAR1)的功能在许多植物中都有所报道,其作为茉莉酸信号通路中的关键酶,在调控茉莉酸信号方面起着十分重要的作用(Chen et al., 2018)。在茉莉酸信号通路中,茉莉酸通过腺苷化与异亮氨酸共价结合形成茉莉酸-异亮氨酸,从而开启下游的信号传导途径,其JAR1关键酶的作用机理分为以下三个部分:腺苷化;共价结合;抗性基因表达的诱导(Shen et al., 2016)。长春花作为一种天然的抗癌抗肿瘤药物,其本身含有多种萜类吲哚生物碱,但由于这些生物碱在长春花中的合成含量甚少(Pandey et al., 2016),其合成量远远小于需求量,所以近年来对于萜类吲哚生物碱的合成途径的研究越来越多(Caputi et al., 2018)。其中,针对茉莉酸信号调节长春花中萜类吲哚生物碱的合成的相关研究还很少。在使用外源激素处理植物时,适宜的浓度和处理时间可以使产物大量合成,但浓度过高或处理时间过长则会使产量下降(乞永艳等,2006),并且大量使用外源激素成本较高,且易造成环境污染。但通过基因工程的手段来影响相关基因的表达,则可以避免这些问题,并且可以提高长春花中次级代谢产物的产量,因此,成功克隆并且了解合成JA-Ile途径中的关键酶基因,对于目前的生产和研究来说是十分重要的。本实验室的前期研究发现可以通过对茉莉酸信号通路的级联放大来增加长春花中萜类吲哚生物碱的生物合成(徐岩等,2017),但对于CrJAR1蛋白的功能研究尚不完全。本研究克隆了长春花中的CrJAR1基因,并确定该基因编码585个氨基酸,并且对长春花CrJAR1蛋白进行了生物信息学分析。经过亚细胞定位分析,预测出该蛋白可能定位于细胞质中,表明CrJAR1蛋白是在细胞质中发挥功能的(Wasternack & Strnad,2015;Wasternack & Song,2016)。经过对CrJAR1蛋白的保守结构域进行预测,发现该蛋白含有茉莉酸酰胺合成酶保守的结构域,属于GH3家族成员,并且通过进化树分析发现长春花CrJAR1蛋白与笋瓜和番木瓜的JAR1蛋白的亲缘关系比较近,表明CrJAR1蛋白可能是在长春花的茉莉酸信号途径中合成JA-Ile的关键酶。构建重组质粒pET-30b-CrJAR1,并且成功在大肠杆菌BL21中异源表达CrJAR1蛋白。通过不同浓度IPTG在不同温度下进行诱导,发现诱导表达16 h后,CrJAR1蛋白表达量最高。此外,该酶体外功能验证也在进行。尽管如此,现阶段的研究仍有助于我们深入研究长春花中茉莉酸生物合成途径以及信号传导机制,并为研究长春花中次级代谢产物的生物合成提供依据。
目前对于长春花中次级代谢产物的研究主要集中在次级代谢产物的合成途径上,但仍然有很多方面的因素可以影响次级代谢产物的生成,如内源外源的刺激以及多种植物激素如茉莉酸、水杨酸等的调控(Goldhaber et al., 2014)等,因此,我們将继续对长春花中茉莉酸-异亮氨酸合成酶的功能以及茉莉酸信号通路中其他重要的信号调节因子进行研究,进一步探讨它们对次级代谢产物合成的影响,为后续的研究奠定理论基础。
参考文献:
CAPUTI L, FRANKE J, FARROW SC, et al., 2018. Missing enzymes in the biosynthesis of the anticancer drug vinblastine in Madagascar periwinkle [J]. Science, 360:1235-1239.
CHEN HJ, FU TY, YANG SL, et al., 2018. FIN219/JAR1 and cryptochrome1 antagonize each other to modulate photomorphogenesis under blue light in Arabidopsis [J]. PLoS Genet, 14(3):e1007248.
DU HM, TANG DM, HUANG DF, 2009. Effects of methyl jasmonate on in vitro tuberization of taro (Colocasia esculenta) [J]. J Shanghai Jiaotong Univ(Agric Sci), 27(5):480-484. [杜红梅,唐东梅,黄丹枫,2009. 茉莉酸甲酯对芋试管成球的影响 [J]. 上海交通大学学报(农业科学版),27(5):480-484.]
GOLDHABER GD, MUSTAFA NR, VERPOORTE R, 2014. Jasmonic acid effect on the fatty acid and terpenoid indole alkaloid accumulation in cell suspension cultures of Catharanthus roseus [J]. Molecules, 19(7):10242-10260.
LI CY, LEOPOLD AL, SANDER GW, et al., 2013. The ORCA2 transcription factor plays a key role in regulation of the terpenoid indole alkaloid pathway [J]. BMC Plant Biol, 13:155-171.
PANDEY SS, SINGH S, BABU CS, et al., 2016. Fungal endophytes of Catharanthus roseus enhance vindoline content by modulating structural and regulatory genes related to terpenoid indole alkaloid biosynthesis [J]. Sci Rep, 6:26583.
QI YY, BOVY A, TANG YX, 2006. Effects of exogenous jasmonic acid on isoflavonoids in Glycine max [J]. Soybean Sci, 25(1):87-90. [乞永艳,Arnaud Bovy,唐益雄,2006. 外源茉莉酸对大豆异黄酮的影响 [J]. 大豆科学,25(1):87-90. ]
RISCHER H, ORESIC M, LAAKSO TS, et al., 2006. Gene-to-metabolite networks for terpenoid indole alkaloid biosynthesis in Catharanthus roseus cells [J]. PNAS, 103(14):5614-5619.
SHEN Q, LU X, YAN TX, et al., 2016. The jasmonate-responsive AaMYC2 transcription factor positively regulates artemisinin biosynthesis in Artemisia annua [J]. New Phytol, 210:1269-1281.
TANG Q, MA XJ, MO CM, et al., 2011. An efficient approach to finding Siraitia grosvenorii triterpene biosynthetic genes by RNA-seq and digital gene expression analysis [J]. BMC Genomics, 12:343-355.
VOM ED, SOARES SM, KIJNE JW, et al., 2007. Identification of a bipartite jasmonate-responsive promoter element in the Catharanthus roseus ORCA3 transcription factor gene that interacts specifically with AT-hook DNA-binding proteins [J]. Plant Physiol, 144:1680-1689.
