去甲肾上腺素联合复合辅酶对脓毒症患者病情程度、氧化应激状态、免疫功能及炎症因子的影响
2020-10-19盛博陈炜赵磊马迎民臧学峰甄洁
盛博 陈炜 赵磊 马迎民 臧学峰 甄洁
1首都医科大学附属北京世纪坛医院ICU(北京100038);2 首都医科大学附属北京朝阳医院呼吸科(北京100020)
脓毒症是由创伤、烧伤、休克以及严重感染所导致的一种全身炎症反应综合征,病情发展迅速,致死率较高,是危重症患者死亡的主要原因[1]。目前临床上主要通过抗休克、抗感染、纠正水电解质紊乱及营养呼吸支持等常规方法进行治疗,但临床疗效仍不理想[2-3]。为了改善脓毒症患者的诊治效果及预后,一直在探索有效治疗方法及能特异性反映炎症特征和敏感性的生物标志物[4-5]。去甲肾上腺素(norepinephrine,NE)是临床上常用的一种血管活性药物,广泛用于治疗脓毒症休克低血压,复合辅酶作为一种人体所需多种辅酶与生物活性物质的复合物,能够缓解心肌能量代谢障碍,保护心肌细胞[6-7]。然而,NE 联合复合辅酶治疗脓毒症患者的相关报道较少。因此,本研究选取我院收治的脓毒症患者114 例为研究对象,从患者病情、氧化应激状态、免疫功能及炎症因子方面来探讨NE 联合复合辅酶治疗脓毒症的临床疗效,以期为床脓毒症的治疗提供有效措施和策略。
1 资料与方法
1.1 一般资料选取2018年1月至2019年6月我院收治的脓毒症患者114 例为研究对象。纳入标准:符合2016年美国重症医学会和欧洲重症医学会联合发布的脓毒症3.0 和感染性休克诊断标准[8];临床资料完整;入组前1 个月内未使用NE、复合辅酶等药物。排除标准:妊娠期、哺乳期者;原发性免疫功能障碍者;入组前接受免疫抑制治疗者;恶性肿瘤、精神疾病及意识障碍患者。将114 例脓毒症患者分为对照组、NE 组、NE 联合复合辅酶组,每组各38 例,3 组患者的性别、年龄、病程和感染部位等一般资料比较,差异均无统计学意义(P>0.05),具有可比性,见表1。
表1 3 组患者的一般资料比较Tab.1 Comparison of general data of patients in the three groups ±s

表1 3 组患者的一般资料比较Tab.1 Comparison of general data of patients in the three groups ±s
组别对照组(n=38)NE 组(n=38)NE 联合复合辅酶组(n=38)F/χ2值P 值性别(例)男22 21 18 0.917 0.632女腹腔其他16 17 20年龄(岁)53.68±11.16 52.11±10.38 52.08±10.06 0.281 0.755病程(d)1.95±0.58 1.99±0.56 2.01±0.58 0.124 0.884感染部位(例)肺部15 15 12 0.913 0.989泌尿系统10 10 11 8 7 8 5 6 7
1.2 治疗方法对照组患者均参照《2012 国际严重脓毒症及脓毒性休克诊疗指南》并根据菌株鉴定及药敏试验结果使用抗生素(主要包括替加环素、亚胺培南/西司他丁、美罗培南、头孢菌素抗生素等)进行规范抗感染治疗,采用静脉注射生理盐水进行液体复苏等基础治疗。NE 组患者在空白对照组的基础上采用微量泵经中心静脉泵入NE维持血压平衡,初始剂量为0.5 μg/(kg·min),后根据患者血压情况调整药物剂量,输注速度控制在0.1~0.5 mmHg,使患者平均动脉压维持在70.0~85.0 mmHg。NE 联合复合辅酶组患者在NE 组的基础上联合复合辅酶进行治疗,将0.2 mg 复合辅酶溶于100 mL 5%葡萄糖注射液中进行静脉泵注,每天1 次,治疗7 d。
1.3 观察指标比较3 组患者治疗前及治疗后3、7 d 的SOFA、APACHEⅡ评分、心肌损伤标志物(LDH、cTnI、BNP)、氧化应激指标(SOD、GSH⁃Px、LHP、AOPP)、炎症因子(CRP、IL⁃6、IL⁃8、TNF⁃α)、EF 及免疫功能指标(CD4+、CD8+、CD4+/CD8+比值)水平。
1.4 统计学方法所有数据均采用SPSS 22.0统计学软件进行处理分析。计量资料以(±s)表示,进行t检验;计数资料以例(%)表示,进行χ2检验。以P<0.05 为差异有统计学意义。
2 结果
2.1 3 组患者治疗前后SOFA、APACHEⅡ评分比较3 组患者治疗后3、7 d 的SOFA 评分、APACHEⅡ评分均显著降低,且NE 联合复合辅酶组降低程度显著优于NE 组和对照组,NE 组降低程度显著优于对照组,差异均具有统计学意义(P< 0.05),见表2。
表2 3 组患者治疗前后SOFA、APACHEⅡ评分比较Tab.2 Comparison of SOFA score and APACHEⅡscore before and after treatment in 3 groups ±s
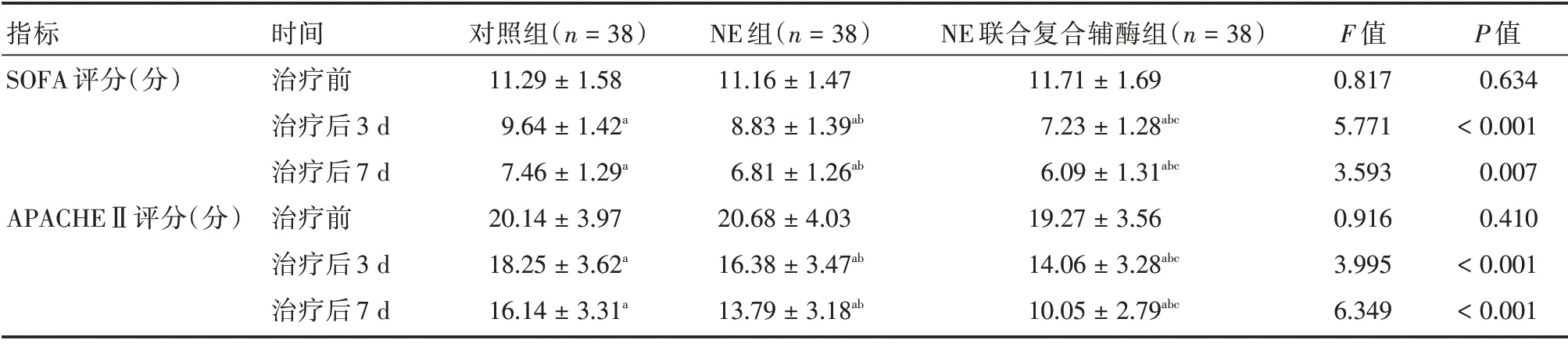
表2 3 组患者治疗前后SOFA、APACHEⅡ评分比较Tab.2 Comparison of SOFA score and APACHEⅡscore before and after treatment in 3 groups ±s
注:与治疗前相比,aP<0.05;与对照组相比,bP<0.05;与NE 组相比,cP<0.05
指标SOFA 评分(分)APACHEⅡ评分(分)时间治疗前治疗后3 d治疗后7 d治疗前治疗后3 d治疗后7 d对照组(n=38)11.29±1.58 9.64±1.42a 7.46±1.29a 20.14±3.97 18.25±3.62a 16.14±3.31a NE 组(n=38)11.16±1.47 8.83±1.39ab 6.81±1.26ab 20.68±4.03 16.38±3.47ab 13.79±3.18ab NE 联合复合辅酶组(n=38)11.71±1.69 7.23±1.28abc 6.09±1.31abc 19.27±3.56 14.06±3.28abc 10.05±2.79abc F 值0.817 5.771 3.593 0.916 3.995 6.349 P 值0.634<0.001 0.007 0.410<0.001<0.001
2.2 3 组患者治疗前后心肌损伤标志物及心功能指标水平比较3 组患者治疗后3、7 d 的LDH、cT⁃nI、BNP 水平均显著降低,EF 水平较治疗前显著升高,且NE 联合复合辅酶组改善程度显著优于NE组和对照组,NE 组改善程度显著优于对照组,差异均具有统计学意义(P<0.05),见表3。
表3 3 组患者治疗前后心肌损伤标志物及心功能指标水平比较Tab.3 Comparison of myocardial injury markers and cardiac function indexes before and after treatment in 3 groups ±s
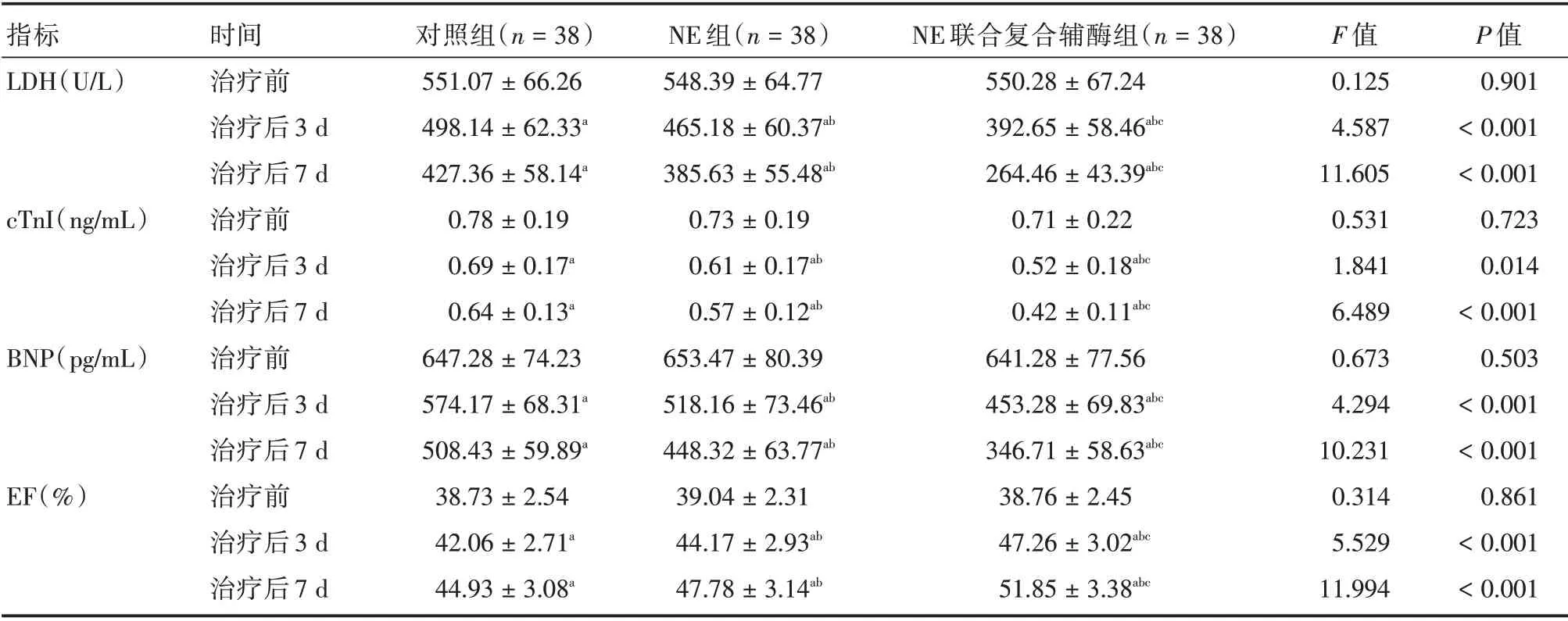
表3 3 组患者治疗前后心肌损伤标志物及心功能指标水平比较Tab.3 Comparison of myocardial injury markers and cardiac function indexes before and after treatment in 3 groups ±s
注:与治疗前相比,aP<0.05;与对照组相比,bP<0.05;与NE 组相比,cP<0.05
指标LDH(U/L)cTnI(ng/mL)BNP(pg/mL)EF(%)时间治疗前治疗后3 d治疗后7 d治疗前治疗后3 d治疗后7 d治疗前治疗后3 d治疗后7 d治疗前治疗后3 d治疗后7 d对照组(n=38)551.07±66.26 498.14±62.33a 427.36±58.14a 0.78±0.19 0.69±0.17a 0.64±0.13a 647.28±74.23 574.17±68.31a 508.43±59.89a 38.73±2.54 42.06±2.71a 44.93±3.08a NE 组(n=38)548.39±64.77 465.18±60.37ab 385.63±55.48ab 0.73±0.19 0.61±0.17ab 0.57±0.12ab 653.47±80.39 518.16±73.46ab 448.32±63.77ab 39.04±2.31 44.17±2.93ab 47.78±3.14ab NE 联合复合辅酶组(n=38)550.28±67.24 392.65±58.46abc 264.46±43.39abc 0.71±0.22 0.52±0.18abc 0.42±0.11abc 641.28±77.56 453.28±69.83abc 346.71±58.63abc 38.76±2.45 47.26±3.02abc 51.85±3.38abc F 值0.125 4.587 11.605 0.531 1.841 6.489 0.673 4.294 10.231 0.314 5.529 11.994 P 值0.901<0.001<0.001 0.723 0.014<0.001 0.503<0.001<0.001 0.861<0.001<0.001
2.3 3 组患者治疗前后炎症因子水平比较3 组患者治疗后3、7 d 的IL⁃6、IL⁃8、CRP、TNF⁃α水平均显著降低,且NE 联合复合辅酶组降低程度显著优于NE 组和对照组,NE 组降低程度显著优于对照组,差异均具有统计学意义(P< 0.05),见表4。
表4 3 组患者治疗前后炎症因子水平比较Tab.4 Comparison of levels of inflammatory factors before and after treatment in 3 groups ±s
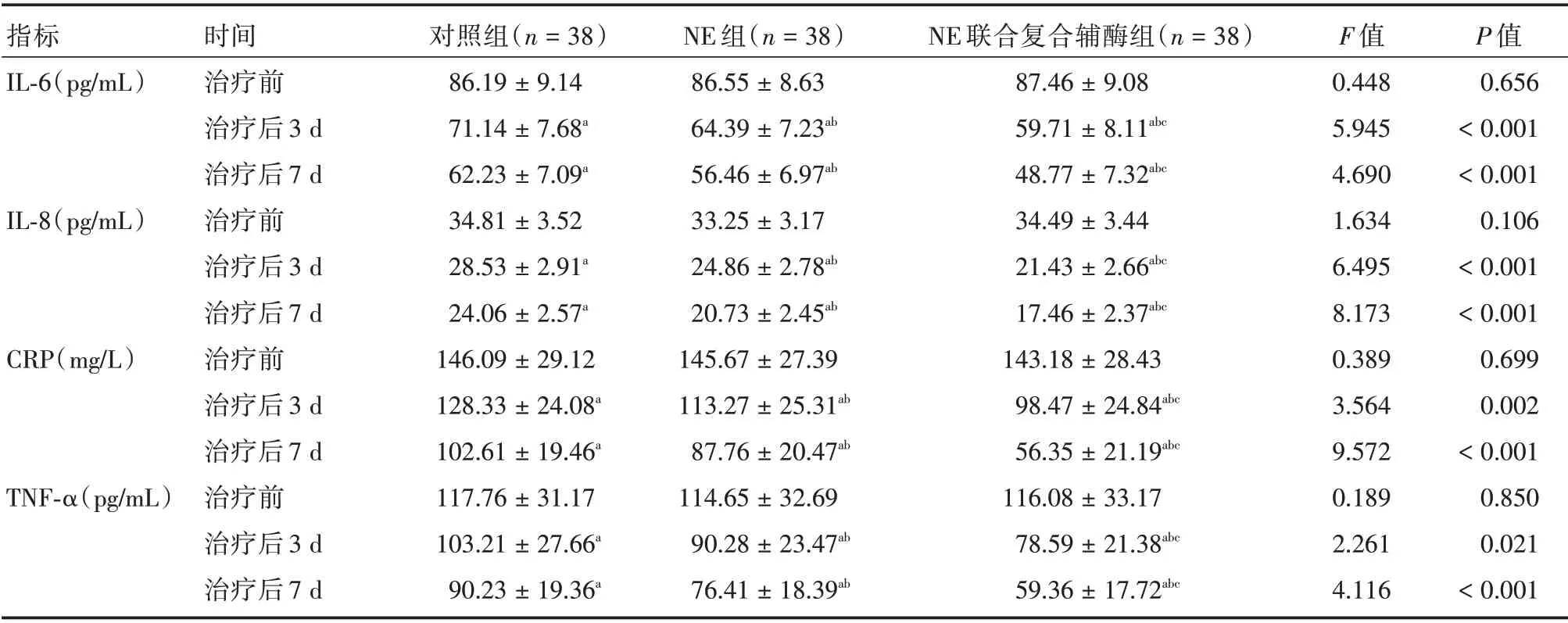
表4 3 组患者治疗前后炎症因子水平比较Tab.4 Comparison of levels of inflammatory factors before and after treatment in 3 groups ±s
注:与治疗前相比,aP<0.05;与对照组相比,bP<0.05;与NE 组相比,cP<0.05
指标IL⁃6(pg/mL)IL⁃8(pg/mL)CRP(mg/L)TNF⁃α(pg/mL)时间治疗前治疗后3 d治疗后7 d治疗前治疗后3 d治疗后7 d治疗前治疗后3 d治疗后7 d治疗前治疗后3 d治疗后7 d对照组(n=38)86.19±9.14 71.14±7.68a 62.23±7.09a 34.81±3.52 28.53±2.91a 24.06±2.57a 146.09±29.12 128.33±24.08a 102.61±19.46a 117.76±31.17 103.21±27.66a 90.23±19.36a NE 组(n=38)86.55±8.63 64.39±7.23ab 56.46±6.97ab 33.25±3.17 24.86±2.78ab 20.73±2.45ab 145.67±27.39 113.27±25.31ab 87.76±20.47ab 114.65±32.69 90.28±23.47ab 76.41±18.39ab NE 联合复合辅酶组(n=38)87.46±9.08 59.71±8.11abc 48.77±7.32abc 34.49±3.44 21.43±2.66abc 17.46±2.37abc 143.18±28.43 98.47±24.84abc 56.35±21.19abc 116.08±33.17 78.59±21.38abc 59.36±17.72abc F 值0.448 5.945 4.690 1.634 6.495 8.173 0.389 3.564 9.572 0.189 2.261 4.116 P 值0.656<0.001<0.001 0.106<0.001<0.001 0.699 0.002<0.001 0.850 0.021<0.001
2.4 3 组患者治疗前后氧化应激指标水平比较3 组患者治疗后3 d、7 d 的LHP、AOPP 水平均显著降低,SOD、GSH⁃Px 水平较治疗前显著升高,且NE联合复合辅酶组改善程度显著优于NE 组和对照组,NE 组改善程度显著优于对照组,差异均具有统计学意义(P<0.05),见表5。
2.5 3 组患者治疗前后免疫功能指标水平比较3 组患者治疗后3、7 d 的CD8+水平均显著降低,CD4+、CD4+/CD8+水平显著升高,且NE 联合复合辅酶组改善程度显著优于NE 组和对照组,NE 组改善程度显著优于对照组,差异均有统计学意义(P<0.05),见表6。
表5 3 组患者治疗前后氧化应激指标水平比较Tab.5 Comparison of levels of oxidative stress factors before and after treatment in 3 groups ±s
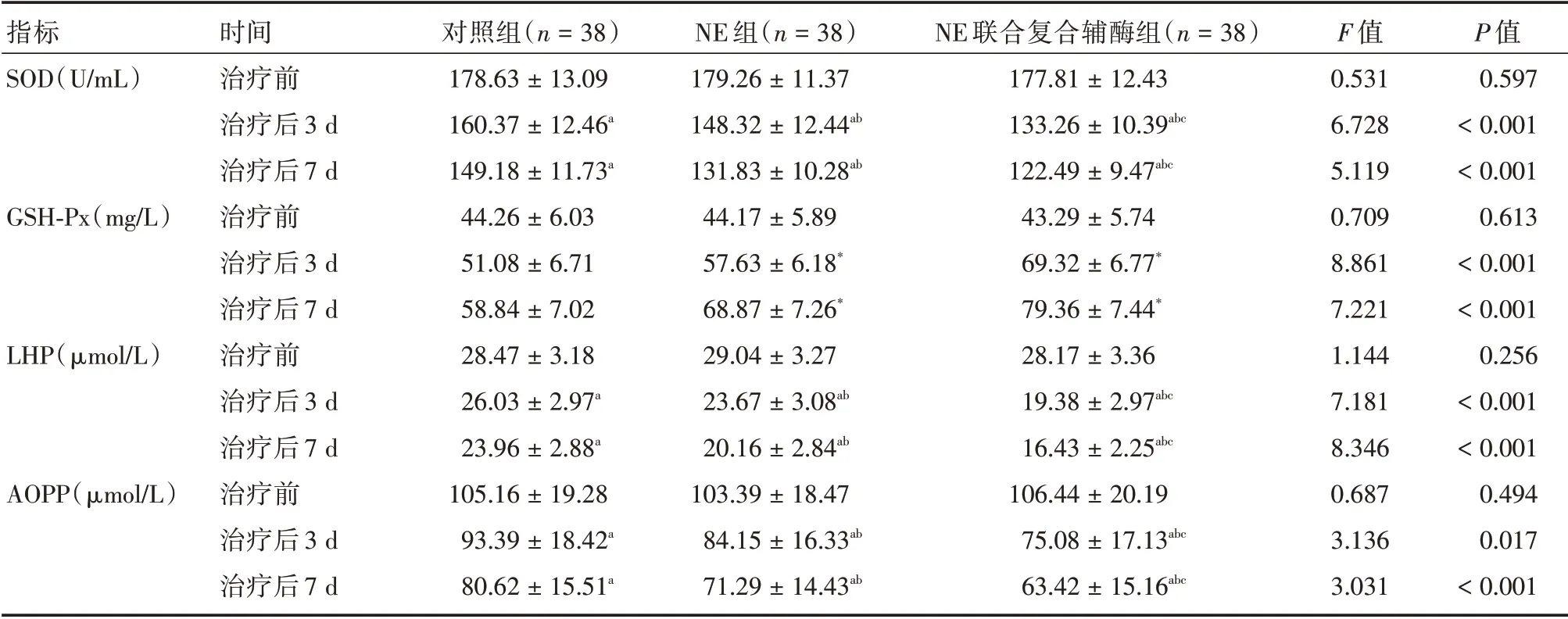
表5 3 组患者治疗前后氧化应激指标水平比较Tab.5 Comparison of levels of oxidative stress factors before and after treatment in 3 groups ±s
注:与治疗前相比,aP<0.05;与对照组相比,bP<0.05;与NE 组相比,cP<0.05
指标SOD(U/mL)GSH⁃Px(mg/L)LHP(μmol/L)AOPP(μmol/L)时间治疗前治疗后3 d治疗后7 d治疗前治疗后3 d治疗后7 d治疗前治疗后3 d治疗后7 d治疗前治疗后3 d治疗后7 d对照组(n=38)178.63±13.09 160.37±12.46a 149.18±11.73a 44.26±6.03 51.08±6.71 58.84±7.02 28.47±3.18 26.03±2.97a 23.96±2.88a 105.16±19.28 93.39±18.42a 80.62±15.51a NE 组(n=38)179.26±11.37 148.32±12.44ab 131.83±10.28ab 44.17±5.89 57.63±6.18*68.87±7.26*29.04±3.27 23.67±3.08ab 20.16±2.84ab 103.39±18.47 84.15±16.33ab 71.29±14.43ab NE 联合复合辅酶组(n=38)177.81±12.43 133.26±10.39abc 122.49±9.47abc 43.29±5.74 69.32±6.77*79.36±7.44*28.17±3.36 19.38±2.97abc 16.43±2.25abc 106.44±20.19 75.08±17.13abc 63.42±15.16abc F 值0.531 6.728 5.119 0.709 8.861 7.221 1.144 7.181 8.346 0.687 3.136 3.031 P 值0.597<0.001<0.001 0.613<0.001<0.001 0.256<0.001<0.001 0.494 0.017<0.001
表6 3 组患者治疗前后免疫功能指标水平比较Tab.6 Comparison of levels of immune function factors before and after treatment in 3 groups ±s

表6 3 组患者治疗前后免疫功能指标水平比较Tab.6 Comparison of levels of immune function factors before and after treatment in 3 groups ±s
注:与治疗前相比,aP<0.05;与对照组相比,bP<0.05;与NE 组相比,cP<0.05
指标CD4+(%)CD8+(%)CD4+/CD8+时间治疗前治疗后3 d治疗后7 d治疗前治疗后3 d治疗后7 d治疗前治疗后3 d治疗后7 d对照组(n=38)35.23±4.91 37.59±4.82a 38.71±5.14a 29.43±4.97 27.06±4.62a 23.78±4.03a 1.25±0.20 1.36±0.21a 1.49±0.26a NE 组(n=38)35.19±4.88 39.94±5.03ab 41.85±5.63ab 28.36±4.81 24.09±4.17ab 20.83±3.91ab 1.26±0.21 1.51±0.23ab 1.73±0.28ab NE 联合复合辅酶组(n=38)36.74±5.16 43.17±5.27abc 48.29±5.77abc 29.17±5.04 21.18±4.26abc 17.79±3.48abc 1.24±0.19 1.66±0.22abc 1.92±0.31abc F 值1.345 2.973 5.024 0.917 3.409 3.580 0.435 3.295 4.804 P 值0.183 0.006<0.001 0.576 0.003<0.001 0.665 0.003<0.001
3 讨论
脓毒症主要是宿主对感染的反应失调所导致的一种全身炎症反应综合征,严重脓毒症的病理生理过程始于微循环障碍或微循环衰竭[9]。SOFA、APACHEⅡ评分在临床上广泛用于脓毒症患者危重程度的评估[10-11]。本研究结果显示,3 组患者治疗后3、7 d 的SOFA、APACHEII 评分均显著降低,且NE 联合复合辅酶组降低程度显著优于NE 组和对照组,提示NE 联合复合辅酶在减轻脓毒症患者病情严重程度方面优势显著。心肌损伤和心功能损伤是脓毒症常见的并发症,会随着脓毒症患者病情加重而并发,学者普遍认为脓毒症患者的心肌损伤及心功能损伤情况能够间接反映其病情严重程度[12-13]。LDH、cTnI、BNP 是临床上常用于评价心肌损伤的标志物,心肌损伤越严重,外周血内LDH、cTnI、BNP 水平会越高[14-16]。NE 作为一种α受体激动剂,同时也是一种血管活性药物,能够收缩外周血管,维持血压平衡,增加回心血量,维持心脏负荷平衡[17]。复合辅酶主要包含辅酶A、辅酶I、三磷酸腺苷、还原型谷胱甘肽和核苷酸等生物活性物质,能够抑制心肌细胞线粒体膜受损,发挥保护心肌细胞功能的作用[18]。本研究结果显示,3 组患者治疗后3、7 d 的LDH、cTnI、BNP 水平均显著降低,EF 水平显著升高,且NE 联合复合辅酶组改善程度显著优于NE 组和对照组,表明应用NE联合复合辅酶在改善脓毒症患者心肌损伤和心功能损伤方面效果更显著,进一步提示NE 联合复合辅酶治疗脓毒症更具优势,这可能与复合辅酶具有保护心肌细胞功能的作用有关。
全身炎症反应是脓毒症发生、进展的基础,IL⁃6、IL⁃8、CRP、TNF⁃α均是目前临床研究中较多的炎症因子,这些炎症因子水平与脓毒症的病情进展存在明显的相关性[19-20]。本研究结果显示,3 组患者治疗后3、7 d 的IL⁃6、IL⁃8、CRP、TNF⁃α水平均显著降低,且NE 联合复合辅酶组降低程度显著优于NE 组和对照组,表明应用NE 联合复合辅酶治疗脓毒症可明显减轻患者全身炎症反应,有助于减缓脓毒症患者病情进展。脓毒症患者持续存在全身炎症反应的情况下,会促进大量氧自由基合成并分泌,导致机体内活性氧大量增加,进一步导致脂质代谢产物LHP、AOPP 累积,而导致抗氧化物质SOD、GSH⁃Px 被过度消耗,加剧氧化应激反应进程,进一步加剧脓毒症患者的全身炎症反应,最终导致脓毒症患者病情加重[21-23]。本研究结果显示,3 组患者治疗后3、7 d 的LHP、AOPP水平较治疗前均显著降低,SOD、GSH⁃Px 水平显著升高,且NE 联合复合辅酶组改善程度显著优于NE 组和对照组,表明应用NE 联合复合辅酶治疗脓毒症患者能够明显改善患者氧化应激状态,这与复合辅酶具有清除氧自由基功能密切相关。此外,本研究结果显示,3 组患者治疗后3、7 d 的CD8+水平均显著降低,CD4+、CD4+/CD8+水平显著升高,且NE 联合复合辅酶组改善程度显著优于NE 组和对照组,表明应用NE 联合复合辅酶治疗脓毒症患者能够明显提高患者的免疫功能,有助于改善脓毒症患者的病情进展。
综上所述,应用NE 联合复合辅酶治疗脓毒症,能够明显减轻患者病情严重程度,减轻患者全身炎症反应,改善患者氧化应激状态,提高患者免疫功能,具有一定的临床价值。然而,由于受外部环境与样本例数等因素制约,本研究仍存在局限之处。需要大规模的临床流行病学调查和基础实验更深入分析E 联合复合辅酶治疗脓毒症的预后情况及其具体作用机制。
