脑苷肌肽辅助治疗新生儿缺氧缺血性脑病对神经损伤标志物、炎症介质的影响
2020-10-19袁晓利
袁晓利
(河南省洛阳东方医院康复儿科 洛阳471000)
新生儿缺氧缺血性脑病(Hypoxic-Ischemic Encephalopathy,HIE)是由围生期窒息而引起的新生儿中枢神经系统缺血缺氧性损害,是足月新生儿发生脑损伤的最常见病因。HIE会直接影响中枢神经功能,引起智力低下、癫痫、共济失调等临床表现,不及时救治可遗留永久性神经系统后遗症。HIE后神经功能损伤的病理生理过程复杂,颅内压升高、营养因子供给不足、炎症介质大量释放及氧自由基生成过多均与神经元的损伤有关,针对性地增加营养供给、抗炎及抗氧化能够起到治疗作用。脑苷肌肽是由神经节苷脂、多肽、氨基酸等成分组成的复合制剂,参与神经损伤修复、神经元发育、营养供给、神经递质合成等过程,用于新生儿HIE的治疗能够促进症状恢复,改善神经功能评分[1],但对病程中神经损伤标志物释放、炎症介质合成的影响尚未见明确报道。本研究具体分析脑苷肌肽辅助治疗新生儿缺氧缺血性脑病,对患儿神经损伤标志物、炎症介质的影响。现报道如下:
1 资料与方法
1.1 一般资料 选取我院2015年2月~2017年10月收治的HIE新生儿作为研究对象。患儿均符合缺氧缺血性脑病诊断标准[2],且为足月新生儿。排除合并先天性畸形的新生儿及电解质紊乱、脑出血、产伤等原因引起的脑损伤患儿。共纳入48例新生儿,采用随机数字表法分为观察组和对照组,每组24例。观察组中男11例,女13例;出生胎龄(38.95±5.41)周;出生体质量(2.68±0.42)kg。对照组中男12例,女12例;出生胎龄(39.15±5.77)周;出生体质量(2.76±0.38)kg。两组一般资料比较无显著性差异(P>0.05)。
1.2 治疗方法 两组均进行常规对症支持治疗,包括维持良好通气,保证PaO2在60~80 mm Hg;pH值7.35~7.45;维持水、电解质平衡,降低颅内压;伴有低血压给予多巴胺2~5μg/(kg·min)微量泵注入,伴有惊厥给予苯巴比妥20 mg/kg在15~30 min内静脉滴注。观察组在常规治疗基础上加用脑苷肌肽治疗,将脑苷肌肽注射液(国药准字H22025046)10 ml加入5%葡萄糖注射液300 ml中,静脉滴注,1次/d。两组均连续治疗2周。
1.3 观察指标 治疗前及治疗2周后,采集空腹静脉血2~3 ml,静置凝血后在离心机中以2 000 r/min的速度离心10 min,分离血清后采用上海西唐公司的酶联免疫吸附法试剂盒测定神经元特异性烯醇化酶(NSE)、缺血修饰清蛋白(IMA)、神经肽Y(NPY)、髓鞘碱性蛋白(MBP)、脑源性神经营养因子(BDNF)、神经生长因子(NGF)、胰岛素样生长因子-Ⅰ(IGF-Ⅰ)、肿瘤坏死因子-α(TNF-α)、白细胞介素-6(IL-6)、IL-18、可溶性细胞间黏附分子-1(sICAM-1)水平。
1.4 统计学方法 采用SPSS22.0统计学软件分析数据。计量资料采用t检验,计数资料采用χ2检验。以P<0.05为差异有统计学意义。
2 结果
2.1 两组血清神经损伤标志物水平比较 治疗前,两组血清神经损伤标志物水平比较无显著差异(P>0.05);治疗后,两组血清NSE、IMA、NPY、MBP含量均较治疗前明显降低,且观察组治疗后血清NSE、IMA、NPY、MBP含量均低于对照组(P<0.05)。见表1。
表1 两组血清神经损伤标志物水平比较(±s)
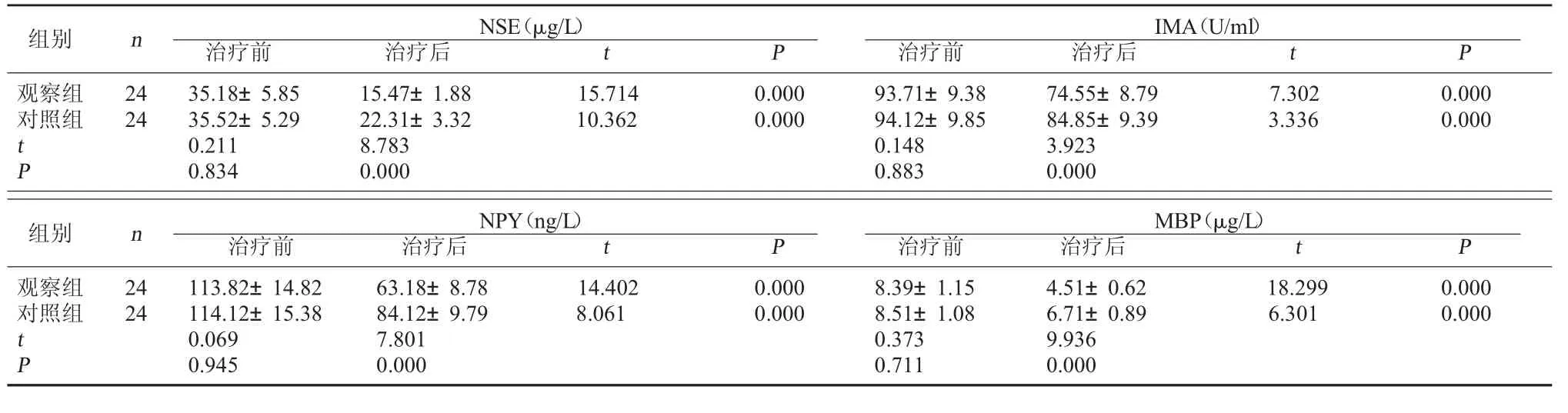
表1 两组血清神经损伤标志物水平比较(±s)
?
2.2 两组血清神经细胞因子水平比较 治疗前,两组血清神经细胞因子水平比较,差异无统计学意义(P>0.05);两组治疗后血清BDNF、NGF、IGF-Ⅰ含量均较治疗前明显升高(P<0.05),且观察组治疗后血清BDNF、NGF、IGF-Ⅰ含量均明显高于对照组(P<0.05)。见表2。
表2 两组血清神经细胞因子水平比较(±s)
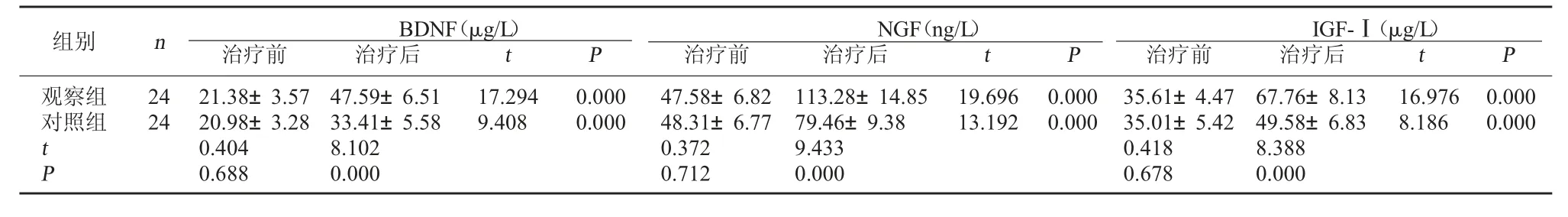
表2 两组血清神经细胞因子水平比较(±s)
?
2.3 两组血清炎症介质水平比较 治疗前,两组血清炎症介质水平比较,差异无统计学意义(P>0.05);两 组 治 疗 后 血 清TNF-α、IL-6、IL-18、sICAM-1含量均较治疗前明显降低(P<0.05),且观察组治疗后TNF-α、IL-6、IL-18、sICAM-1含量均明显低于对照组(P<0.05)。见表3。
表3 两组血清炎症介质水平比较(±s)
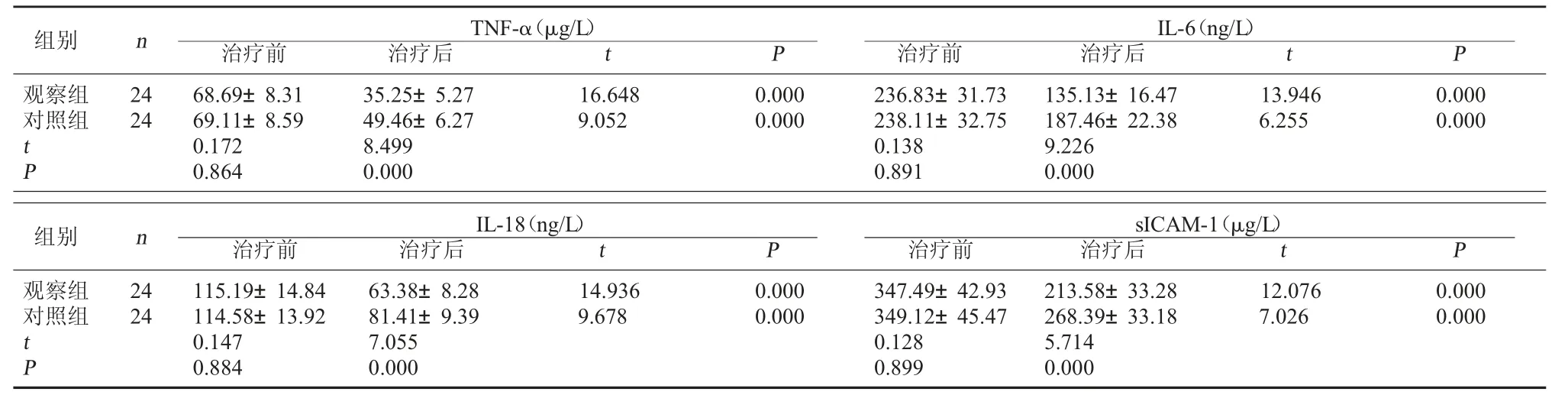
表3 两组血清炎症介质水平比较(±s)
?
3 讨论
HIE具有较高的致死率和致残率,是新生儿在缺血缺氧条件下脑代谢发生障碍,进而引起神经元坏死、脑组织水肿、神经营养因子分泌减少、炎症介质释放增多及氧自由基生成增多,最终引起神经功能的不可逆性损害[3]。目前,临床上治疗HIE的主要手段包括营养支持、神经保护剂、降颅内压等,但整体效果仍有较大提高空间。脑苷肌肽是具有神经保护作用的复合制剂,该制剂中的神经节苷脂能够促进神经元存活和再生,多肽类物质能够增强神经元的营养,氨基酸能够作为原料直接增加细胞内蛋白质的合成、促进神经功能的修复。国内肖勇等[1]的临床研究发现,在常规治疗基础上加用脑苷肌肽治疗,能够促进HIE新生儿的神经症状恢复,同时也改善神经功能评分,提示脑苷肌肽能够减轻HIE新生儿的神经损伤程度。但目前尚无研究从分子层面阐明脑苷肌肽用于HIE新生儿治疗的价值。
在新生儿HIE的病情进展过程中,缺血缺氧造成神经损伤后会使神经元及神经胶质细胞内的功能分子释放至细胞外,进而通过损伤的血脑屏障进入血液循环。NSE是在神经元内参与糖酵解过程的催化酶,缺血缺氧造成神经元损伤时会使其释放增多[4];IMA是清蛋白经血液循环流经缺血缺氧组织时修饰生成的产物[5];NPY是在交感神经系统内发挥调节作用的生物活性肽,缺血缺氧对交感神经的刺激会使其释放增多[6];MBP是分布于脑白质的蛋白,缺血缺氧损伤髓鞘时会使其释放增多。本研究为了明确脑苷肌肽辅助治疗对新生儿HIE神经损伤程度的影响,对治疗前后血清中神经损伤标志物的水平进行了分析,发现两组治疗后血清NSE、IMA、NPY、MBP含量均较治疗前明显降低,且观察组治疗后血清NSE、IMA、NPY、MBP含量均明显低于对照组。这一结果表明常规治疗能够使新生儿HIE的神经损伤程度得到减轻,并且在常规治疗的基础上加用脑苷肌肽能够使神经损伤标志物的释放减少,并进一步减轻神经损伤程度。
在新生儿HIE的病程中,缺血缺氧条件不仅能够直接造成神经损害,还能通过引起多种细胞因子的改变来造成神经功能损伤。BDNF、NGF、IGF-Ⅰ是具有促生长作用的保护性细胞因子,BDNF和NGF具有促进神经元再生和生长的作用,IGF-Ⅰ则具有广泛的促增殖效应,对神经元、神经胶质细胞、内皮细胞的增殖均具有促进作用,神经元及神经胶质细胞的缺血缺氧损害会使上述保护性细胞因子的分泌减少[7]。TNF-α、IL-6、IL-18、sICAM-1是具有促炎活性的损伤性炎症介质,TNF-α、IL-6、IL-18能够促进炎症细胞的活化和浸润,sICAM-1则能促进炎症细胞的迁移和黏附,持续的缺血缺氧条件能够增加上述损伤性炎症介质的分泌[5]。本研究为了进一步明确脑苷肌肽辅助治疗对新生儿HIE病程中保护性细胞因子及损伤性炎症介质分泌的影响,具体分析了治疗前后神经细胞因子及炎症介质的水平。两组治疗后血清BDNF、NGF、IGF-Ⅰ含量均较治疗前明显升高,TNF-α、IL-6、IL-18、sICAM-1含量均较治疗前明显降低,且观察组治疗后血清BDNF、NGF、IGF-Ⅰ含量均明显高于对照组,TNF-α、IL-6、IL-18、sICAM-1含量均明显低于对照组。这一结果表明,常规治疗能够调节新生儿HIE病程中细胞因子的分泌,并且在常规治疗的基础上加用脑苷肌肽能够进一步使保护性细胞因子分泌增多,损伤性炎症介质分泌减少,有助于减轻神经功能的损伤,促进神经功能修复。
综上所述,脑苷肌肽辅助治疗新生儿缺氧缺血性脑病能够减轻神经损伤程度、减少神经损伤标志物的释放,同时能够增加神经细胞因子分泌、减少炎症介质分泌。
