EphB4/EphrinB2对糖尿病视网膜病变大鼠视网膜新生血管生成的影响
2020-10-17李游张玉强张一
李游 张玉强 张一
糖尿病是由于糖代谢障碍所导致全身各器官微血管发生病理性改变的一种疾病,在眼部主要表现为微血管瘤形成,新生血管增生、出血、机化,纤维增生挛缩,最终牵拉视网膜导致视网膜裂孔和脱离。糖尿病视网膜病变(diabetic retinopathy,DR)是最为严重的致盲性眼病[1]。近年来,DR患者人数急剧增加,DR带来的问题越来越引起人们的重视。然而,DR的发病机制非常复杂,至今尚未得出确切结论。深入研究DR病变机制,寻找有效的治疗方案,已成为眼科学研究的热点。
受体酪氨酸激酶信号通路在新生血管生成的分子机制中起着重要作用[2]。目前有三个已知的酪氨酸激酶信号通路被认为是血管发育和形成的关键因素。血管内皮生长因子(VEGF)/血管内皮生长因子受体(VEGFR)系统可以促进血管内皮细胞的分化和发展;Ang/Tie可控制血管形成后成熟和生长过程;Eph/Ephrin家族是受体酪氨酸激酶家族中的最大亚族,在血管生成过程中传递VEGF/VEGFR和Ang/Tie在血管血浆之间的定位信号,影响血管内皮细胞增殖,控制新生血管生成[3]。
在视网膜新生血管生成和增殖过程中,EphB4/EphrinB2起到了重要的作用。本次我们研究EphB4/EphrinB2对DR大鼠视网膜新生血管生成的影响,并且观察玻璃体内注射sEphB4是否能抑制视网膜新生血管的生成。
1 材料与方法
1.1 材料
1.1.1 实验动物及分组取60只体质量为150~200 g的健康雄性SD大鼠(购自锦州医科大学实验动物中心),随机分为模型组、干预组和对照组,每组20只。模型组建立大鼠DR模型;干预组建立DR模型并于玻璃体内注射2 μL sEphB4;对照组建立DR模型并于双眼玻璃体内注射 2 μL生理盐水。实验动物的饲养和处置严格遵守国家科学技术部颁布的《关于善待实验动物的指导性意见》。
1.1.2 试剂与仪器链脲佐菌素(美国Sigma公司),ADP酶(国药集团化学制剂有限公司),小鼠抗大鼠EphB4及兔抗大鼠EphrinB2多克隆抗体(美国Santa Cruz公司),SABC试剂盒及免疫荧光二抗(武汉博士德公司),sEphB4 (美国 VasGene Therapeutics公司)。
1.2 方法
1.2.1 大鼠DR模型的建立将模型组大鼠禁食24 h后,腹腔内注射60 mg·L-1链脲佐菌素溶液,24 h后每天测量大鼠空腹血糖,血糖浓度连续3 d超过250 mg·L-1为糖尿病模型建立成功,纳入实验并给予高糖高脂饲料。糖尿病建模后密切观察大鼠,建模后10周时出现视网膜血管迂曲、静脉串珠样改变及微血管瘤,16周时形成视网膜新生血管的大鼠为DR大鼠[4]。将模型建立不成功的SD大鼠予以剔除,不纳入实验。干预组建立DR模型并于16周、20周末双眼玻璃体内注射sEphB4 2 μL。对照组大鼠建立DR模型并于16周、20周末玻璃体内注射 2 μL生理盐水。模型组和干预组糖尿病大鼠皮下注射少量胰岛素(每周4 U)来预防酮症酸中毒的发生[5]。24周后,分别处死各组大鼠并取材。
1.2.2 组织的制备与检测采用过量麻醉法处死大鼠,取双眼。将右眼制作成视网膜组织铺片和冰冻切片,进行ADP酶染色和EphB4/EphrinB2免疫荧光检测。将左眼视网膜组织集中冷冻保存,用Western blot方法检测EphB4蛋白表达水平。
1.2.3 视网膜组织铺片的 ADP 酶染色将摘取的眼球在40 g·L-1多聚甲醛中固定24 h后取出。在手术显微镜下仔细剥出视网膜和脉络膜,得到完整的视网膜组织铺片。用 0.05 mol·L-1Tris 马来酸缓冲液漂洗,置于37 ℃ADP酶孵育液中孵育15 min,用PBS充分冲洗,硫化铵显色,甘油明胶密封,在显微镜下观察视网膜新生血管形态和分布。
1.2.4 免疫荧光双标检测EphB4/EphrinB2蛋白的表达用冰冻切片机作厚度为8 μm的切片,山羊血清封闭,同时加入小鼠抗大鼠EphB4及兔抗大鼠EphrinB2多克隆抗体,4 ℃冷藏过夜,加入Cy3标记的羊抗小鼠IgG和荧光素钠标记的羊抗兔IgG,室温下在暗盒内静置1.5 h,再加入DAPI于暗盒内室温静置5 min,充分洗涤,甘油明胶密封,遮光,在激光共聚焦显微镜下观察EphB4/EphrinB2蛋白在视网膜组织的表达强弱和分布情况并拍照。
1.2.5 Western blot检测EphB4蛋白的表达将裂解液分装,并混入分装体积1%的PMSF备用。分别取-80 ℃冷冻保存的各组视网膜组织,根据每个样本的质量及体积加入相应体积的裂解液,置于冰上,分散成单细胞悬液,然后继续置于冰上静置5 min。放入离心机12000 r·min-1、4 ℃ 离心10 min,分离上清作为所得的蛋白质抽提物。制备蛋白质待测液,进行BCA反应,取每组样本16 μL加4 μL 5倍样品缓冲液混匀,用SDS-PAGE电泳并转移至纤维素膜上,充分洗涤后加入EphB4一抗,4 ℃过夜,洗涤后再加入二抗杂交2 h,TTBS和TBS充分洗涤后显影。选择β-actin作为内参。图像扫描用Chemi Imager 5500 V2.03图像分析系统,用Fluor Chen 2.0软件进行整合光密度(D值)分析,测定结果采用EphB4蛋白D值与内参β-actinD值的比值表示。
1.3 统计学分析用SPSS 19.0统计软件进行统计学分析,计量数据用均数±标准差来表示;采用单因素方差分析(one-way ANOVA)的方法分析各组差异,采用Dunnett’s法进行组间比较。检验水准:α=0.05。
2 结果
2.1 各组视网膜新生血管观察结果视网膜新生血管呈毛刷状或团簇状,而正常血管呈树枝状,二者有明显不同的形态。模型组和对照组大鼠视网膜毛细血管扩张、迂曲,出现微血管瘤并可见大量紊乱的新生血管,干预组视网膜血管形态接近正常,新生血管少见(见图1)。
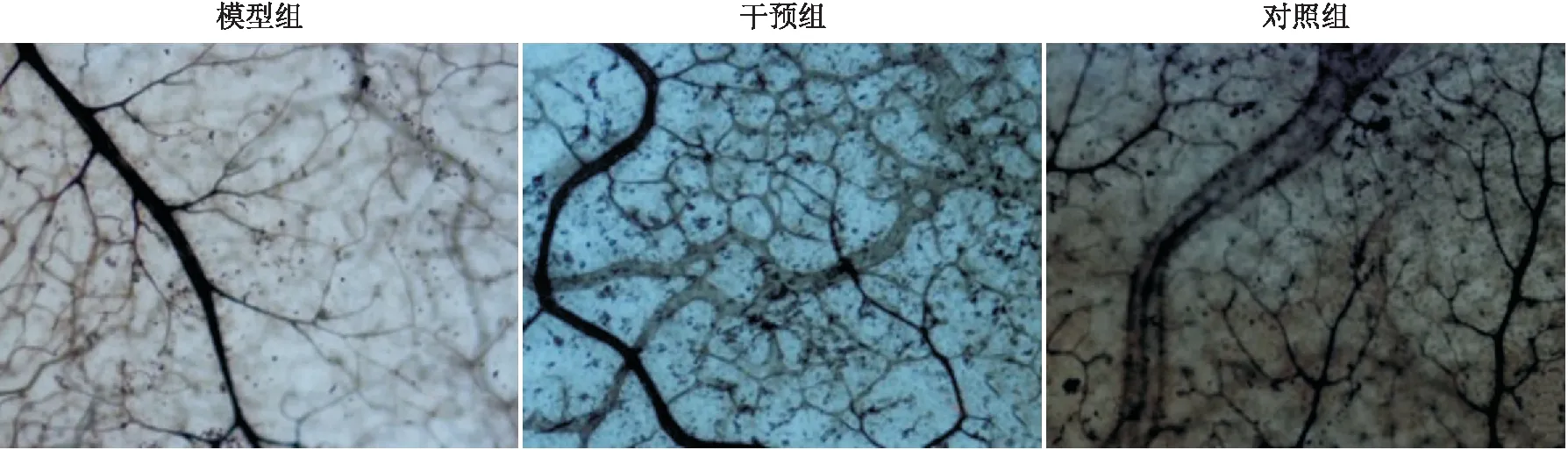
图1 各组大鼠视网膜血管ADP酶染色结果
2.2 各组视网膜组织中EphB4和EphrinB2蛋白的表达激光共聚焦显微镜下可以清晰地观察到视网膜各层的组织形态,EphB4和EphrinB2蛋白大量表达于脉络膜新生血管生成区,且图像重合后发现EphB4蛋白的红色荧光与EphrinB2蛋白的绿色荧光互相重合呈黄色,DAPI蓝色荧光显示于细胞核。如图2所示,模型组和对照组视网膜组织EphB4和EphrinB2呈高表达,干预组的EphB4和EphrinB2的蛋白表达量明显少于模型组和对照组;这说明,sEphB4可以有效地抑制视网膜组织 EphB4 和EphrinB2蛋白的表达。

图2 各组视网膜组织中EphB4和EphrinB2蛋白的表达
2.3 各组视网膜组织EphB4蛋白表达Western blot检测结果显示:模型组和对照组视网膜组织EphB4蛋白表达量较高,干预组DR大鼠视网膜组织中EphB4蛋白表达量明显低于模型组和对照组(见图3)。整合光密度分析的结果显示,干预组EphB4蛋白与内参β-actinD值的比值为0.12±0.02,与模型组的比值(0.76±0.04)和对照组的比值(0.68±0.05)之间差异显著,均有统计学意义(均为P<0.01),而模型组和对照组差异无统计学意义(P=0.08)。

图3 各组大鼠视网膜组织EphB4蛋白表达
3 讨论
DR是一个非常复杂的病理过程,视网膜新生血管的形成是病情发展中最为重要的一环。视网膜新生血管发育不完全,容易发生出血和机化,牵拉视网膜发生裂孔和脱离后,可导致患者视力丧失。探讨糖尿病视网膜新生血管生成机制,以及如何安全和有效抑制新生血管生成已成为DR研究和临床工作的一个重要课题。
在视网膜新生血管生成的信号传输中,Eph/ephrin系统起着重要作用[6]。有研究显示,在血管内皮细胞中既有EphB4蛋白的表达,同时也有EphrinB2蛋白的表达,EphB4/EphrinB2系统传递血管内皮细胞之间的双向信号,促进血管内皮细胞的生长和连接[7],而且EphB4/EphrinB2还可以接收和传递外部刺激信号,促进新生血管形成[8]。研究表明,Ephrin受体和Ephrin配体也参与了视网膜新生血管生成过程,可改变肾上腺素能受体或肾上腺素能受体配体的表达,从而影响血管的形成[9]。相邻的血管内皮细胞之间的丝状伪足彼此吻合形成连接是形成视网膜血管腔的第一步[10],而EphrinB2和EphB4存在于视网膜动脉和静脉血管以及血管网的深层,在视网膜血管的生成和连接过程中发挥作用[11]。另有研究发现,在小鼠胚胎细胞中敲除EphrinB2结合的PDZ区后,视网膜血管内皮细胞形成丝状伪足的能力显著降低,相互连接不紧密,易形成发育不全的新生血管[12-13]。玻璃体内注射可溶性EphrinB2、EphB4-Fc或可溶性EphB4能抑制大鼠视网膜新生血管的形成[14]。用EphrinB2抗体治疗后,血管内皮细胞骨架的动态变化达到平衡,血管形态多态性下降,更趋于环状,表明EphB4/EphrinB2是影响血管内皮细胞功能的重要因素之一,是治疗DR视网膜新生血管的有效靶点[15-16]。
综上所述,本研究通过siRNA抑制EphB4蛋白来调节DR视网膜组织中EphB4/ EphrinB2蛋白的活性,结果显示,Eph /Ephrin 信号通路可以作为调节靶点抑制视网膜新生血管的生成,这为治疗视网膜新生血管病提供新的研究方向,推动人们对DR视网膜新生血管发病机制的认识,有助于临床医师选择更可靠的药物治疗方案,为DR药物治疗提供可靠的理论依据。
