高糖对人晶状体上皮细胞沉默信号调节蛋白6(SIRT6)表达的影响△
2020-10-17蔡莲君李欢徐丽珲郭玉芦晓红罗明秀张茜姚青
蔡莲君 李欢 徐丽珲 郭玉 芦晓红 罗明秀 张茜 姚青
糖尿病性白内障是患病人数逐年增多的糖尿病并发症之一[1],是导致糖尿病患者视力下降甚至失明的重要原因[2]。由于糖尿病性白内障的发病机制复杂且研究进展缓慢,临床上缺乏有效的治疗药物,目前主要靠手术置换人工晶状体的方式治疗,但有些术后并发症又会对患者视力造成新的损伤。糖尿病性白内障发生的病理学基础为高浓度葡萄糖造成晶状体上皮细胞的损伤,且体外研究显示高糖可以导致晶状体上皮细胞损伤[3]。因此,维持晶状体上皮细胞的正常功能对维持正常视功能极其重要。沉默信号调节蛋白6(silent information regulator 6,SIRT6)是哺乳动物中Sirtuins(SIRT1-SIRT7)蛋白家族的成员之一[4],主要定位在细胞核[5],具有依赖烟碱胺腺嘌呤二核苷酸的去乙酰化酶和ADP-核糖基转移酶活性,可参与调节多条信号通路[6]。SIRT6蛋白可通过组蛋白去乙酰化作用调控某些基因表达及DNA修复[7],还可以通过核糖基化修饰作用提高DNA双链断裂后的核酸修复功能[8],维持基因组稳定,尤其在各种衰老相关性疾病,如神经退行性疾病、糖尿病、肿瘤、炎症等疾病的发生、发展中具有正向调节作用[9]。但是在糖尿病性白内障中,人晶状体上皮细胞中SIRT6蛋白的表达变化及作用机制目前还未完全清楚。本研究旨在以高糖干预人源晶状体上皮细胞为模型,探讨糖尿病性白内障患者晶状体上皮细胞中SIRT6蛋白表达情况,为进一步研究糖尿病性白内障的发病机制提供实验依据。
1 材料与方法
1.1 实验细胞株和主要试剂人源晶状体上皮细胞永生系SRA01/04(北京协和细胞中心),DMEM培养基(美国Hyclone公司),胎牛血清(以色列BI公司),2.5 g·L-1胰蛋白酶(美国Hyclone公司),蛋白含量检测试剂盒及蛋白提取试剂盒(中国凯基生物技术股份有限公司),SIRT6多克隆抗体(Affinity,DF12739,美国)、β-actin多克隆抗体(Biossion,bs-0061R,中国)、 LC3多克隆抗体(Proteintech,14600,美国)、Beclin1单克隆抗体(Proteintech,66665,美国)、ATG5多克隆抗体(Proteintech,60061,美国)、ATG12多克隆抗体(Proteintech,11122,美国)、Bcl-2多克隆抗体(Proteintech,12789,美国)、 Bax多克隆抗体(Proteintech,50599,美国)。
1.2 SRA01/04细胞的培养从液氮罐的冻存盒中取出SRA01/04的冻存管后,迅速进行复苏,接种于预先准备好的含体积分数10%胎牛血清的DMEM低糖培养基的培养瓶中,放入含体积分数5%CO2、37 ℃培养箱中培养,12 h后换液,待细胞长至瓶底80%后用2.5 g·L-1胰蛋白酶进行消化,以14进行传代。
1.3 不同浓度葡萄糖对细胞活性的影响常规培养SRA01/04后以 10×103mL-1接种于 96 孔板中,常规培养贴壁固定24 h后,弃去常规培养基,PBS洗3遍后,分别加入含5.5 mmol·L-1、15.5 mmol·L-1、25.5 mmol·L-1、35.5 mmol·L-1、45.5 mmol·L-1、55.5 mmol·L-1、75.5 mmol·L-1葡萄糖的DMEM 培养液,每组设4个复孔,干预48 h后每孔加入 10 μL CCK-8试剂,37 ℃培养箱孵育2 h后,用酶标仪在450 nm波长测定各孔光密度(D)值,每组取4个复孔的平均值,实验重复3次。
1.4 不同浓度葡萄糖对SRA01/04细胞SIRT6蛋白表达的影响常规培养SRA01/04细胞贴壁固定24 h后,分别加入含5.5 mmol·L-1、15.5 mmol·L-1、25.5 mmol·L-1、35.5 mmol·L-1、45.5 mmol·L-1、55.5 mmol·L-1、75.5 mmol·L-1葡萄糖的DMEM 培养液干预各组细胞48 h,用显微镜观察细胞形态变化并拍照记录。收集各组细胞,按凯基全蛋白提取试剂盒说明提取全蛋白,蛋白定量好后,将各组样品进行100 g·L-1SDS-PAGE电泳,280 mA电流湿转45 min,100 g·L-1脱脂奶粉室温封闭4 h,TBST洗膜3次后孵育一抗:兔抗SIRT6抗体( 11000 稀释)、兔抗β-actin抗体(17000稀释),4 ℃孵育过夜,二抗孵育1.5 h,用Image Lab凝胶成像图像分析系统显色并采集图像分析灰度值。
1.5 高糖干预晶状体上皮细胞不同时间后SIRT6蛋白表达常规培养SRA01/04细胞贴壁固定24 h后,用含55.5 mmol·L-1葡萄糖的培养基分别干预SRA01/04细胞0 h、6 h、12 h、24 h、48 h、72 h后收集细胞,按上述方法提取蛋白、蛋白定量以及Western blot检测各组细胞SIRT6蛋白和β-actin的表达。
1.6 免疫荧光检测高糖对晶状体上皮细胞SIRT6蛋白定位和表达的影响将放有爬片的6孔板加入含100×103个SRA01/04细胞的培养基,贴壁固定24 h后将细胞随机分为:对照组:含5.5 mmol·L-1葡萄糖的培养基干预培养;高糖组:含55.5 mmol·L-1葡萄糖培养基干预培养48 h后取出细胞爬片,用多聚甲醛室温固定30 min,Triton-100破膜20 min,封闭30 min,SIRT6多克隆抗体(1100稀释)一抗 4 ℃ 孵育过夜,二抗孵育1.5 h,DAPI染核封片并避光5 min后在荧光显微镜下观察并拍照记录。
1.7 统计学方法采用SPSS 20.0统计学软件对数据进行处理,计量资料以均数±标准差表示。多样本均数比较采用单因素方差分析。两组间比较采用t检验。检验水准:α=0.05。
2 结果
2.1 高糖对晶状体上皮细胞活性的影响将SRA01/04细胞用不同浓度葡萄糖干预后,随着葡萄糖浓度的增加,细胞数量逐渐减少。CCK-8法检测细胞活力结果显示,随着葡萄糖浓度的增加,SRA01/04细胞的增殖活性逐渐降低,与5.5 mmol·L-1葡萄糖组比较,15.5 mmol·L-1葡萄糖组、25.5 mmol·L-1葡萄糖组及35.5 mmol·L-1葡萄糖组与其细胞活性的差异均无统计学意义(均为P>0.05)见图1);45.5 mmol·L-1葡萄糖组、55.5 mmol·L-1葡萄糖组及75.5 mmol·L-1葡萄糖组与其细胞活性的差异均有统计学意义(均为P<0.05,见图1),提示高浓度葡萄糖可以降低SRA01/04细胞的增殖活性。
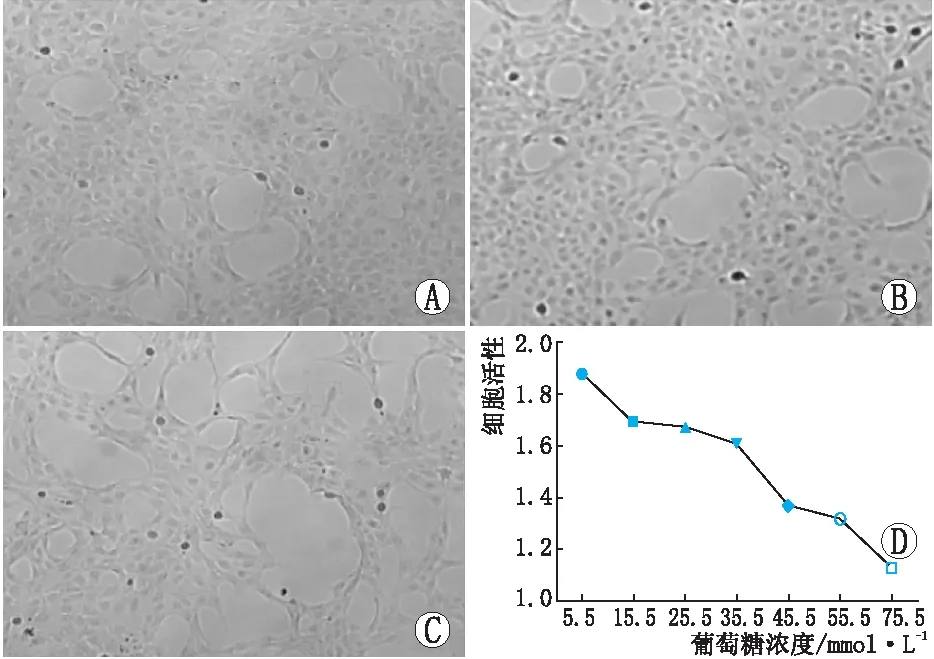
图1 不同浓度葡萄糖干预48 h后晶状体上皮细胞(SRA01/04)的增殖活性(×200) A:5.5 mmol·L-1葡萄糖;B:55.5 mmol·L-1葡萄糖;C:75.5 mmol·L-1葡萄糖;D:SRA01/04在不同浓度葡萄糖中的增殖活性
2.2 不同浓度葡萄糖对晶状体上皮细胞SIRT6蛋白表达的影响Western blot检测结果表明,随着葡萄糖浓度的增加,SRA01/04细胞中SIRT6蛋白表达量逐渐下降,且呈剂量依赖性,与 5.5 mmol·L-1葡萄糖组SRA01/04细胞中SIRT6蛋白的表达量比较,15.5 mmol·L-1葡萄糖组、25.5 mmol·L-1葡萄糖组及35.5 mmol·L-1葡萄糖组与其差异均无统计学意义(均为P>0.05);45.5 mmol·L-1葡萄糖组、55.5 mmol·L-1葡萄糖组及75.5 mmol·L-1葡萄糖组与其差异均有统计学意义(均为P<0.05)(见图2),结合上述CCK-8检查结果表明,55.5 mmol·L-1葡萄糖组使SRA01/04细胞中SIRT6蛋白表达下降有显著差异,同时导致细胞损伤达到后期可进行干预的程度,所以确定后期高糖干预的有效合适浓度为55.5 mmol·L-1。
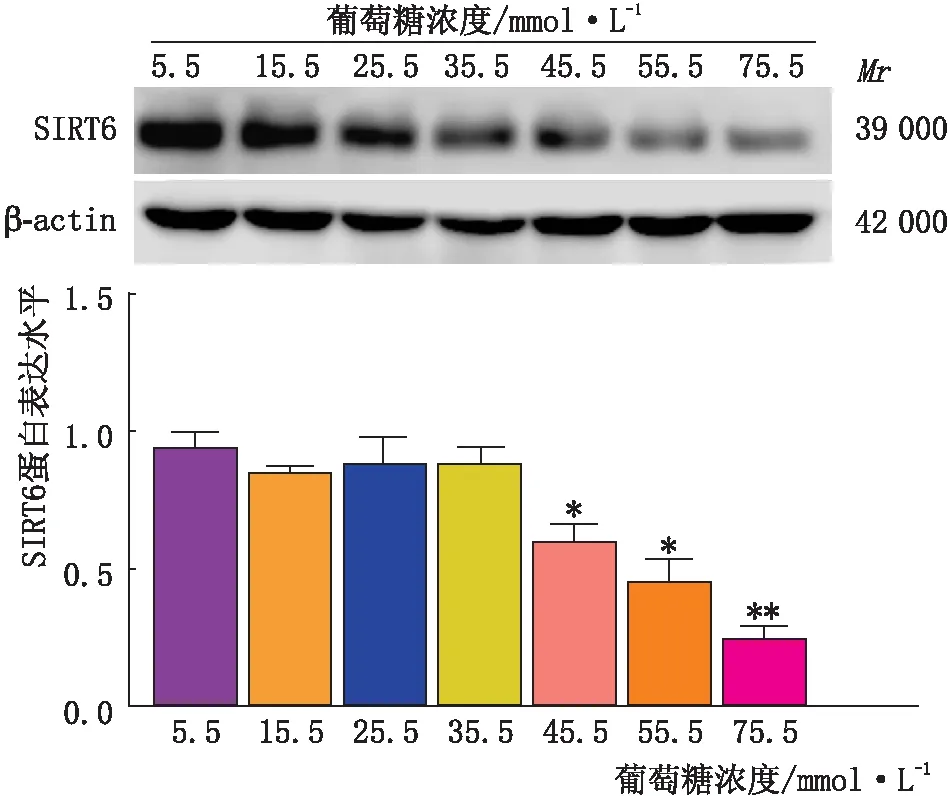
图2 不同浓度葡萄糖对SRA01/04细胞SIRT6蛋白表达的影响 与5.5 mmol·L-1葡萄糖组比较,*P<0.05,**P<0.01
2.3 高糖干预不同时间对晶状体上皮细胞SIRT6蛋白表达的影响将SRA01/04细胞随机分为6组,用含55.5 mmol·L-1葡萄糖的培养基分别干预0 h、6 h、12 h、24 h、48 h、72 h后,Western blot检测结果表明,在同样的高浓度葡萄糖干预下,随着时间延长,SRA01/04细胞中SIRT6蛋白的表达量逐渐下降,呈时间依赖性,与0 h组SIRT6蛋白表达量比较,6 h组和12 h组与其差异均无统计学意义(均为P>0.05);24 h组、48 h组及72 h组与其差异均有统计学意义(均为P<0.05)(见图3)。提示高糖干预时间越久,SRA01/04细胞中SIRT6蛋白表达量越低,因为高糖干预SRA01/04细胞48 h后,SIRT6蛋白的下降有显著差异,所以把48 h作为后期的高糖干预时间。
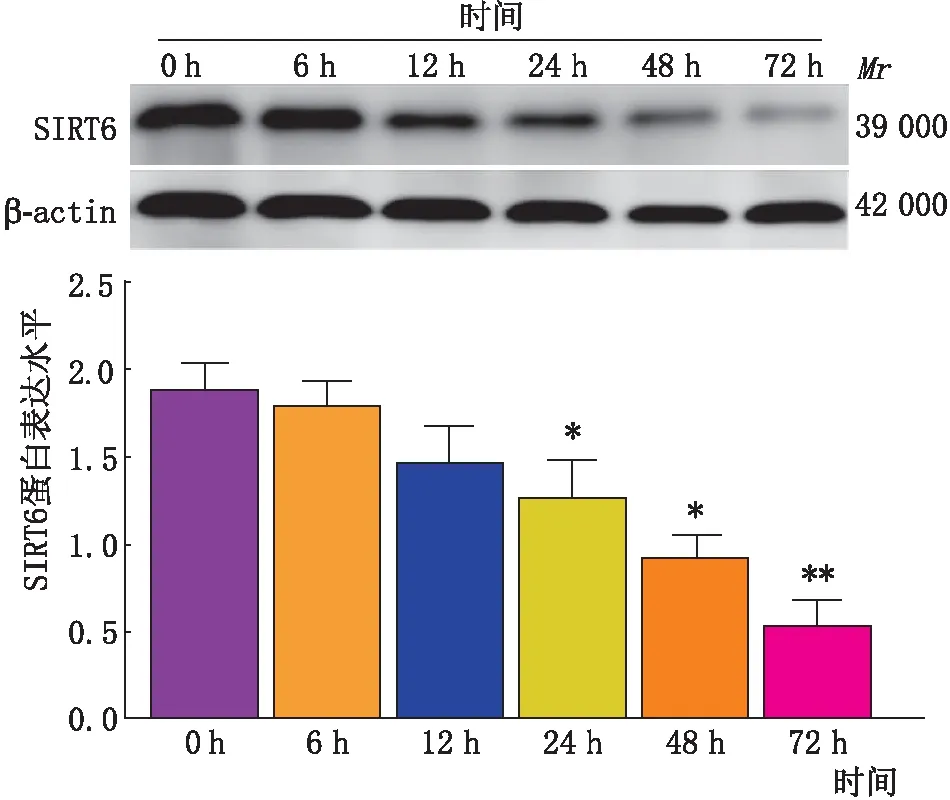
图3 高糖干预不同时间对SRA01/04细胞SIRT6蛋白表达的影响 与0 h组比较,*P<0.05,**P<0.01
2.4 高糖对晶状体上皮细胞SIRT6蛋白定位和表达的影响免疫荧光结果显示,SIRT6蛋白主要在细胞核表达(见图4),相比对照组,高糖组细胞SIRT6蛋白表达量明显下降,且高糖组细胞出现明显的核固缩、核碎裂现象。
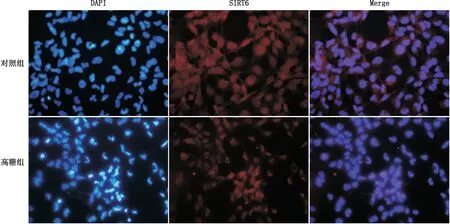
图4 对照组和高糖组SRA01/04细胞中SIRT6蛋白定位和表达情况(×200)
3 讨论
随着人们生活水平的提高,糖尿病性白内障患者的人数随着糖尿病患者的人数增多而逐年增加[2]。糖尿病性白内障是导致糖尿病患者视力逐渐降低的主要原因之一,从一开始的视力模糊影响患者阅读、开车等,到后期的视力完全丧失,视力的缺陷严重影响患者的生活质量及身心健康[10-11]。虽然超声乳化、飞秒激光等人工置换晶状体手术有明显治疗效果,但术后并发症,如玻璃体混浊、眼底出血等又会对患者视力造成新的损伤。既往研究表明,糖尿病性白内障患者晶状体摘出术后的并发症高于普通白内障手术患者[12]。由于糖尿病性白内障的发病机制复杂,虽然近年来研究者提出了多元醇途径、糖基化学说,并以此开发出了糖基化抑制剂、醛糖还原酶抑制剂等西药以及水蛭素、丁基苯酞、黄酮类化合物等中成药,但因其疗效差、毒副作用大,而且多数实验还停留在动物模型阶段而未能投入临床应用[13-14]。
人类长寿蛋白SIRT6 基因位于SSC19,长39.1 kb,含8个外显子,主要定位于细胞核内,在肝脏、肾脏等多种组织细胞中高度表达[15]。既往研究发现SIRT6蛋白具有多种生物学功能:调控某些基因表达,对损伤后的核酸进行修复,维持基因组稳定,维持体内葡萄糖的稳态,延长机体寿命[8,16-19]。有研究发现[16],分别敲除小鼠的SIRT1-SIRT7基因后,只有SIRT6基因缺陷的小鼠出现明显的衰老表现。Liu等[8]发现,在糖尿病肾病小鼠体内,肾脏足细胞中的SIRT6蛋白表达明显下降,体外高糖或糖基化终末产物干预后,足细胞中SIRT6蛋白的表达也会明显下降,SIRT6蛋白还能够通过抗炎、抗凋亡调控足细胞自噬进而对足细胞起保护作用。我们前期研究发现,和正常组相比,高糖组细胞凋亡率明显上升,且高糖组细胞中SIRT1蛋白表达明显下降[20]。SIRT1蛋白是SIRT6蛋白的同源蛋白,且相关研究已证实SIRT1蛋白对SIRT6蛋白具有正向调节作用[21]。
本研究结果表明,在高糖干预下,晶状体上皮细胞的增殖活性明显下降;在不同浓度葡萄糖干预下,SIRT6蛋白的表达随着葡萄糖浓度的增加而逐渐下降,我们确定了合适的高糖干预浓度为55.5 mmol·L-1;在同一高糖浓度干预不同时间后,SIRT6蛋白的表达随着高糖干预的时间延长而逐渐降低,我们确定了合适的高糖干预时间为48 h;高浓度葡萄糖使晶状体上皮细胞的细胞核出现明显核固缩、核碎裂现象,且与5.5 mmol·L-1葡萄糖组比较晶状体上皮细胞SIRT6蛋白的表达下调。
综上所述,高糖会导致人源晶状体上皮细胞损伤、增殖活性下降且凋亡明显,同时会降低SIRT6蛋白的表达,而SIRT6蛋白可以维持体内葡萄糖稳态,SIRT6蛋白可能是糖尿病性白内障导致晶状体上皮细胞损伤的关键靶基因之一。但其确切的分子机制还有待进一步研究。
