干热法灭活对新型冠状病毒肺炎相关炎症指标检测的影响
2020-10-17赵明海张雅洁杨懿祺
赵明海,李 欣,魏 东,罗 敏,张雅洁,杨懿祺,郑 磊
(南方医科大学南方医院检验科,广东 广州 510515)
由严重急性呼吸综合征冠状病毒2(severe acute respiratory syndrome coronavirus 2,SARSCoV-2)感染引起的新型冠状病毒肺炎(corona virus disease 2019,COVID-19)已对我国及全世界人民的健康造成了巨大的威胁[1-3]。我国已将其纳入《中华人民共和国传染病防治法》规定的乙类传染病,并按照甲类传染病管理。SARSCoV-2的主要传播途径是经呼吸道飞沫传播,亦可通过接触传播(手-口、粪-口),同时可能存在气溶胶传播[4]。目前,对于COVID-19的诊断、病情评估及监测主要根据各项实验室检测指标,其中检测过程中的拔盖步骤存在气溶胶传播的高风险[5]。拔盖前对病毒灭活可有效降低其传播风险,保护检验人员的安全。目前认为56 ℃ 30 min可对SARS-CoV-2进行灭活,已有报道56 ℃ 30 min灭活处理血液样本对免疫层析法及化学发光免疫分析法SARS-CoV-2抗体检测、咽拭子SARS-CoV-2核酸检测结果无明显影响[6-7]。由于COVID-19诊疗过程中涉及的实验室检查不仅包括核酸检测、抗体检测,其他实验室指标也十分重要,其中炎症标志物不仅对COVID-19的鉴别诊断意义重大,对COVID-19重症患者的病情评估及用药指导也十分重要。白细胞介素6(interleukin 6,IL-6)可以作为判断疾病严重程度和预后的生物标志物[8],C反应蛋白(C-reactive protein,CRP)和降钙素原(procalcitonin,PCT)可以作为鉴别诊断细菌、病毒感染的辅助指标[9-11]。白露等[12]发现炎症细胞因子刺激和释放治疗会使相关指标水平升高,56 ℃ 30 min水浴法灭活对CRP和PCT的检测结果无影响,对IL-6的检测结果有影响。但该研究样本量较小,且样本采集是使用带分离胶的试管,并从离心后的样本中分离出1/2血清作为灭活后检测的样本,而临床大部分实验室是使用样本采集管而非带分离胶的试管,灭活是在样本拔盖前进行,凝集后红细胞及分离血清在同一试管内。本研究扩大了样本量,并通过模拟临床实际进行灭活前处理,即收集临床中已进行过CRP、PCT和IL-6检测的样本,盖上帽盖后立即进行灭活并再次检测,进一步明确干热法灭活对COVID-19诊疗常用炎症指标的影响。
1 材料和方法
1.1 研究对象
随机选取2020年3月2日—5月28日南方医科大学南方医院检验科进行过CRP、PCT和IL-6检测,且结果尽量覆盖线性范围的无脂血、溶血的临床剩余血样本332例,其中CRP检测样本104例、PCT检测样本124例、IL-6检测样本104例。采集静脉血后,2 191×g离心10 min,收集分离的血清进行检测。本研究经南方医科大学南方医院伦理委员会审查通过(伦理号:NFEC-2018-144)。
1.2 仪器与试剂
静脉血样本采集管购自成都瑞奇科技实业有限责任公司。IL-6和PCT采用cobas e602全自动电化学法发光免疫分析仪(瑞士罗氏公司)及配套试剂(电化学发光双抗体夹心法)检测,CPR采用cobas e7500全自动生化分析仪(瑞士罗氏公司)及配套试剂(颗粒增强投射免疫比浊法)检测。干热灭活仪器为DHG-9203A型电热恒温鼓风干燥箱(上海精宏实验设备有限公司)。
1.3 方法
在当天室内质控合格的前提下,收集当天符合纳入要求、已检测CRP、PCT和IL-6且经过审核的剩余血样本,盖上帽盖后放入干燥箱进行56 ℃ 30 min干热灭活,使用经校准的温度计分别在灭活前、后对干燥箱温度进行监测。灭活后将帽盖拔去,当天重新对样本进行CRP、PCT和IL-6检测,并记录结果。
1.4 统计学方法
采用 SPSS 23.0软件进行统计分析,采用SPSS 23.0及GraphPad Prism 8软件进行绘图。非正态分布的计量资料采用中位数(M)[四分位数(P25,P75)]表示,组间比较采用配对秩和检验。采用Spearman相关分析评估灭活前、后检测结果的相关性,采用Bland-Altman法进行一致性分析,以≥95%的散点位于差值的95%可信区间内为有一致性。以P<0.05为差异有统计学意义。
2 结果
2.1 干热法灭活对CRP、PCT及IL-6检测结果的影响
与灭活前比较,332例样本灭活后均未出现肉眼可见的溶血现象。CRP灭活前、后检测结果差异无统计学意义(P=0.456),PCT、IL-6灭活前、后检测结果差异有统计学意义(P<0.001);PCT经灭活后有98例样本水平下降,其中5例超过参考区间的样本灭活后检测结果降至参考区间内(灭活前分别为0.050、0.053、0.056、0.058 及0.600 ng/mL,灭活后分别为0.040、0.046、0.049、0.047及0.042 ng/mL),1例处于医学决定水平附近(0.5 ng/mL)的样本经灭活后低于医学决定水平(由0.503 ng/mL降为0.478 ng/mL)。见表1、图1。

表1 灭活前、后3项炎症指标检测结果比较

图1 灭活前、后散点图
2.2 灭活前、后检测结果的一致性和相关性
Bland-Altman图分析结果显示,PCT、CRP及IL-6分别有96.77%、97.11%及97.11%的散点位于差值的95%可信区间内,干热法灭活前、后检测结果结果具有一致性(相对偏移分别为0.431%、0.141%、2.133%),见图2。灭活前、后PCT、CRP、和IL-6的检测结果均呈正相关(r值分别为0.992、0.999、0.966,P<0.05)。
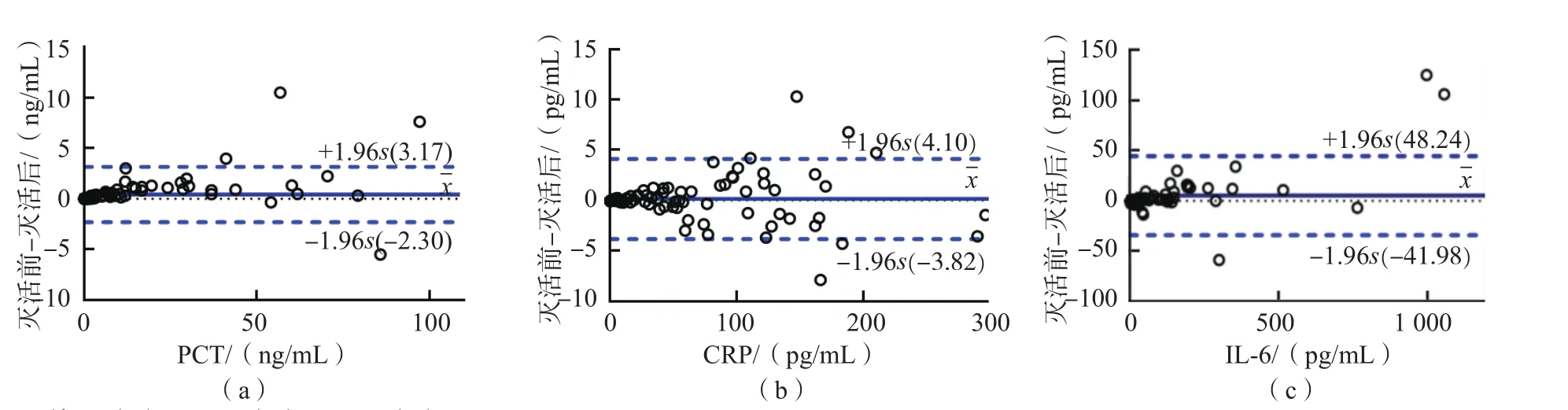
图2 热灭活前、后一致性分析
3 讨论
由SARS-CoV-2引起的疫情严重威胁着全世界人民的生命安全,尽管明确的接触史、全身症状和肺炎的影像学改变可基本确定COVID-19,但实验室检测结果仍是COVID-19确诊的金标准。由于SARS-CoV-2具有极强的传染性,检验人员在处理各种样本时面临极大的感染风险。如何减少检验工作人员的感染风险,保证实验室生物安全,引起了临床实验室的关注。目前认为SARS-CoV-2的传播途径除经呼吸道飞沫传播、接触传播外,还可能存在气溶胶传播,特别是在相对封闭的实验室中长时间暴露于高浓度气溶胶时,感染风险有可能增加[14]。尽管《新型冠状病毒感染的肺炎实验室检测技术指南(第二版)》[15]要求未经灭活的COVID-19患者相关临床样本的血清学检测应在生物安全二级实验室进行,同时采用生物安全三级实验室的个人防护,但也不能完全保证检验人员的安全。
目前,学者们认为SARS-CoV-2对紫外线和热敏感,56 ℃ 30 min、乙醚、75%乙醇、含氯消毒剂、过氧乙酸和氯仿等脂溶剂均可对其有效灭活[4]。因此,在样本开盖之前对其进行灭活可有效减少检验工作人员操作风险。本研究结果显示,56 ℃ 30 min灭活后,261例样本并未出现肉眼可见的溶血现象,灭活对CRP的检测结果无影响,对PCT、IL-6有影响,与刘兆宇等[13]报道的加热灭活对PCT检测结果无影响的结论不一致。本研究124例PCT样本经灭活处理后,有98例水平下降,其中5例超过参考区间的样本灭活后检测结果降至参考区间内。有研究结果表明,在样本采集24 h后,PCT水平在室温下大约下降12%,4 ℃条件下大约下降6%[16]。由此可见,加热灭活可能会加快PCT水平的下降。此外,PCT、IL-6、CRP灭活前、后检测结果的一致性及相关性显著。因此,临床上可考虑使用不带分离胶的常规采血管对CRP进行灭活处理,但对PCT及IL-6进行灭活需慎重。值得注意的是,由于PCT灭活后结果存在下降趋势,对于处于参考区间临界值及医学决定水平附近的结果需要谨慎处理。
相较已有的研究报道,本研究从临床更为常见的情境出发,包括使用临床上多采用的不带分离胶的采血管,离心后凝集的红细胞和血清在同一试管内等情况,对COVID-19诊疗中用于检测3项炎症指标的样本进行灭活处理,评估其操作可行性。本研究也存在一些局限性:(1)本研究只是提供策略参考,受不同仪器及检测原理的影响,不同实验室需根据自身条件评估灭活对检测结果的影响;(2)大多临床实验室CRP与血常规合并使用乙二胺四乙酸抗凝管、全血模式检测,尤其在发热门诊,但由于本实验室尚未开展此类检测,因此该类样本灭活方式及检测结果一致性需进一步验证。
本研究通过模拟临床常见灭活前处理流程,发现56 ℃ 30 min干热灭活对CRP检测结果无影响,对PCT、IL-6检测结果有影响。本研究结果可为拟通过加热灭活减少实验室SARS-CoV-2检测样本传染性风险的前处理流程提供可行性参考,在防护物资有限的情况下,干热法灭活可有效降低感染风险,保证检测人员安全。
