单株猪红斑丹毒丝菌的生物学特性及耐药性分析
2020-10-17葛晨玲蒋康富石大丽霍孔林宋星星韦德源胡传活王晓晔
葛晨玲,蒋康富,石大丽,霍孔林,宋星星,韦德源,胡传活,王晓晔
(1.广西大学动物科学技术学院,南宁 530000;2.东营市畜牧局,东营 257091)
红斑丹毒丝菌(Erysipelothx rhusiopathiae)是一种纤细或微弯曲的兼性厌氧的革兰氏阳性杆菌,可广泛感染各种动物引发丹毒[1]。猪感染红斑丹毒丝菌后,通过扁桃体和消化道及其他淋巴组织进入血液,主要临床表现为急性败血症、皮肤疹块、慢性心内膜炎和关节炎[2]。猪丹毒曾作为我国“三大猪传染性病”之一,严重影响我国畜牧业健康发展。随着疫苗的研制与使用,我国规模化猪场猪丹毒的发病明显减少,仅小型猪场和散养户有零星发病[3]。但自2012年底以来,猪丹毒在广西多地复发[4],与此同时,中国上海、湖南、安徽、江苏、山东等地也频频报道感染猪丹毒的案例,并逐年递增呈现卷土重来的趋势。
广西南宁市武鸣区某规模化肉猪场有60日龄左右保育猪700余头,2018年7月,工作人员巡栏发现急性死亡猪1只,该猪体重可达百余斤,全身红热,耳、颈、腹部皮肤发绀,背部出现菱形或方形疹块且稍隆起于皮肤表面。与病死猪同栏的大部分猪精神萎靡,不愿走动,卧地不起,体温可达40℃~42℃,呼吸困难,黏膜发绀,体表淋巴结肿大,背部也出现菱形疹块,见图1。

图1 发病猪临床症状Fig.1 Clinical symptoms of sick pigs
现场剖检病死猪,眼观呈现典型的急性败血症症状。脑部大量充血,肠系膜淋巴结、颌下淋巴结肿胀充血,呈现暗红色;肺部钝圆、肿大,表面覆盖有纤维素样物质。脾脏呈现褐红色长条状,明显的淤血肿胀;气管内含有大量粉红色泡沫,关节腔内有积液,见图2。本研究通过对分离到的细菌进行生物学特性和耐药基因分析,以期掌握其生物学特性并为临床用药提供指导性意见。

图2 死亡猪剖检图Fig.2 Anatomy of a dead pig
1 材料和方法
1.1 样品来源2018年7月,广西武鸣区某规模化肉猪场病死保育猪(60日龄左右)。
1.2 主要培养基和试剂TSB营养琼脂、绵羊血琼脂固体培养基购自南宁百赛斯生物试剂公司;2×TaqMasterMix、DL2000 DNA marker及细菌基因组DNA提取试剂盒(离心柱型)购自天根生物科技有限公司;药敏纸片购自杭州微生物试剂有限公司。
1.3 细菌的分离鉴定将采集的样品在无菌操作环境下,用平板划线的方式接种于绵羊血琼脂固体培养基,37℃培养20 h,挑取大小一致,色泽鲜明的单个可疑菌落进行革兰氏染色并镜检,以观察细菌的形态及生物学特性。
1.4 细菌的16S rRNA的PCR检测参照细菌DNA提取试剂盒说明书方法提取分离菌株基因组DNA。设计16S rRNA通用引物。上游引物:5'-AGAGTTTG ATCCTGGCTCAG-3',下游引物:5'-ACGGCTACC TTGTTACGACTT-3',引物由华大基因合成。反应体系(25 μL):2×TaqMaster Mix 12.5 μL,上、下游引物各1 μL,DNA模板2 μL,用ddH2O补至25μL。反应程序:94℃预变性5 min;94℃变性50 s,52℃退火30 s,72℃延伸40 s,共35个循环;72℃终延伸10 min。将PCR产物经1.5%琼脂糖凝胶电泳后胶回收后测序,测序结果与GenBank中参考株的基因序列进行同源性比较。
1.5 生物被膜体外形成测定参考文献[5]利用TSB肉汤培养分离菌株20 h后,按1∶1000稀释后,加入到聚丙乙烯无菌培养板中,每孔200 μL;以无菌肉汤作阴性对照。将培养孔分别在28℃和37℃静置培养24 h,弃菌液洗涤烘干后,采用结晶紫染色,用乙酸充分溶解后测定570 nm处D值。将阴性对照的平均D值加上其标准差定义为ODC,待测菌株D值与ODC比较,将生物膜形成能力分为4个等级,阴性(-):D570
1.6 毒力基因检测参考文献[6-7]扩增神经氨酸酶(Sialidase)、荚膜多糖(CPS-A)、黏附素(RspA)、表面保护性抗原(SPaA)4种毒力因子,具体信息见表1,由华大基因合成。反应体系(25 μL):2×TaqMaster Mix 12.5 μL,上、下游引物各1 μL,DNA模板2 μL,用ddH2O补至25 μL。反应程序:95℃预变性5 min;94℃变性30 s,相应的退火温度具体见表1;退火30 s,72℃延伸60 s,共34个循环;72℃终延伸5 min。

表1 毒力基因引物序列信息Table 1 Sequence information of the primers for virulence gene
1.7 药敏试验采用WTO推荐的Kirby-Bauer(K-B)纸片琼脂扩散法测定22种抗菌药物的耐药性,参照美国临床与实验室标准化协会(CLSI)文件(M100-S21)进行结果判定。
1.8 耐药基因检测参考文献[8-9]扩增β-内酰胺酶类blaOXA、blaSHV、blaTEM和磺胺类Sul1、Sul2共5种耐药基因,具体信息见表2,由华大基因合成。反应体系(25 μL):2×TaqMaster Mix 12.5 μL,上、下游引物各1 μL,DNA模板2 μL,用ddH2O补至25 μL。反应程序:95℃预变性5 min;94℃变性30 s,相应的退火温度见表1;退火30 s,72℃延伸60 s,共34个循环;72℃终延伸5 min。
2 结果
2.1 细菌的分离鉴定该菌落在含有5%胎牛血清和烟酰胺腺嘌呤二核苷酸(Nicotinamide adenine dinucleotide,NAD)的绵羊血琼脂固体培养基上表现为灰白色、半透明、边缘齐整、如针尖麦芒样细小的菌落。经镜检,该菌呈现稍直或稍弯的杆状,以单个或链状存在,有丝状菌毛,无芽孢,无运动性的革兰氏阳性菌,疑似猪红斑丹毒丝菌,将其命名为GXWMZD1,见图3。

表2 耐药基因引物Table2 Primers for drug resistance genes
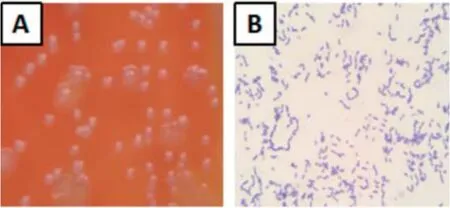
图3 细菌的分离鉴定Fig.3 Isolation and identification of bacteria
2.2 细菌的16S rRNA的PCR检测分离菌株经16S rRNA PCR扩增,结果显示,扩增出1条1437 bp的条带(图4),与预期目标条带大小一致,与阳性对照相同,且阴性未扩增出条带,将测序得到的序列与NCBI公布的序列进行同源性比对,结果表明,分离菌株与猪红斑丹毒丝菌在基因关系上最接近,同源性高达99.9%,证实该分离菌株为猪红斑丹毒丝菌。
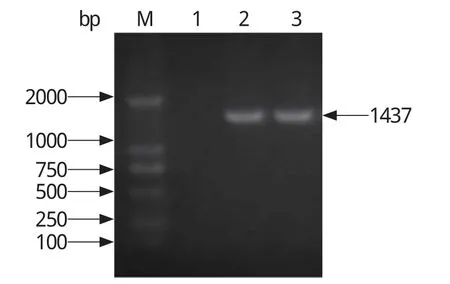
图4 细菌的16S rRNA的PCR检测Fig.4 PCR detection of bacterial 16S rRNA
2.3 分离菌株的同源性及进化树分析利用DNAStar软件对所测序列和GenBank中公布的国内外猪丹毒杆菌的16S rRNA序列进行比对,具体菌株信息见表2,该菌株与比对菌株的同源性基本为91.9%~99.6%(图6),与中国广西2014年分离株Er.GXGG-1同源性最高,可达99.6%。经遗传进化树分析,结果表明,分离菌株GXWMZD1与来自中国广东的GD-GZ菌株位于同一分支上,与ZYL、SY1027、WC14.1、QY13.1、Er.GXGG-1等菌株分离地同为中国,且处于同一分支上(图7)。

表3 同源关系比对菌株信息表Table 3 Homologous relationship comparison strain information table
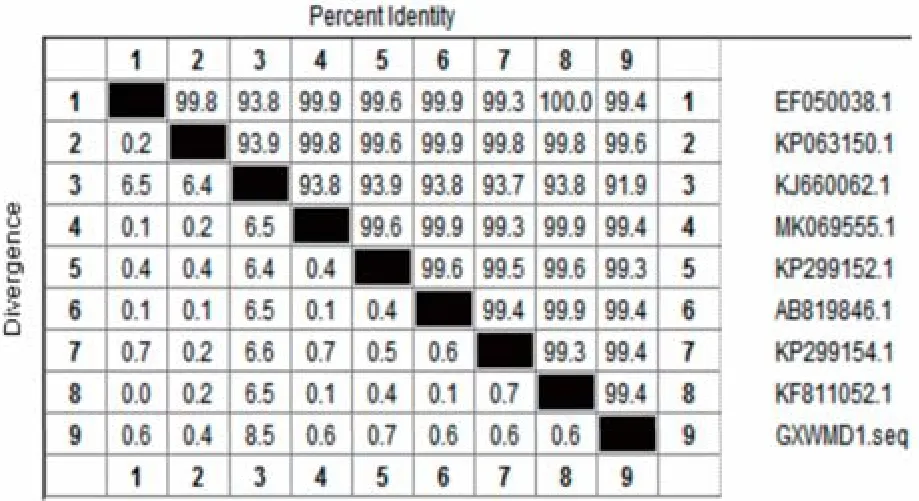
图5 16S rRNA基因核苷酸序列同源性比对Fig.5 Homology comparison of 16S rRNA gene nucleotide sequence

图6 16S rRNA基因核苷酸序列遗传进化树Fig.6 Phylogenetic tree of nucleotide sequence of 16S rRNA gene
2.4 生物被膜体外形成测定结果采用微孔板半定量粘附法对生物被膜体外形成进行测定,结果显示,分离菌株在28℃培养24 h后,D570的平均值为1.615,标准差为0.322,阴性对照为0.157,标准差为0.090,表明分离菌株在28℃形成能力适中(4+),分离菌株在37℃培养24 h后,D570的平均值为0.517,标准差为0.177,阴性对照为0.090,标准差为0.011,表明菌株在37℃形成能力适中(4+),比较分离菌株在28℃和37℃形成生物被膜的能力显示,28℃更有利于分离菌株的生物被膜形成(图7、8)。

图7 生物被膜体外形成结果Fig.7 Results of biofilm formation in vitro

图8 生物被膜体外形成结果统计图Fig.8 Results of statistical graph biofilm formation
2.5 毒力基因检测结果通过PCR的方法扩增荚膜多糖(CPS-A)、黏附素(RspA)、表面保护性抗原(SPaA)、神经氨酸酶(Sialidase)4种毒力因子。结果表明,扩增出CPS-A(1168 bp)、RspA(1186 bp)、SPaA(1800 bp)3种毒力因子,条带大小与预期目标条带大小一致,与阳性对照相同,且阴性未扩增出条带,神经氨酸酶(Sialidase)未扩增出条带,具体结果见图9。
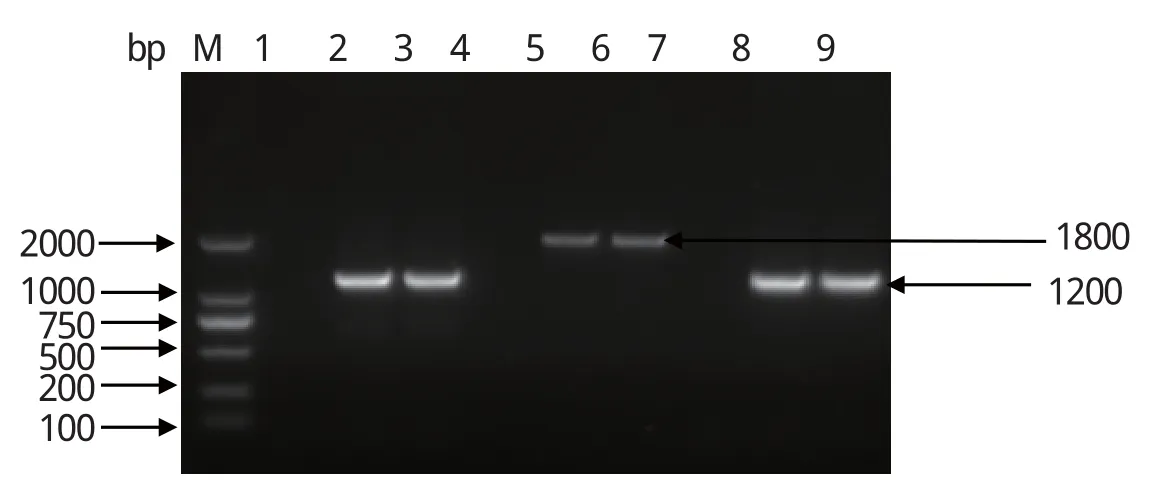
图9 毒力因子检测结果Fig.9 Results of virulence factor test
2.6 药物敏感性检测结果通过WTO推荐的Kirby-Bauer(K-B)纸片琼脂扩散法测定22种抗菌药物的耐药性,参照美国临床与实验室标准化协会(CLSI)文件(M100-S21)进行结果判定。见表3,其中总耐药率为68.18%(15/22)中介率为13.64%(3/22),仅对米诺环素、多西环素、恩诺沙星、氟苯尼考4种药物敏感,敏感率只有18.18%(4/22)。对于氨基糖胺类、大环内酯类、磺胺类7种药物的耐药率可到100.00%,β-内酰胺类药物除头孢哌酮外,对其余的4种药物均耐药,占受试药物的80.00%,但头孢哌酮的抑菌环直径可达20 mm,属于中介的边缘,其敏感度有进一步向耐药转化的趋势。
2.7 耐药基因检测药敏结果显示分离菌株对β-内酰胺类、磺胺类的药物耐药率较高,进行针对性的耐药基因扩增,扩增β-内酰胺酶类blaOXA、blaSHV、blaTEM,磺胺类Sul1、Sul2共5种耐药基因。PCR结果显示(图10),扩增出blaTEM(788 bp),Sul2(435 bp)2种耐药基因,与目标条带的大小一致,阴性未扩增出条带,该结果与药敏实验的结果呈现正相关。
3 讨论
本研究从某规模化肉猪场急性死亡的保育猪(60日龄左右)中成功分离出1株猪红斑丹毒丝菌,通过细菌的分离鉴定、16S rRNA的扩增、生物被膜的形成条件等方法对其生物学特性进行分析。细菌生物膜可作为一种生物屏障系统,使存在于其中的菌体(被膜菌)相对于其单个浮游状态的菌体(浮游菌)对抗菌药物表现出更强的抗性[10],而胞外基质能有效的抑制免疫细胞的吞噬作用[11]。生物膜一旦形成,膜内细菌比浮游细菌耐药性增加100~1000倍以上[12-13]。当致病菌通过群体感应效应形成生物膜,则会导致顽固性疾病难以根治[14-15]。相较于37℃,该分离菌株在28℃时生物被膜体外形成的能力更强。夏季猪场的饲养环境的平均室温可达28℃,一些圈舍设备、饲槽上的细菌可能乘机肆意生长,体外被膜的形成助长其对消毒剂的抗性,为疾病的形成提供了温床。

表4 药物敏感性试验结果Table 4 Results of drug sensitivity test

图10 分离细菌耐药基因检测Fig.10 Detection of isolated bacterial resistance genes
本研究通过药物敏感性试验、耐药基因的检测等试验方法,对分离菌株的耐药情况进行鉴定。对于受试的22种药物来说,该菌株仅对米诺环素、多西环素、恩诺沙星、氟苯尼考4种药物敏感,敏感率仅为18.18%(4/22),且扩增出β-内酰胺酶类blaTEM(788 bp),磺胺类Sul2(435 bp)2种耐药基因。由此可见,该菌株的药物敏感性差,耐药谱广,多重耐药情况严重。本研究与陆英杰等[16]对从广东分离的5株猪红斑丹毒丝菌均对林可霉素耐药、恩诺沙星敏感的结果一致,与陆萍等[17]对安徽分离到的28株猪红斑丹毒丝菌对氨 西林、青霉素敏感的试验结果略有差异,与唐爱明等[18]对湖南长沙分离到的3株猪红斑丹毒丝菌对磺胺类药物耐药的结果一致,与曾文斌等[19]从江西分离到的2株猪丹毒杆菌对β-内酰胺酶类药物高度敏感的试验结果并不相符,这可能与临床用药习惯有关[20]。目前,大多数对于猪丹毒红斑丝菌的研究仅停留于各种药物的敏感性,并未对耐药基因进行检测。本研究表明耐药表型与耐药基因呈现正相关,该菌株为复合基因型耐药菌株,应加强耐药性检测,谨防敏感菌转化为耐药菌。
综上所述,本研究已成功分离出1株猪红斑丹毒丝菌,并对其生物学特性进行测定,该菌株生长迅速,生物被膜体外形成能力强,扩增出荚膜多糖CPS-A、黏附素RspA、表面保护性抗原SPaA共3种毒力基因,多重耐药情况严重,扩增出β-内酰胺酶类blaTEM、磺胺类Sul2 2种耐药基因。
