天然免疫系统的双链RNA受体及其抗病毒研究进展
2020-10-17李双洁周荣云朱美芹朱建中
何 珊,李双洁,周荣云,朱美芹,朱 聪,朱建中
(1.扬州大学兽医学院,扬州 225009;2.扬州大学比较医学研究中心,扬州 225009;3.江苏省动物重要疫病与人兽共患病防控协同创新中心,扬州 225009;4.农业与农产品安全国际联合研究实验室,扬州 225009)
天然免疫系统存在于所有多细胞动物中,是机体抗感染机制中的第一道防线。模式识别受体(pattem recognition receptor, PRRs)能够识别病原体相关分子模式(pathogen-associated molecule patterns,PAMPs),从而区分非机体自身的病原微生物[1-4]。模式识别受体主要包括Toll样受体(toll-like receptors,TLRs)、NOD样受体(NOD-like receptors,NLRs)、RIG-I样受体(RIG-I receptors,RLRs)、C型凝集素样受体(C-type lectin receptors,CLRs)和胞质中的DNA识别受体等。
第一大类PRRs是TLRs,最早被发现。目前家族内至少包括11名成员,可分别识别不同的PAMPs[5]。TLR1、2、4、5、6、10表达于细胞表面,TLR3、7、8、9主要定位于细胞质中内体。第二大类是核苷酸结合寡聚化结构域受体NLRs[6],是胞质内识别受体,能够识别细菌细胞的脂多糖和肽聚糖等多种组分。所有NLR成员具有相似的结构域结构:N末端效应结构域,中间核苷酸结合和寡聚化结构域(nucleotide binding oligomerization domain,NOD)和C-端富含亮氨酸的重复序列(LRR)[7]。基于N末端效应结构域,NLR分为5个亚家族:NLRA(核酸激活结构域)、NLRB(细胞凋亡重复的杆状病毒抑制剂)、NLRC(半胱天冬酶活化募集结构域 CARD)、NLRP(Pyrin结构域,PYD)和NLRX(未知域名)[8]。除NOD1和NOD2外,所有NLR激活后均诱导炎性小体产生。第三类是视黄酸/维甲酸诱导基因Ⅰ样受体RLRs,是胞质内重要的抗病毒识别受体[9]。RLRs包括视黄酸诱导基因Ⅰ(RIG-I)、黑素瘤分化相关基因5(MDA5)和LGP2。很多细胞通过该受体家族识别病毒RNA或其复制中间产物,在抗病毒天然免疫中起重要的作用。第四类是C型凝集素样受体CLRs,最早被认为是Ca2+依赖型受体,具有碳水化合物识别域(carbohydrate recognition domain,CRD),有碳水化合物结合活性。CLRs可分为跨膜型和分泌型两种,跨膜型的主要代表为选择素家族、MR家族等,分泌型主要为胶原凝集素家族[10]。第五类为胞浆内DNA识别受体包括cGAS、DAI、AIM2、DDX41、IFI16、DHX9、DHX36、DDX60、DNAPK、MRE11等,是较晚发现的PRRs,主要存在于胞质中,部分存在于细胞核,如:IFI16、DNA-PK和MRE11。另外还有其他一些受体家族,如清道夫受体、甲酸基多肽受体、补体受体等[11]。
宿主PRRs识别并感知来自病毒、细菌、真菌和原生动物等的各种PAMPs,其范围从脂蛋白、碳水化合物、脂多糖到核酸。其中,DNA和RNA作为重要的PAMPs得到了广泛的关注。病毒DNA和RNA最为典型,病原体在细胞内大量复制,并积累大量的核酸,能被细胞内PRRs识别。识别DNA的受体除前面提及的胞浆内DNA受体外,还有内体TLR9[12];识别RNA的受体是TLR3、TLR7、TLR8、RIG-I,MDA5、LGP2、NLRP3和NOD2等。由于RNA病毒表现出快速的复制动力学、高突变率和复杂的进化动力学的特点,引发动物疾病的危害性更大,因此研究和了解RNA受体在识别RNA病毒感染和启动保护性免疫应答中发挥的作用,受体相互之间是否存在协同或拮抗关系对控制RNA病毒感染、保护宿主和促进养殖业发展尤其重要[13]。RNA受体包括识别单链RNA(single-stranded RNA,ssRNA)的受体(TLR7和TLR8),还有识别双链RNA(doublestranded RNA,dsRNA)受体(TLR3、RIG-I、MDA5、LGP2和NLRP3等),后者在抗病毒免疫中起到更广泛的作用。养猪业常见的病毒性疾病包括猪瘟、猪繁殖与呼吸综合征(俗称“蓝耳病”)、口蹄疫、流行性腹泻病毒病和传染性胃肠炎等,养禽业常见的病毒性疾病包括禽流感和新城疫等,这些病毒均属于单链RNA病毒,但病毒复制过程中形成的复制中间体dsRNA都能被dsRNA受体所识别。本文主要针对几种重要的dsRNA受体TLR3、RIG-I和MDA5及其抗病毒作用进行综述。
1 dsRNA受体TLR3结构和功能
所有TLRs都是I型跨膜蛋白,由N端胞外域或细胞外结构域(ECD),中间跨膜结构域(TM)和C端细胞质Toll/IL-1受体(Toll/IL-1-receptor homologous region,TIR)结构域组成。TIR是一个高度保守的蛋白质互作区域,在TLRs的信号传导中发挥重要作用。ECD含有20~26个富含亮氨酸的重复序列(LRR),形成马蹄形螺线管或环状结构。这些LRR与病原的识别有直接联系。单个LRR包括α螺旋和β折叠,每个LRR的α螺旋位于螺线管结构的凸面上,而每个LRR的β折叠组装并形成螺线管结构的凹面。与其他含LRR的蛋白质不同,TLR在马蹄型结构侧凸表面上结合其配体包括激动剂[14]。所有TLR活化都需要形成M形二聚体或多聚体,使得两个TLR ECD的C末端区域接近,反过来导致细胞质TIR结构域的多聚化,通过TIR同源结构域相互作用来募集下游衔接蛋白/接头蛋白,进一步形成称为信号体的信号复合物并激活下游转录因子:一种是核因子κB转录因子(NF-B),能够诱导促炎性细胞因子的表达;另一种是干扰素调节因子(interferon regulatory factor,IRF),诱导抗病毒I型干扰素(interferon,IFN)的产生[15]。
TLR3广泛分布于除浆细胞样树突状细胞(pDC)和中性粒细胞之外的所有先天免疫细胞中,并在内质网(endoplasmic reticulum,ER)合成后通过跨膜蛋白UNC93B1转运到细胞内体中[16]。TLR3识别病毒的双链RNA(dsRNA)、人工合成的dsRNA类似物聚肌苷酸-聚胞苷酸(poly I:C)和宿主的mRNA[17]。TLR3胞外区(ECD)的晶体结构是TLR蛋白中第一个被解析的晶体结构,以螺线管结构单体形式存在。在与dsRNA结合时,TLR3 ECD N和C端的侧凸面正电荷区域与带负电荷的dsRNA磷酸戊糖骨架结合,并形成二聚体[18]。Sarkar等[19]发现,与其他TLRs不同,TLR3胞浆侧的肽链中含有5个酪氨酸残基(Tyr),分别为Tyr733、Tyr756、Tyr759、Tyr764和Tyr858。Tyr733和Tyr759突变成苯丙氨酸(Phe)时能降低识别dsRNA后活化的效率,当这些酪氨酸残基全部突变时,dsRNA引导的信号识别被阻断。这一发现对TLR3信号传导认识至关重要。
2 dsRNA受体RIG-I和MDA5结构与功能
RLRs几乎在所有哺乳动物细胞类型中表达,并且作为细胞浆RNA受体的主要家族,在病毒识别和保护性免疫应答中起关键作用[20-21]。原型RIG-I最初是通过筛选cDNA文库被发现的[22-23],该家族的其他成员包括MDA5和LGP2。RIG-I和MDA5具有相似的结构域结构:N端有两个半胱天冬酶活化募集结构域(2CARDs);中间为RNA解旋酶结构域,能够和C端结构域一起结合RNA;C端是编码自身活化抑制域(RD),或被称为调节结构域(RD),负责识别并结合病毒RNA。没有病毒感染时,RIG-I呈静息状态,活性区2CARDs与CTD和RNA解旋酶结构域结合,后者阻止2CARDs与修饰蛋白接触活化[24]。尽管RIG-I和MDA5在结构上很类似,但两者在RNA识别中还是具有一定差异性,RIG-I能够识别5'-三磷酸dsRNA(5'-ppp-dsRNA)和短链dsRNA(<300 bp),而MDA5优先识别的是长链dsRNA(>1000 bp)。5'-pppRNA是多数病毒RNA在胞质中合成时会出现的一种特异性修饰。Poly I:C是人工合成的dsRNA类似物聚肌苷酸-聚胞苷酸,各种长度dsRNA的混合物,因此也可以被RIG-I和MDA-5识别。第三个成员LGP2缺乏N端的2CARDs,没有信号传导活性[25],但由于能够结合RNA,LGP2可以调节RIG-I和MDA5信号传导[20,26]。
3 dsRNA识别受体 TLR3、RIG-I和MDA5的信号通路
机体的天然免疫通过识别入侵的病原微生物(如病毒)的PAMPs,然后释放有抗病毒作用的细胞因子(如IFN-I)从而诱导机体产生抗病毒免疫反应,并将病毒清除。TLR3是第一个被报道的dsRNA病毒受体,可识别病毒的双链RNA(dsRNA)和dsRNA的人工合成类似物poly I:C。TLR3是唯一不使用MyD88作为衔接蛋白的TLR,而是使用诱导β干扰素的TIR结构域衔接蛋白(TIR domain containing adaptor inducing interferon-β,TRIF)作为其下游接头分子。TLR3活化后通过自身的TIR结构域基于同源作用募集TRIF,推测形成信号复合物Tiffosome,进而结合肿瘤坏死因子受体相关因子(TNF receptor associated factors,TRAF)3和6,分别激活蛋白激酶TBK1/IKKε和IKK/IKKβ。最终引起下游两类转录因子IRF3/7和NF-κB的转位入核并引起活化,分别诱导Ⅰ型IFN尤其是IFN-β和炎症细胞因子的产生(图1),诱导机体产生抗病毒反应。
RIG-I和MDA5作为胞浆内的模式识别受体,识别病毒来源的双链RNA,活化途径类似,但具有识别不同病毒入侵的功能。病毒感染宿主后,RIG-I和MDA5识别配体dsRNA后被活化,在ATP水解酶的作用下构象发生了改变,暴露CARDs,并由细胞浆转移到一个线粒体相关膜上,在此与含有CARD结构域的线粒体抗病毒信号蛋白(MAVS,也称CARDIF/VISA/IPS-1)同源结构域相互作用,引起MAVS的活化。MAVS是RIG-I和MDA5下游的接头蛋白,通过招募TRAF3进而激活蛋白激酶TBK-1和IKKε,磷酸化并激活转录因子IRF3/7。活化的IRF3/7从细胞质转移到细胞核中,从而诱导具有抗病毒作用的I型IFN的生成[27]。同时,活化的MAVS还可以借助TRAF6、FADD、RIPI、TRADD、Caspase8/10将信号传导给IKK复合物(IKKα、IKKβ、IKKγ),进而导致NF-κB活化,活化后NF-κB二聚体进入细胞核调节促炎因子和相关趋化因子产生(图1)。研究发现,CARD缺失的RIG-I可抑制干扰素产生[28]。另外,还有一种接头分子STING也可以与RIG-I、MAVS相互作用活化IRF,但STING在RLR信号转导中具体作用机制尚不清楚[29]。
4 dsRNA受体间的相互作用
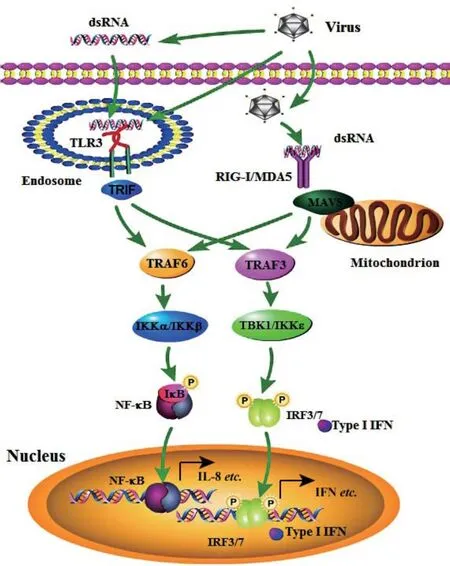
图1 dsRNA介导的TLR3和RIG-I/MDA5信号途径Fig.1 The signaling pathways triggered by dsRNA and mediated by TLR3 and RIG-I/MDA5
不同PRRs识别不同PAMPs,引发多种信号通路。而各种通路间也存在一些交叉互作,由此形成了巨大的病原微生物-天然免疫相互作用网络。在此列举几个已知相互关系的例子:病毒感染激活RLRs后诱导的IRF3信号竞争性占据IL-12启动子后会抑制细菌感染后TLRs所诱导的IRF5信号,表明RLRs和TLRs途径之间存在着某种抑制作用[30]。RIG-I在病毒感染后,可以促NLRs介导的炎性小体活化和IL-1β的成熟[31],但是NLRs对RLRs介导的Ⅰ型IFN产生起负调控作用[32],表明RLRs和NLRs信号通路间也存在相互作用。TLRs和NOD蛋白在细菌感染宿主时起关键作用。一方面,NOD1和NOD2刺激剂与TLR2、TLR3、TLR4和TLR9刺激剂都可以促进树突状细胞和嗜碱性粒细胞的成熟,具有协同作用;另一方面,NLRs抑制TLRs信号的调控。表明TLRs与NLRs也相互影响[33]。就dsRNA受体而言,同属RLRs家族却缺失2CARDs的LGP2和RIG-I竞争性地结合病毒RNA,能负调控RIG-I信号[34]。相反,该蛋白导致MDA5免疫应答信号上调[35]。TLR3可以促进西尼罗河病毒(West nile virus,WNV)的复制和发病[36];而RIG-I激活caspase-12可以抵抗WNV[37]。这提示TLR3和RIG-I在WNV感染中存在某种拮抗作用。有了对以上受体间相互作用的初步了解,不禁思考TLR3、RIG-I和MDA5既然都能够识别dsRNA,又分别属于TLRs和RLRs,那么三者之间尤其在不同动物种属中是否也存在着某种具体相互作用?目前我们对家猪(Porcine,p)TLR3,RIG-I和MDA5初步研究显示,在共转染人293T细胞和基因敲低猪细胞中,pTLR3可以负调控pRIG-I和pMDA5下游组成性NF-κB活性,反过来,pRIG-I和pMDA5却都能正调控TLR3下游刺激诱导性IRF活性。以上结果表明,不同家猪dsRNA受体的免疫应答信号通路之间存在着或协同或拮抗的截然不同作用。如果在不同猪病毒感染条件下,这些dsRNA受体间的相互作用情况可能还会不一样,虽然受体间相互作用复杂,但值得深究。
5 dsRNA受体的抗病毒作用
TLRs和RLRs的主要区别在于细胞定位和特异性配体的不同,这些促成了宿主细胞复杂的抗病毒防御机制。TLR3识别呼肠孤病毒(Reovirus)的基因组dsRNA,也识别其他病毒复制中间体dsRNA,激发保护性免疫反应,从而限制病毒复制;这些病毒包括脑心肌炎病毒(Encephalomyocarditis virus,EMCV)、禽流感病毒(Avian influenza virus,AIV)、在猪繁殖与呼吸综合征病毒(Porcine reproductive and respiratory syndrome virus,PRRSV)和鸡马立克氏病病毒(Marek's disease virus,MDV)等[38]。体内研究显示,TLR3在宿主抗小鼠巨细胞病毒(Mouse cytomegalovirus,MCMV)感染中起一定作用[39-40]。鸡感染高致病性禽流感(Highly pathogenic avian influenza,HPAI)H5N1 24 h后,在各类脏器如脾脏、肺脏和脑组织中发现TLR3和IFN-β表达水平显著上调[41]。另外发现,PRRSV感染猪6 h左右,肺泡巨噬细胞(pulmonaryalveolar macrophages,PAMs)和外周血单核细胞(peripheral blood mononuclear cell,PBMCs)中TLR3的表达受到抑制,然而在感染24 h后PAMs和未成熟树突状细胞(immature dendritic cells,imDCs)正常表达TLR3[42]。TLR3对这些病毒是否有抵抗作用以及抗病毒机制尚不清楚,有待进一步研究。TLR3信号通路在抗疱疹病毒感染以及抗肿瘤免疫中起着不可替代的作用:MDV是一种α亚科疱疹病毒,近期结果显示,激活TLR3应答不仅能在体外有效抑制MDV的复制,同时也能够明显抑制体内MD肿瘤的发生和发展。这为开发新型MDV疫苗以及抗肿瘤药物提供了一定的参考价值和理论依据[43]。
病毒感染期间,其复制产物多在细胞浆中积聚,因此,RIG-I和MDA5诱导的应答比在细胞内体TLR3诱导的应答更能持久和显著。RIG-I特异性识别大多数单负链RNA病毒,其在复制期间产生大量短的5'ppp-dsRNA。这些病毒包括副粘病毒家族的新城疫病毒(Newcastle disease virus,NDV)、正粘病毒科的流感病毒、弹状病毒科的水疱性口炎病毒(Vesicular stomatitis virus,VSV)和狂犬病病毒(Rabies virus,RV)等。RIG-I还识别单正链RNA病毒,例如日本脑炎病毒(Japanese encephalitis virus,JEV)。此外,还有一些DNA病毒也被RIG-I感知,如腺病毒和痘苗病毒,因为这些病毒在复制过程中通过Ⅲ型RNA聚合酶产生小的dsRNA。MDA5识别长链dsRNA,例如小核糖核酸病毒科的EMCV[44]。另一方面,RIG-I和MDA5都交叉检测相同的病毒,如:呼肠孤病毒科的轮状病毒(Rotavirus)[45]、经典猪瘟病毒(Classical swine fever virus,CSFV)等[46]。CSFV感染期间,一方面,TLR3感知复制中间体dsRNA[47-49],诱导IFN-β基因的表达。另一方面,细胞浆中存在的病毒RNA通过RIG-I和MDA-5识别[50]。Dong等[51]发现CSFV通过RIG-I和MDA-5依赖的IRF-3和NF-κB途径诱导I型IFN的表达。
6 了解dsRNA受体及其信号通路能够改善抗病毒策略
dsRNA是细胞功能广泛且有效的调节剂,其作用由dsRNA结合蛋白或受体介导,在相关病毒疾病的发现和治疗中起重要作用。研究RNA受体,包括细胞内定位、配体识别结合、结构与功能、激活机制、细胞信号传导途径,以及不同RNA受体之间的相互作用,有助于理解病毒感染和有效应对。首先,不同病毒RNA由不同RNA受体识别,并激活细胞信号和产生应答反应,在这种情况下,了解RNA受体对所识别的病毒种类变得至关重要。其次,不同受体感知配体的细胞种类和细胞内定位不同,已知TLR3、TLR7、TLR8主要在巨噬细胞和树突状细胞(dendritic cells,DC)中表达,并识别由细胞吞噬到达细胞内体的病毒RNA,而RLRs(RIG-I,MDA5)普遍表达于细胞浆,感知细胞浆内的病毒RNA,因此,将RNA受体刺激剂递送进细胞的途径对于是否能够激发更有效的免疫应答尤为关键。比如,polyI:C直接加入细胞主要激发TLR3活化途径,而通过转染方式激发RIG-I和MDA5活化。第三,基于RNA受体的配体识别和激活机制,可以开发具有更高效力的小分子激动剂,直接用于抗病毒治疗,或制作出有效的病毒疫苗佐剂。第四,针对TLRs、RLRs、NLRs相互作用,虽然目前信息不完整,但可以基于受体互作调节信息,考虑组合使用不同刺激剂,以达到最优抗病毒效果[52]。
7 总结
本文描述了在识别病毒时起关键作用的dsRNA受体TLR3、RIG-I和MDA5的结构、信号通路及抗病毒作用,旨在阐明这些不同类别dsRNA受体在识别配体和激发下游信号活性中的区别及关联。迄今为止,已经有很多关于TLR3和RLRs(RIG-I/MDA5)对病毒识别并诱导免疫应答的研究,但两者在dsRNA识别结合配体、激活机制以及诱导细胞信号传导途径过程中是否相互促进或抑制尚待进一步研究。同样,不同的病毒感染或感染的不同阶段,TLR3和RLRs相互作用是否会发生变化?以及TLR3主要互作于RIG-I还是MDA5?RIG-I对TLR3的影响是否与MDA5对TLR3影响类似?随着时间的推移和科技手段的进步,人们对于天然免疫尤其是信号通路方面研究越来越深入。但RNA病毒种类繁多,尤其是不同种属动物的RNA病毒,因而需要更加完善和深入的RNA受体免疫生物学理解和认识。相信上述疑问的解决能够给抗动物病毒免疫研究和疾病治疗方面带来重要启发。
