藏猪甲基转移酶3a基因的SNP筛选及其在精子中的表达分析
2020-10-17赵彦玲李善政王福成王建洲任子利
赵彦玲,李善政,王福成,王建洲,任子利
(西藏农牧学院 动物科学学院,西藏 林芝 860000)
DNA甲基化在调节基因表达、基因组稳定性和细胞命运承诺方面起着关键作用[1],在哺乳动物精子发生过程中也发挥着重要作用[2]。DNA甲基转移酶3a(Dnmt3a)是主要的从头甲基化酶之一,其表达水平会影响到全基因组DNA甲基化的水平,从而调控基因表达[3]。藏猪是我国特有的能适应高原环境的一个重要品种[4],其雄性生殖系统已适应高海拔条件[5]。对藏猪Dnmt3a基因进行单核苷酸多态性(SNP)筛选并分析其在精子中的表达,有助于高繁殖力藏猪的分子育种等工作的开展。LIU等[6]研究发现,Dnmt3a启动子多态性与辅助生殖技术和自然受孕后的人类自然流产风险相关。波兰人群中Dnmt3a基因变异与卵巢癌风险有关[7]。ZENG等[8]采用qRT-PCR和ELISA方法对新鲜和超低温保存的猪精子中Dnmt3a的mRNA表达和蛋白质水平进行检测,发现该基因在超低温保存后的精子中,其mRNA表达水平显著低于新鲜精子,而蛋白质表达水平差异不显著。笔者所在课题组研究了Dnmt3a在藏猪与大白猪睾丸中的mRNA表达水平,发现藏猪睾丸组织中,Dnmt3a基因mRNA相对表达量显著低于大白猪[9]。有研究表明,Dnmt3a敲除小鼠的精子发生受损并出现异常的父系印迹[10]。Dnmt3a基因对精子正常发生至关重要[11],但目前尚未见对藏猪Dnmt3a基因进行SNP筛选并分析其在精子中表达的研究。因此,采用PCR-直接测序法对藏猪Dnmt3a基因5′侧翼区和编码区进行SNP筛选,分别应用实时荧光定量PCR技术、Westen blot方法对藏猪Dnmt3a基因在精子中的mRNA、蛋白质表达水平进行研究,旨在为阐述藏猪精子高原适应性的DNA甲基化机制及高繁殖力藏猪的分子育种等研究提供参考。
1 材料和方法
1.1 材料
1.1.1 样品采集及处理 采集藏猪、大白猪和滇南小耳猪各50个个体的耳组织以筛选Dnmt3a基因的SNP。藏猪、大白猪的精液分别取自西藏农牧学院实习基地与西藏林芝嘎玛养殖有限责任公司。用手握法分别采集10头健康藏猪、大白猪精液,取中段精液,3层纱布过滤,将精子活率在80%以上的精液放入保温瓶立即运回实验室。将精液在4 ℃条件下2 000 r/min离心10 min,分离出精子细胞。用预冷的PBS溶液重悬精子细胞,再次离心10 min进行洗涤,重复2次。将洗涤后的精子立即用于总RNA及蛋白质提取或存于-80 ℃备用。
1.1.2 主要试剂与仪器设备 FastQuant cDNA第一链合成试剂盒购自天根生物技术有限公司;2×TaqPCR Mix购自北京百泰克生物技术有限公司;TransStart Eco Green qPCR SuperMix购自北京全式金生物技术有限公司;Trizol、蛋白质抽提试剂、BCA蛋白质浓度测定试剂盒(增强型)、抗体稀释液、封闭液、ECL底物发光显色试剂盒、蛋白质Marker、β-actin小鼠单克隆抗体、Dnmt3a兔单克隆抗体、辣根过氧化物酶标记山羊抗小鼠IgG(H+L)、辣根过氧化物酶标记山羊抗兔IgG(H+L)等均购自碧云天生物技术研究所。
PCR仪、Eppendorf Centrifuge 5417R、5415R离心机购自德国Eppendorf公司;Boi-Rad凝胶成像系统、CFX96荧光定量实时PCR仪购自美国Bio-Rad公司。
1.2 引物设计与合成
从GenBank中获得猪Dnmt3a基因cDNA序列(NM_001097437)和5′侧翼区2 500 bp的DNA序列,利用软件Primer Premier 5.0设计8对引物,可以扩增该基因cDNA和5′侧翼区2 500 bp的DNA序列,引物信息见表1。

表1 猪Dnmt3a基因SNP筛选引物信息
从GenBank中获得猪Dnmt3a和β-actin基因的cDNA序列,利用Primer Premier 5.0软件跨内含子设计这2个基因的定量引物,用于实时荧光定量PCR扩增,引物信息见表2。引物由生工生物工程(北京)股份有限公司合成。
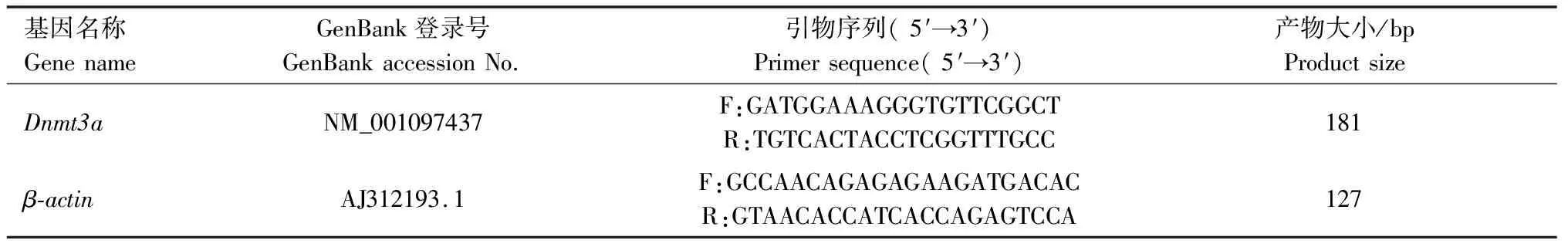
表2 实时荧光定量PCR的引物信息
1.3 组织DNA和RNA提取
1.3.1 DNA提取 用苯酚-氯仿抽提法提取精子(藏猪、大白猪)与耳组织(藏猪、大白猪、滇南小耳猪,打耳标时取样)的基因组DNA。
1.3.2 RNA提取及cDNA合成 采用Trizol一步法提取猪精子及耳组织的总RNA,质检合格后反转录成cDNA,-20 ℃保存备用。
1.4 Dnmt3a基因SNP筛选
1.4.1 PCR扩增 PCR反应体系:模板1 μL,2×TaqPCR Mix 10 μL,正向和反向引物各0.4 μL,加ddH2O至20 μL。PCR的反应条件:95 ℃预变性5 min;95 ℃变性30 s,退火30 s,72 ℃延伸50 s,38个循环;72 ℃延伸 10 min,降温至4 ℃保存。
1.4.2 SNP分析 PCR产物经1%琼脂糖凝胶电泳检测后,每个品种选取扩增效果最优的10个样本,每个样本取5 μL PCR产物,混池后送生工生物工程(北京)股份有限公司测序。测序结果利用软件DNAMAN和Chromas进行峰图比对分析,筛选出SNP位点,然后对藏猪、大白猪、滇南小耳猪这3个猪种各50个个体进行个体测序,以确定个体SNP位点的基因型。
1.5 Dnmt3a基因实时荧光定量PCR
1.5.1 PCR扩增 藏猪、大白猪精子中Dnmt3a和β-actin基因的PCR反应体系同1.4.1。PCR反应条件:95℃ 5 min;然后95 ℃ 20 s,60 ℃ 20 s,72 ℃ 30 s,36个循环;72 ℃延伸7 min, 最后4 ℃结束反应。1%的琼脂糖凝胶电泳检测扩增产物。
1.5.2 标准曲线的制备及实时荧光定量PCR 将反转录得到的所有样本的cDNA分别取出2 μL混合在一起成为荧光定量PCR的校准样,将校准样按5倍梯度进行稀释,共稀释5个梯度(包括原校准样),在伯乐CFX96实时荧光定量PCR仪上运行标准曲线的程序,程序结束后看其标准曲线的斜率和引物扩增效率,若扩增效率PCR在90%~105%,说明引物可用于实时荧光定量PCR。
每个样本的目的基因和内参基因均在同一板扩增,且设目的基因与内参基因的校准样扩增,均设3个重复,以这3个重复Ct值的平均值作为该个体的平均Ct值。反应程序:95 ℃ 15 min,40个循环(95 ℃ 10 s,60 ℃ 30 s,72 ℃ 30 s),然后95 ℃ 10 s,65 ℃至95 ℃每增加0.5 ℃读取荧光1次,绘制熔解曲线。实时荧光定量PCR反应体系同1.4.1。目的基因的表达量采用2-ΔΔCT法计算。
1.6 Dnmt3a蛋白表达水平检测
1.6.1 精子总蛋白质的提取与定量 分别在藏猪、大白猪精子中加入预冷的含抑制剂的蛋白质抽提试剂,匀浆2次,在4 ℃条件下14 000 r/min离心30 min,取上清液,按照BCA蛋白质浓度测定试剂盒(增强型)说明书提供的方法,测定样品总蛋白质的浓度,用于进行后续试验或置于-80 ℃冰箱备用。
1.6.2 Westen blot方法检测Dnmt3a蛋白表达水平 每个样品均取30 μg总蛋白质,变性上样后,进行SDS-PAGE电泳,然后将分离胶转至PVDF膜上,封闭液4 ℃封闭过夜,洗膜后根据Marker标记的位置将膜横向剪开,分别放入各自稀释好(1∶1 000)的一抗(β-actin小鼠单克隆抗体、Dnmt3a兔单克隆抗体)中,于摇床上室温孵育2~4 h,洗膜后放入各自稀释好(1∶1 000)的二抗(辣根过氧化物酶标记山羊抗小鼠IgG(H+L)、辣根过氧化物酶标记山羊抗兔IgG(H+L))中,于摇床上室温孵育2 h,再洗膜后用ECL显影。用Image J图像分析软件对条带进行灰度值计算,蛋白质相对表达量为Dnmt3a与β-actin灰度值的比值。
1.7 数据统计分析
基因表达量和蛋白质表达量数据用SPSS 17.0软件进行单因素方差分析,结果用平均数±标准误表示,差异显著性水平为P<0.05。用Sigma Plot 10.0软件对Dnmt3a基因的mRNA及蛋白质表达水平进行分析。
2 结果与分析
2.1 Dnmt3a基因5′侧翼区与外显子区的SNP筛选
由图1、表3可知,在藏猪Dnmt3a基因的5′侧翼区起始密码子上游2 012 bp处发现1个C→T的突变,且杂合度、多态信息含量均较高,表明群体内变异程度大、能提供的遗传信息较多,但该位点不是藏猪特有的SNP,滇南小耳猪也有。在编码区,藏猪Dnmt3a基因的第11外显子区第1 360 bp处发现1个C→T突变位点,且该位点在大白猪、滇南小耳猪均未突变,但该突变并没有引起氨基酸变化,原来的GCC翻译成丙氨酸,突变后变成GCT,也翻译成丙氨酸,属同义突变,且杂合度、多态信息含量均较低,表明群体内变异程度小、能提供的遗传信息较少。

YP:大白猪;DP:滇南小耳猪;TP:藏猪,下同

表3 Dnmt3a基因SNP的基因型及基因频率
2.2 藏猪精子中Dnmt3a基因mRNA表达水平
在β-actin、Dnmt3a的标准曲线扩增中,其扩增效率在90%~105%,R2值均大于0.99,且没有非特异性扩增,符合试验的质量控制要求。从图2可以看出,Dnmt3a基因在藏猪精子中的mRNA表达水平显著低于大白猪(P<0.05)。
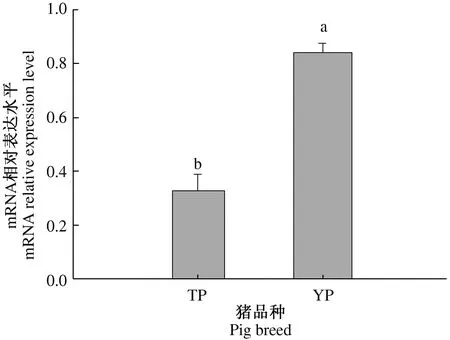
不同小写字母表示差异显著(P<0.05),下同
2.3 藏猪精子中Dnmt3a蛋白表达水平
Dnmt3a蛋白在藏猪、大白猪精子的蛋白质印迹中均有清晰的条带(图3A),藏猪精子中Dnmt3a蛋白的相对表达量显著低于大白猪(P<0.05,图3B)。

A.蛋白质印迹;B.蛋白质表达水平
3 结论与讨论
本研究中,在藏猪Dnmt3a基因的5′侧翼区和外显子区各发现了1个SNP。在5′侧翼区起始密码子上游2 012 bp处,发现C→T的突变,且杂合度、多态信息含量均较高,表明群体内变异程度大,能提供的遗传信息较多。在藏猪Dnmt3a基因的第11外显子区第1 360 bp处也发现了C→T突变位点,且是大白猪和滇南小耳猪所没有的SNP,但突变前后都翻译成丙氨酸,属同义突变,且杂合度、多态信息含量均较低,表明群体内变异程度小,能提供的遗传信息较少。可见,C2 012T位点可以作为藏猪分子育种中的候选标志。
本研究中,Dnmt3a基因在藏猪精子中的mRNA与蛋白水平上的相对表达量均显著低于大白猪,这有助于阐明藏猪精子高原适应性的DNA甲基化机制[12]。Dnmt3a在高畸形率的人精子中mRNA表达水平显著高于正常精子[13],其在小鼠生殖系干细胞中的异常表达会导致精子形成缺陷[14],人源性Dnmt3a在转基因大鼠睾丸中过表达会提高大鼠精子全基因组DNA甲基化水平[15]。藏猪睾丸组织中,Dnmt3a基因mRNA相对表达量显著低于大白猪[9]。本研究中,藏猪精子的Dnmt3a基因mRNA相对表达量也显著低于大白猪,而BAN等[16]认为,Dnmt3a在藏猪肺中的mRNA表达水平显著高于大白猪,造成结果的不同可能与所检测的组织不同有关。在低氧条件下,Dnmt3a介导的DNA甲基化改变会调节成骨分化[17],Dnmt3a过表达可通过p21和PPARg启动子甲基化促进猪肌肉前脂肪细胞增殖并抑制其分化[18],Dnmt3a蛋白在睾丸细胞和生长受阻的成纤维细胞中呈高水平[19],阿霉素能降低Dnmt3a在睾丸中的表达水平[20]。雄性不育的犏牛睾丸组织中Dnmt3a蛋白的相对表达量显著高于牦牛[21],这与本研究结果一致,藏猪精子的Dnmt3a蛋白表达水平显著低于大白猪,有利于藏猪精子品质的提高。
综上,相对于大白猪,藏猪Dnmt3a基因C2 012T位点可以作为藏猪分子育种中的候选标志;藏猪精子中Dnmt3a基因mRNA及蛋白的低表达可能会导致较低的基因组DNA甲基化水平,从而有利于转录,这可能是藏猪精子高原适应性的DNA甲基化机制之一,而如何进一步阐明藏猪精子高原适应性的DNA甲基化机制、开展高繁殖力藏猪的分子育种等研究是今后研究的方向。
