急性旁中心中层黄斑病变的光学相干断层扫描血管成像的影像特征
2020-10-16朱晓红赵玥姚进
朱晓红,赵玥,姚进
(南京医科大学附属眼科医院门诊特检科,南京 210029)
急性旁中心中层黄斑病变(paracentral acute middle maculopathy,PAMM)于2013年由Sarraf等[1-2]首先提出并命名,是对急性黄斑神经视网膜病变(acute macular neurocristopathy,AMN)的再认识[3],患者多主诉为眼前暗影、伴有轻度或不伴有视力下降,可单眼或双眼发病,PAMM常伴发于多种视网膜血管病变,如视网膜血管阻塞性疾病(如视网膜动脉阻塞、视网膜静脉阻塞等)以及系统性视网膜血管疾病(如糖尿病性视网膜病变、镰刀细胞视网膜病变及远达性视网膜病变等)[4-8]。由于PAMM的病变部位在ICP,在眼底的特征表现隐匿,因此既往的常规眼底检查由于无法分层观察,往往无法明确诊断,尤其是病变早期更容易漏诊。OCTA无需造影剂,快捷无创,可以分层显示,调整分层线可直接定位到ICP,通过结构En face图像可观察到其不同于其他影像结果的特殊特征性表现。为此,本研究观察分析了一组PAMM患者的OCTA影像特征,现报告如下。
1 对象与方法
1.1 对象
回顾2016年3月至2020年4月南京医科大学附属眼科医院确诊发生PAMM的患者,将因高度近视、屈光介质浑浊严重及配合不佳导致检查成像不清的病例排除后,共纳入25例患者(26只眼)。其中男15例(16只眼),女10例(10只眼)。病程均在1周之内,年龄45~79(67.0±2.4)岁。患眼均伴不同程度的视力下降,BVCA 0.1~0.6;均无病毒感染、口服避孕药、血压过低、服用血管收缩剂、外伤、急性胰腺炎及其他特殊的全身性疾病。其中16例患者有高血压病史,8例患者有糖尿病病史,1例患者有高血压并糖尿病病史。
1.2 方法
患者均行最佳矫正视力(best corrected visual acuity,BCVA)、眼底彩色照相、频域光学相干断层扫描(spectral-domain optical coherence tomography,SD-OCT)、眼底自发荧光(fundus auto fluorescence,FAF)、OCTA、视野及多焦视网膜电图(multifocal electroretinograms,M-ERG)检查。其中10例无造影禁忌证的患者行FFA及ICGA检查。眼底彩色照相检查采用日本Topcon眼底照相系统;SD-OCT,FAF,FFA及ICGA检查采用德国海德堡共焦激光眼底扫描系统;视野检查采用重庆康华瑞明全自动视野计APS-6000AER系统;M-ERG采用德国Tomey-EP1000视觉电生理仪。
采用美国光视公司AngioVue系统行黄斑区OCTA检查,由同一位医生独立对患眼行黄斑区3 mm×3 mm及6 mm×6 mm范围视网膜血流检查。操作中尽量避免抖动严重、泪膜不稳定等影响图像质量的客观因素,系统自动处理图像后提供视网膜浅层、深层毛细血管层、外层视网膜及脉络膜毛细血管层血流图像以及对应分层面的结构En face图像和B-scan图像,多角度观察PAMM的OCTA影像特征。
2 结果
如图1、图2所示,所有患眼经眼底检查可见PAMM在后极部或视盘周围呈散在的灰白色病灶(图1A,图2A);在FAF中呈低荧光(图1B,图2B);眼底血管造影中表现为原发性视网膜血管性疾病的影像(图1C,图2C);SD-OCT显示黄斑区内核层和外丛状层呈高反射带(图1D,图2D);视野检查示中心、旁中心暗点及视敏度下降(图1E);M-ERG显示黄斑区中心凹及周边振幅密度下降(图1F)。
所有患眼经OCTA检查发现:PAMM病灶区域的浅层及深层毛细血管层毛细血管匮乏,血流密度明显降低(图1G,图1H,图2E,图2F);将分层线调整至ICP,即IPL向上10 μm至IPL向下30 μm(IPL-10至IPL+30),可见结构En face显示为典型的沿静脉走形分布的蕨状形态,对应分层面的B-scan显示INL和OPL之间呈不连续的高反射带(图1I,图2G)。随访模式可见随着病情好转,蕨状高反射的面积逐渐减少,INL萎缩变薄(图3)。

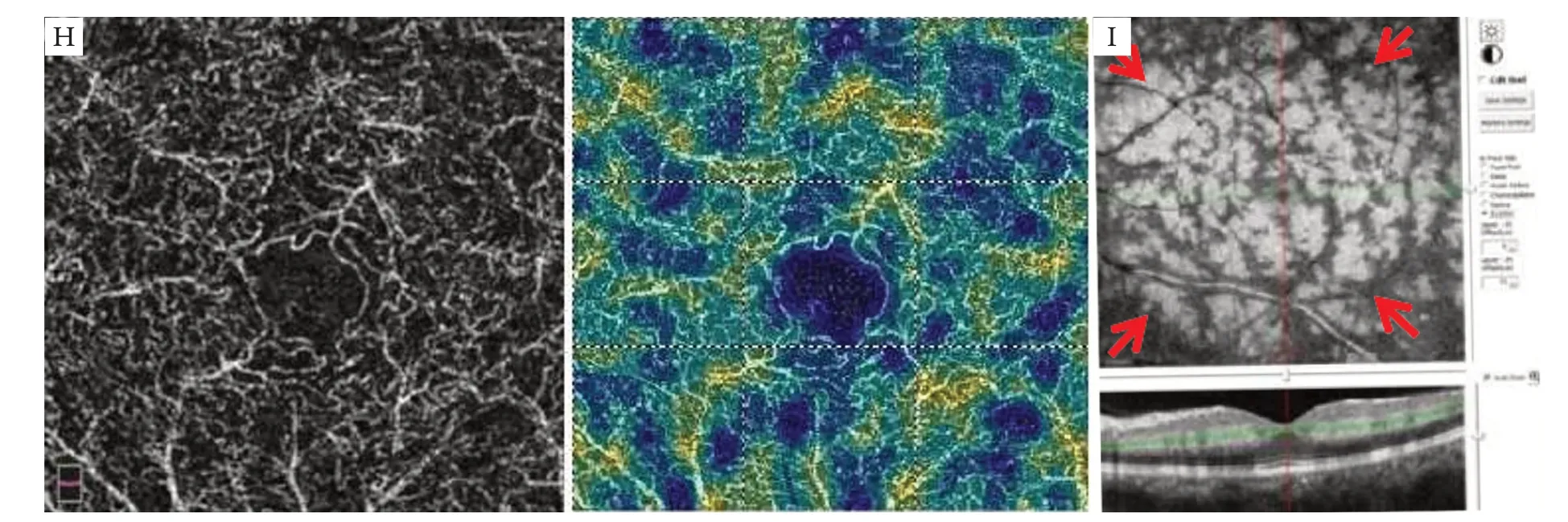
图1 患者,男,50岁,左眼视力下降3 d就诊,糖尿病病史9年,BCVA 0.3Figure 1 A 50-year-old male presented with a 3-day history of vision loss in left eye,who had 9 years of diabetes mellitus and BCVA of 0.3
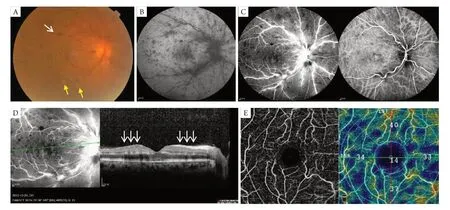

图2 患者,男,61岁,右眼视力下降1周就诊,既往有高血压史,BCVA 0.15,诊断为视网膜中央静脉阻塞合并PAMMFigure 2 A 61-year-old male presented with a 1-week history of vision loss in left eye,who had hypertension and BCVA of 0.15,diagnosed with central retinal vein occlusion with PAMM
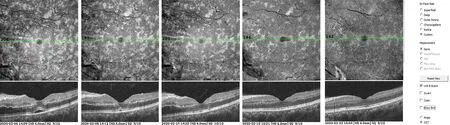
图3 患者,男,44岁,左眼视力下降1 d就诊,既往有颈动脉狭窄病史,BCVA 0.15,经临床诊断为低灌注性视网膜病变合并PAMMFigure 3 A 44-year-old male presented with 1-day history of vision loss in left eye,who had carotid stenosis and BCVA of 0.15,diagnosed with low-perfusion retinopathy with PAMM
3 讨论
Sarraf等[1]按照频域OCT将AMN分为2类,在频域OCT上表现为黄斑区INL和OPL之间高反射条带的是1型,后被独立为PAMM,随着病程进展,INL最终会萎缩变薄;2型病变在外核层(outer nuclera layer,ONL),可同时累及椭圆体带及嵌合带。临床上PAMM分为原发性和继发性。原发性PAMM[2,5]常发生于健康的青年人,病因不明,发病高危因素包括病毒感染、血压过低、口服避孕药或血管收缩剂[4-7]等。继发性PAMM常发生于中老年人,多伴有糖尿病、高血压、镰刀红细胞型贫血等全身血管性疾病[9]。INL的供养来源是中、深层及脉络膜血管层[10],PAMM的发病机制与ICP及DCP缺血密切相关[11-12]。从解剖学上看,ICP与DCP分别位于INL上方及下方,INL/OPL区域又与ICP紧密相连,因此ICP的缺血更易导致PAMM的发生。同时黄斑中心凹旁视网膜较厚,氧气从脉络膜扩散至视网膜不易,因此PAMM的发生很有可能由黄斑区视网膜毛细血管网血供发生异常导致。多数学者[4-5]认为:PAMM不仅仅是一种黄斑区毛细血管性缺血性病变,更是视网膜血管性疾病的一种典型临床表现,是缺血性和非缺血性眼底病变的一种中间状态。
PAMM病变在视网膜中层,常规眼底检查及彩色眼底无法确切显示病变形态。FAF利用特定波长的光,可以勾勒出视网膜深层病变的边界,但无法与原发性视网膜病变的影像改变分隔开。FFA仅能观察到原发性视网膜病变的影像特征,评价其视网膜缺血程度,无法检测ICP或DCP的血流信号。因此上述检查对于诊断PAMM均没有代表性意义[13]。尽管PAMM在频域OCT中有特异性表现,但仅仅能够观察到中层视网膜的高反射带,无法显示视网膜内血管形态。而OCTA能够清晰的分层显示视网膜内毛细血管网的层次及解剖结构,除默认分层下的SCP和DCP外,还能准确锁定到ICP,通过血流图可以观察SCP及DCP的毛细血管分布及血流密度等异常改变,从一定意义上评价其缺血程度。有学者[14]通过OCTA的观察,认为PAMM患眼的视力丢失可能与DCP毛细血管的局灶性缺失存在相关性。当调整分层线至ICP(IPL-10~IPL+30)时,对应的B-san可见IPL和OPL之间呈高反射带,结构En face能够清晰显示病灶区域静脉周围典型的蕨状分布形态,但动脉分支周围并无此表现,这种特殊类型的病变分布特点可能与动静脉周围的氧分压相关。动脉氧分压高,故其周围的视网膜细胞对缺血损伤的耐受性更好,而静脉周围则恰好相反[15]。
本研究结果显示:对于PAMM的诊断OCTA检查具有显著的特征性影像表现。相较于其他传统影像,OCTA具备3个特征优势:1)血流图、血流密度、结构En face以及B-san可以多角度提供不同信息,更加综合全面地了解病变状态;2)能够清晰地分层显示视网膜内毛细血管网,通过调整分层线,可以准确锁定在ICP,结构En face中呈现出的蕨状分布表现是最为典型的特征性影像表现,也是其他检查手段均无法观察到的;3)随访模式可以对同一分层面进行治疗前后的对比,了解疾病变化。
综上所述,OCTA可以帮助临床对PAMM进行明确诊断与鉴别,尤其在分层显示视网膜内毛细血管网解剖结构方面有其他检查无可取代的优势。但在研究过程中,笔者发现OCTA对ICP血流密度的量化功能还没有开放,因此无法具体说明ICP的血流密度变化。其次,OCTA对患者固视要求较高,固视差往往会降低最终扫描质量,影响对视网膜血流状态的判断。此外,由于本研究因样本量较小,还有待于更多样本的积累和分析长期结果,有助于评估这种新的成像工具在PAMM诊断和随访中的确切作用。
