枯草芽孢杆菌对冰鲜罗非鱼肠道菌群的调节及保鲜作用
2020-10-16王芳婷
张 雯 王芳婷,2 倪 莉*
(1 福州大学食品科学技术研究所 福建省食品生物技术创新工程技术研究中心 福州350108 2 福建省新闽科生物科技开发有限公司 福州350108)
我国幅员辽阔,具有丰富的淡水和海水资源,渔业在我国具有重要的地位。据统计,2018年,海洋捕捞和养殖产值分别为2 228 亿元和3 572 亿元,淡水捕捞和养殖产值分别为465 和5 884 亿元[1]。水产品营养丰富,在流通环节容易在内源酶和微生物的作用下发生腐败。水产保鲜是确保水产品品质的关键环节,也是水产行业发展亟待解决和改进的关键环节。目前,水产品保鲜技术主要有物理保鲜、化学保鲜和生物保鲜3种形式[2]。动、植物来源的保鲜剂受原料限制,价格较高,微生物源保鲜剂成为筛选和应用的热点[3]。微生物保鲜剂包括2 方面:利用微生物本身的成膜性、拮抗作用抑制腐败菌的生长;利用微生物的次生代谢物抑菌[4],如蜡样芽胞杆菌、乳杆菌及一些曲霉,有报道用微生态及其代谢活性物质抑菌[5]。一些枯草芽孢杆菌菌株被批准作为益生菌施用在养殖行业[6]。病原菌入侵鱼体的主要途径是鱼鳃、体表和肠道,它通过对黏液的粘附作用定植于宿主表面,从而大量滋生、分解鱼体营养物质,导致鱼体腐败变质。而益生菌作为一种环境友好型的抗生素替代品,主要通过生成抑菌物质,调节机体免疫应答,竞争粘附位点,竞争营养物质等方式起到抑制病原菌、保护宿主的目的[7-9]。本文探讨益生菌是否通过抑制腐败菌对鱼体各部位黏液的粘附作用,进而减少鱼体携带腐败菌的初浓度,抑制腐败菌的滋生,从而延缓鱼体腐败进程。
本课题组前期筛选得到一株具有显著抑制希瓦氏菌、假单胞菌活性的枯草芽孢杆菌[10-11],通过体外试验证明了腐败菌的腐败能力与粘附能力具有正相关性[12]。本文在此基础上,通过在饲料中添加枯草芽孢杆菌,喂养罗非鱼,研究枯草芽孢杆菌是否改变腐败菌对罗非鱼肠道的定植和滋生,并最终影响冰鲜鱼的鲜度。
1 材料与方法
1.1 材料
1.1.1 供试菌株 希瓦氏菌属(Shewanella)MA1-5,MA1-7 和MA1-13,假单胞菌属(Pseudomonas)R3-1,R3-2 和R3-5,枯草芽孢杆菌BS08:由福州大学食品科学技术研究所保藏。
1.1.2 试验材料 130 尾罗非鱼幼鱼,平均体重20~30 g。
1.1.3 试剂与设备
1)主要试剂 ATP 关联物标准品(纯度>98%),上海蓝季科技发展有限公司、上海麦克林生化科技有限公司,其它常规试剂均为分析纯。粪便基因组提取试剂盒(TIANamp Stool DNA Kit),北京天根生化科技有限公司。
2)主要仪器 SW-CJ-IFD 型超净工作台,上海智诚分析仪器制造有限公司;GNP-9080 型恒温培养箱,上海精宏实验设备有限公司;CF16RXⅡ冷冻高速离心机,日本日立公司;L-2000 高效液相色谱仪,安捷伦科技有限公司。
1.2 方法
1.2.1 饲料的制备 取一环枯草芽孢杆菌BS08接种到牛肉膏蛋白胨液体培养基中,37 ℃,200 r/min,培养24 h 后,将种子液以5%的比例接种至发酵培养基,37 ℃,200 r/min 培养48 h,获得发酵菌液。用离心机进行离心,去除培养液,加入生理盐水制成菌悬液。
菌悬液以15%(质量分数)加入阿拉伯胶保护剂,通过喷干燥制成菌粉,以便保藏。枯草芽孢杆菌喷雾干燥工艺的参考最佳参数:进料速度550 mL/h,入口温度150 ℃,出口温度84 ℃,雾化压力0.1 MPa,最终活菌保鲜剂菌含量在5×1010个/g。
将一定含量的菌粉溶于无菌水中,均匀喷洒到普通饲料上,在44 ℃烘箱里干燥24 h,封装于密闭容器中4 ℃下保存,最终添加量为10 g(菌量)/kg(饲料),以不添加枯草芽孢杆菌的饲料为对照组。
1.2.2 罗非鱼的喂养 130 尾20~30 g 罗非幼鱼根据以下4 组饲喂方式养殖。每组约30~35 尾罗非鱼幼鱼,平均分配饲养在2 个约75 L 的箱子中。每箱水温控制在(28±1)℃,每日换二分之一水。按每日1%的体重比例饲喂饲料,正常饲料饲喂7 d 作为适应期,之后根据以下处理组分组喂养7 d。
对照组(CK):正常水体中,普通饲料喂养组。每日按体重的1%饲喂饲料。
枯草芽孢杆菌组(BS):正常水体中,益生菌饲料喂养组。每日按体重的1%饲喂枯草芽孢杆菌饲料。
腐败组(SP):腐败水体中,添加普通饲料喂养组。腐败水体中,添加108个/mL 希瓦氏菌和假单胞菌各5 mL,每日按体重的1%饲喂饲料。
腐败改善组(BS+SP):腐败水体中,添加益生菌饲料喂养组。腐败水体中,添加108个/mL 希瓦氏菌和假单胞菌各5 mL,每日按体重的1%饲喂枯草芽孢杆菌饲料。
1.2.3 样品提取 试验结束后,将全部的鱼进行碎冰急冻,并按组分装,置于4 ℃环境,每日换冰,冰鲜保藏,0~2 d 取样。将罗非鱼洗净,去鳞、去鱼鳍,用无菌水冲洗数次。在无菌环境下将鱼体解剖,取全段鱼肠样品。将鱼体和肠道样品保存在-20 ℃冰箱中用于鲜度测定和肠道微生态检测。
1.2.4 高通量测序 使用粪便基因组DNA 提取试剂盒(QIAamp Stool Mini Kit)提取鱼 肠道DNA。以16SV3-V5 为目标区域进行高通量测序。
本研究选取对照组(CK)、枯草芽孢杆菌组(SB)、腐败菌组(SP)、改善组(SP+SB)4 组在冰鲜保藏第1 天与第2 天的鱼肠道样品,各取2 份平行,共计16 个样品进行粪便基因组的提取,样品信息表见表1,进行Illumina Miseq 双端测序(Pair-end sequencing)。

表1 样品信息表Table 1 Sample information table
1.2.5 TVB-N 测定 参考中华人民共和国食品安全国家标准[13](GB 5009.228-2016)测定挥发性盐基氮。
1.2.6 K 值测定 参考中华人民共和国水产行业标准[14](SC/T3048-2014)测定K 值。
1.2.7 数据分析 结果采用SPSS 22.0 的Duncan检验对数据进行显著性分析。
2 结果与分析
2.1 肠道菌群的多样性变化分析
图1 为不同处理组的分类单元(OTU)韦恩图,由图1可知:1)初始阶段,枯草芽孢杆菌和腐败菌单独添加均使OTU 数量增加,而枯草芽孢杆菌和腐败菌共同作用却显著减少了OUT 数量。2)腐败的过程细菌总量增加,OUT 数量减少,说明菌株出现了优势富集。从富集程度来看,枯草芽孢杆菌和腐败菌的共同作用对菌体多样性影响最小,富集程度最低,贮藏初期检测到的OUT 减少了57%,而其余3 组富集程度均大于64%。
Shannon 指数以及Simpson 指数同时反映群落中物种丰富度和均匀度,ACE 和Chao1 指数体现群落的丰富度。如表2所示,对照组(RS1,RS2)的肠道菌群OUT 数量下降,Chao1 指数下降,Shannon 指数上升,多样性的指标综合反映了肠道菌群的物种丰富度随着时间的推移明显下降,均匀度上升,说明在贮藏过程中出现了菌群优势化趋势,少数菌的丰度上升;枯草芽孢杆菌组(RS3,RS4)的肠道菌群OUT 数量下降,Chao1 指数下降,Shannon 指数基本不变,说明饲喂枯草芽孢杆菌的罗非鱼在储藏过程中肠道菌群丰富度稍下降,但均匀度变化小。同时,枯草芽孢杆菌组罗非鱼样品肠道初始菌群均匀度就处于较高的水平;腐败菌组(RS5,RS6)的肠道菌群OUT 数量下降,Chao1 指数显著下降,Shannon 指数显著下降,第2天与第1 天相比肠道菌群丰富度和均匀度显著下降,说明腐败菌组的菌群在储藏后出现了明显的优势化趋势;改善组(RS7,RS8)肠道菌群的变化和枯草芽孢杆菌组类似,OUT 数量稍有下降,Chao1 指数和Shannon 指数变化不显著。由此可见,枯草芽孢杆菌的加入能够调节鱼肠道菌群处于一个较为均衡稳定的状态。

图1 不同样品OTU 韦恩图Fig.1 Venn profile of OTU in different samples
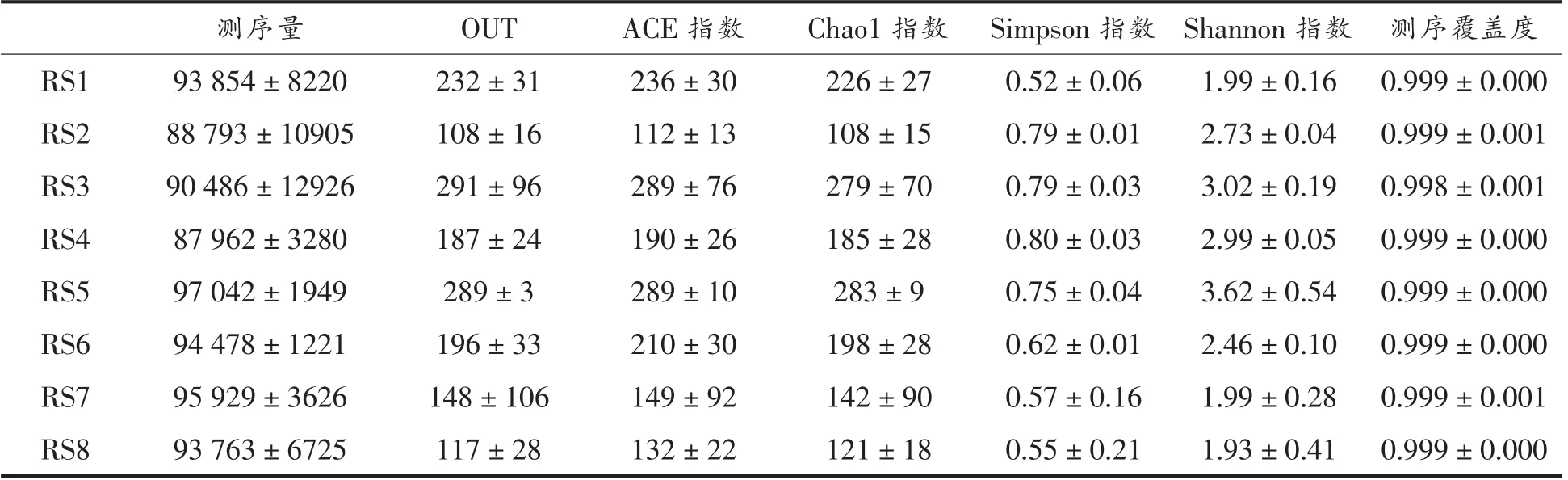
表2 肠道菌群多样性指数比较Table 2 Comparison of intestinal flora diversity index
2.2 多元统计方法的肠道菌群群落结构的比较分析
将4 组饲养条件下的罗非鱼肠道菌群进行主坐标分析(Principal coordinates analysis,PCoA)。根据图2 中散点的分布情况可以看出,菌群总体变化的趋势是二象限至一象限至四象限。冰鲜1 d 后的样品分布较为聚集,各组间罗非鱼肠道菌群群落结构差异较小。随着冰鲜时间至第2 天后,肠道中细菌的滋生导致肠道菌群的群落结构出现较大差异。经过腐败菌处理的腐败菌组和改善组处于第四象限,而枯草芽孢杆菌组处于第一象限,说明饲喂含枯草芽孢杆菌的饲料对罗非鱼的肠道菌群的变化具有阻遏作用,对照组的样品在第2天后分别处于第一和第四象限,说明未额外添加枯草芽孢杆菌的样品菌群个体变化差异或随机性较强,添加枯草芽孢杆菌减少了这些个体变化的差异,维持了菌群结构的稳定性。
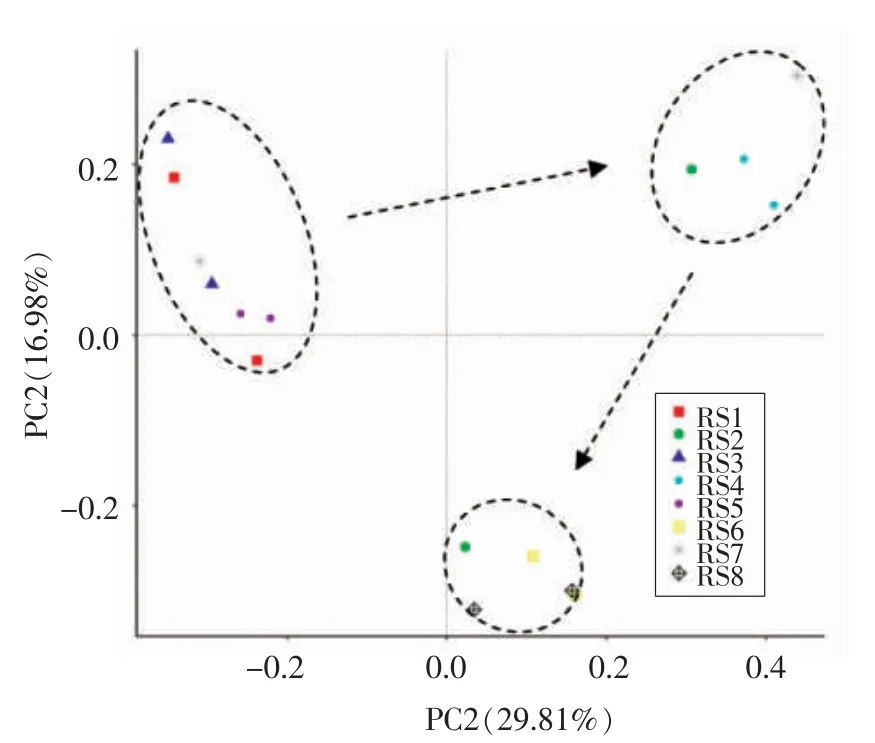
图2 4 组饲养条件下罗非鱼肠道菌群的主坐标分析(PCoA)Fig.2 Principal coordinate analysis(PCoA)of intestinal flora of tilapia in four feeding conditions
2.3 微生物群落结构变化
进一步分析不同处理组的罗非鱼肠道在贮藏过程中发生的菌群结构变化,尤其是希瓦氏菌、假单胞菌以及枯草芽孢杆菌的群落变化规律。
对菌群分布的热图与丰度分析(图3)发现厚壁菌门(Firmicutes),拟杆菌门(Bacteroidetes)和变形菌门(Proteobacteria)是罗非鱼肠道门水平上含量最高的3种优势菌。从属水平看,对照组中,气单胞菌属(Aeromonas)、拟杆菌属(Bacteroides)和希瓦氏菌属(Shewanella)冰鲜贮藏过程中显著生长,其中希瓦氏菌属是常见水产品优势腐败菌,气单胞菌是水产养殖中常见的病原菌之一,通常引发鱼类细菌性肠炎、败血症、疖疮病等,严重可造成死亡[15-16]。腐败菌组中,假单胞菌(Pseudomonas)在冰鲜贮藏期间明显增加,而邻单胞菌(Plesiomonas)、乳酸杆菌(Lactobacillus)、芽孢乳杆菌(Sporolactobacillus)和 丙 酸 杆 菌 属(Propionibacterium)等多种鱼肠道中原生健康菌群的相对含量显著降低。正常情况下,健康鱼类肠道菌群和肠黏膜免疫系统处于一种动态平衡,通过合成营养素、拮抗潜在致病菌等维护宿主的健康生长,腐败菌的加入对罗非鱼的正常肠道菌群造成了一定破坏。不动杆菌属(Acinetobacter)的显著增加也提高了罗非鱼染病的概率,Xia等[17]鉴定鲍氏不动杆菌为斑点叉尾鲶的病原体。假单胞菌和希瓦氏加入水体中对罗非鱼肠道菌群造成了较大的改变,这可能对鱼的生长性能造成不利影响。含枯草芽孢杆菌BS08 饲料的喂养能够恢复肠道菌群的结构与组成,且爱德华氏菌(Edwardsiella)这类致病菌的减少表明枯草芽孢杆菌BS08 对鱼类感染性疾病具有潜在的保护作用[18]。

图3 不同样品菌群属间热图与前10 名菌的丰度Fig.3 Heatmap of different samples and the abundance of the top 10 bacteria at the genus level
进一步分析对比希瓦氏菌、假单胞菌和枯草芽孢杆菌在各处理组中相对含量的变化(图4):冰鲜第1 天,希瓦氏菌相对含量从大到小依次为:SP>SP+SB>CK>SB,说明天然水体中和外源添加的希瓦氏菌均可在肠道很好地粘附,但枯草芽孢杆菌可在一定程度上抑制希瓦氏菌的粘附程度。无论是天然水体还是外源添加的假单胞菌的粘附性都显著低于希瓦氏菌。同时,枯草芽孢杆菌在鱼肠道的定植程度也显著低于希瓦氏菌。
希瓦氏菌在天然水体养殖的罗非鱼冰鲜贮藏期逐渐成为优势菌,但在外源微生物干扰的作用下,在很大程度上被抑制。冰鲜第1 天到第2 天,空白对照组(RS1,2)希瓦氏菌相对含量迅速上升,假单胞菌的比例轻微下降,几乎无枯草芽孢杆菌;枯草芽孢杆菌组(RS3,4)希瓦氏菌显著下降,假单胞菌和枯草芽孢杆菌的比例显著上升;腐败组(RS5,6)希瓦氏菌显著降低,假单胞菌的比例显著上升,枯草芽孢杆菌比例轻微上升;改善组(RS7,8)希瓦氏菌显著降低,假单胞菌的比例轻微上升,枯草芽孢杆菌显著上升。说明,若不添加枯草芽孢杆菌,希瓦氏菌将在肠道中成为优势菌;前期希瓦氏菌在肠道中的定植数量明显高于假单胞菌,在第2 天,肠道中的希瓦氏菌数量显著下降,假单胞菌数量上升,说明假单胞菌能够对希瓦氏菌产生竞争性抑制作用。Gram等[19]发现在鱼体组织中,当假单胞菌数量达到108~109CFU/g 时,会抑制希瓦氏菌的生长,课题组前期研究工作也同样发现,假单胞菌对希瓦氏菌的生长具有拮抗作用[20]。

图4 不同样品中希瓦氏菌、假单胞菌和枯草芽孢杆菌的相对含量Fig.4 Relative abundance of Shewanella,Pseudomonas and Bacillus subtilis in different samples
2.4 添加枯草芽孢杆菌对冰鲜鱼鲜度变化的影响
新鲜鱼类由于其高蛋白和高水分含量,在贮藏期间容易滋生微生物,使鱼体腐败变质。在鱼体品质变化的初期阶段,体内糖原经糖酵解反应被分解成乳酸,pH 下降,激活三磷酸腺苷酶,导致三磷酸腺苷(ATP)在内源酶的作用下降解,主要反应途径为:ATP→ADP→AMP→IMP→HXR→HX[21]。因此,通过检测ATP 降解产物的变化可以判断出鱼的新鲜程度。此外,在微生物代谢分泌的水解酶作用下,蛋白质水解产物和游离氨基酸增加,同时产生氮、三甲胺、硫化物、醇类等挥发性物质,产生不愉快的腐臭味[22-23]。因此,挥发性物质是测定鱼类新鲜度的重要参数。本文以挥发性盐基氮(TVB-N)和K 值作为鲜度变化的指标,探讨枯草芽孢杆菌对延缓罗非鱼腐败变质的作用。
罗非鱼在冷藏过程中挥发性盐基氮TVB-N值变化如图5所示。4 组鱼肉样品TVB-N 值随着冷藏时间均出现不同程度的增长。4 ℃冷藏24 h后,不同处理组之间产TVB-N 的能力具有显著性差异(P<0.05)。发生腐败的程度从高到低依次为SP>CK>SP+SB>SB。加入腐败菌的水体最容易让鱼腐败(腐败组,SP),通过饲喂枯草芽孢杆菌饲料,鱼抗腐败的能力显著提高,无论是在腐败水体中的鱼(改善组,SB+SP)或是正常水体的鱼(对照组,CK),其腐败程度都比未添加枯草芽孢杆菌饲料时(对照组CK 和腐败组SP)显著减缓。4 ℃冷藏48 h 后,腐败组SP 接近腐败的终点(30 mg/100 g),腐败程度从高到低依然为SP>CK>SP+SB>SB。经过枯草芽孢杆菌饲料喂养的鱼腐败过程显著缓慢,其腐败程度与冷藏24 h 时的正常水体组鱼没有显著差异。
一般认为,鱼体的K 值在20%以下为一级鲜度,20%~40%为二级鲜度。40%~60%为三级鲜度,高于60%则腐败。由图6可知,K 值总体上随着贮藏时间的增加呈上升趋势。24 h 时,4种处理方式的鱼鲜度没有显著差异;48 h 后,4 组处理方式的鱼鲜度出现显著差异,正常水体和腐败水体中的鱼鲜度显著变差;添加枯草芽孢杆菌饲料喂养的鱼在贮藏48 h 后,虽然鲜度比24 h 有显著损失,但比未经过枯草芽孢杆菌饲养的鱼鲜度损失有显著的缓解(P<0.05);改善组的K 值上升最为缓慢,说明枯草芽孢杆菌在鱼肠道的成功定植,对腐败菌起到了拮抗作用,在一定程度上能够延缓罗非鱼冰鲜期的腐败变质。

图5 4 个处理组的鱼肉在冰鲜过程中TVB-N 值变化(mg/100 g)Fig.5 Changes of TVB-N value(mg/100 g)of fish from four treatment groups during ice storage
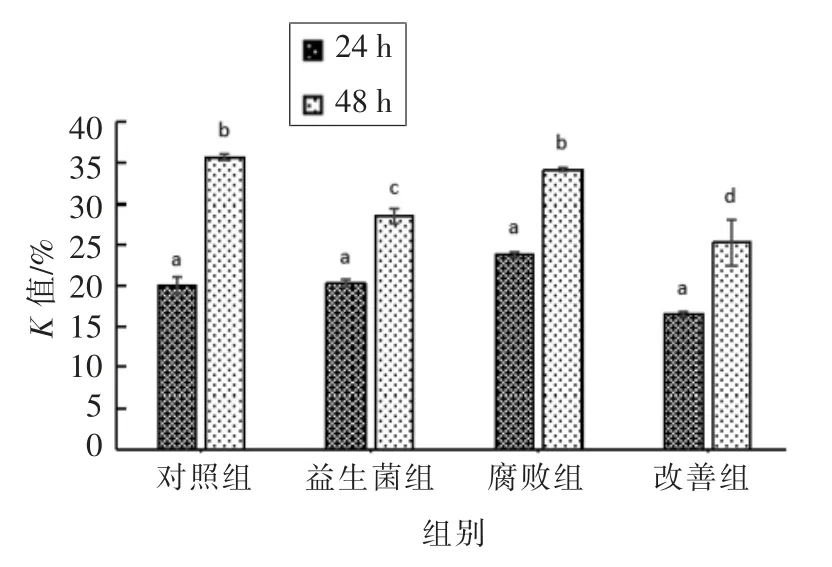
图6 4 组处理鱼肉样品冷藏过程中K 值变化Fig.6 Changes of K value of fish from four treatment groups during ice storage
3 结论
本课题将枯草芽孢杆菌作为饲料添加剂加入鱼饲料中,通过分组喂养来确定枯草芽孢杆菌对罗非鱼肠道菌群的影响。高通量测序结果表明,枯草芽孢杆菌作为益生菌剂喂养能够对罗非鱼肠道菌群起到显著调节作用。与不添加枯草芽孢杆菌的对照组和腐败菌组相比,枯草芽孢杆菌组的罗非鱼肠道菌群多样性维持在一个相对稳定的水平。枯草芽孢杆菌对罗非鱼的肠道菌群的变化具有阻遏作用,延缓冰鲜鱼肠道优势菌群的富集现象。希瓦氏菌在肠道内定植程度大于假单胞菌,试验筛选得到的枯草芽孢杆菌可定植在鱼肠道内,并且可抑制希瓦氏菌在鱼肠道内定植,阻止希瓦氏菌将在肠道中的优势富集。同时,腐败菌的加入对罗非鱼的正常肠道菌群造成了一定程度的破坏,含枯草芽孢杆菌BS08 饲料的喂养能够恢复肠道菌群的结构与组成,并减少某些机会致病菌,表明枯草芽孢杆菌BS08 对鱼类感染性疾病具有潜在的保护作用。
在冰鲜冷藏过程中,通过TVB-N 和K 值为指标判断鱼的鲜度表明,枯草芽孢杆菌的添加显著延缓了冰鲜鱼的腐败程度。
综上所述,本文利用枯草芽孢杆菌对细菌的拮抗特性来研究其在水产养殖和保鲜中的应用。结果说明了枯草芽孢杆菌有望成为改善罗非鱼肠道菌群,并延缓腐败菌定植和滋生的双效益生菌添加剂,为开发新型的微生态保鲜剂提供新思路。
