基于机器学习的大脑白质影像组学标签识别帕金森病早期阶段的应用研究
2020-10-16徐建国宋侨伟沈莹舒震宇
徐建国 宋侨伟 沈莹 舒震宇
帕金森病(Parkinson’s disease,PD)是最常见的运动相关神经退行性疾病[1]。大多数PD患者确诊时已处于疾病中晚期,错过了最佳治疗时期[2-5]。因此,寻找一种快速、准确的方法对PD进行早期诊断显得尤为重要。近年来,影像组学作为一种新的定量成像技术,已被应用于包括PD在内的多种疾病的诊断[6-7]。而机器学习由于能提高分析结果的精确度和可靠性,已成为影像组学的重要组成部分[8]。PD患者大脑白质的微观结构可能在疾病的早期阶段就发生了变化,且结构变化的发生早于生理变化[9],而已有研究表明影像组学分析可以反映白质的微观结构变化[10]。本研究旨在探讨使用机器学习方法构建大脑白质影像组学标签用于PD早期诊断的可行性,以确定PD新的影像学标志物。
1 对象和方法
1.1 研究病例 使用PD进展标记倡议数据库(Parkinson’s progression markers initiative,PPMI)(http://www.PPMI-info.org)[11]基线数据来研究PD的早期阶段。经过性别和年龄匹配,从数据库中选出171例健康对照(healthy control,HC)人群和169例PD患者的影像和临床资料。PD患者均是未进行药物治疗的新患者,大多处于疾病的早期。340例受试者按7∶3随机分为训练组237例和测试组103例。训练组男156例、女81例,年龄(61.6±9.9)岁;测试组男 58例、女 45例,年龄(61.4±10.0)岁;两组性别和年龄比较差异均无统计学意义(均P>0.05)。两组组内PD患者和HC人群性别和年龄比较差异均无统计学意义(均P>0.05),见表1。利用训练集构建影像组学标签,并利用测试集验证标签的可靠性。本研究经浙江省人民医院伦理委员会审查通过。
1.2 白质分割与图像预处理 使用SPM 12软件包(https://cn.mathworks.com/)将所有数据的 T1FLAIR 图像自动分割成大脑灰质、白质和脑脊液。白质由两位经验丰富的神经放射科医生(放射科医生A和放射科医生B)手动修正,使用 ITK-SNAP 软件(http://www.itksnap.org)对临床数据进行盲测。通过以下步骤完成:(1)去除非脑组织、脑干和小脑;(2)修正分割错误的区域。然后将修正的白质区域导入Quantitative Analysis Kit(QK,version 1.2,GE Healthcare)软件进行图像预处理,将图像重新采样到1 mm×1 mm×1 mm体素尺寸,并将图像灰度级标准化为1到32阶段,以消除各向异性对提取特征的影响[12]。

表1 PD患者与HC人群性别和年龄比较
1.3 影像组学特征提取和选择 采用QK软件自带的特征提取软件包对白质图像进行影像组学特征提取[12],包括直方图特征(Histogram)、形状学特征(FormFactor)、灰度共生矩阵特征(gray level co-occurrence matrix,GLCM)、游程矩阵特征(run-length matrix,RLM)和灰度区域大小矩阵特征(gray level size zone matrix features,GLZSM)。使用Spearman秩相关计算两个放射科医生提取特征之间的r值并选取r>0.8的特征作为最稳健的特征[13-14]。另外,本研究采用最小冗余最大相关(the maximum relevance minimum redundancy,mRMR)算法提取训练集中的Robust特征[15]。然后采用传统的套索算法(the least absolute shrinkage and selection operator,LASSO)对筛选出的特征进一步降维。最后,采用梯度增强决策树(gradient boosting decision tree,GBDT)算法进行选择,以构建影像组学标签。
1.4 影像组学标签建立 机器学习包括建立数据衍生的计算标签和方法,以提高标签的准确性、性能或预测能力,这是影像组学的一个重要组成部分[16-17]。本研究使用3种机器学习分类器来构建影像组学标签模型,包括支持向量机、贝叶斯和logistic回归分类器。所有的机器学习使用训练组数据构建的标签模型,测试组数据测试构建的标签模型。同时,对创建的不同的机器学习标签模型计算影像组学评分,以反映PD概率。最后,利用ROC曲线评估不同机器学习构建的影像组学标签的准确性。
1.5 影像组学标签评估 为了确定影像组学标签区分PD患者和HC人群的有效性,用Hosmer-Lemeshow检验分析标签的拟合优度,并使用效验曲线可视化拟合度。此外,为了评价标签的临床疗效,将所有数据集按照ROC曲线的截断值分为高危组和低危组。比较两组PD患者例数,以确定影像组学特征的临床效果。最后,利用ROC曲线和决策曲线(decision curve analysis,DCA)分别评估标签在所有PPMI数据中的准确性和净效益[18]。
1.6 统计学处理 采用SPSS 22.0统计软件和Graph-Pad Prism 6软件包。计量资料以表示,组间比较采用两独立样本t检验。计数资料组间比较采用χ2检验。P<0.05为有差异统计学意义。
2 结果
2.1 影像组学特征选择 每例患者提取378个影像组学特征,通过检测稳健性,保留316个特征。采用mRMR算法选择与PD结果相关性最大的139个特征,然后在139个特征中选择冗余度最小的28个特征,之后使用LASSO算法对选取的28个特征进一步降维获得20个特征,最后,GBDT算法获得最优的4个特征用于构建标签。另外,logstic回归显示了最佳的标签性能,因此,本研究使用logstic回归构建标签,具体公式如下:影像组学评分=0.04579241+0.108305416×GLCMEntropy_angle135_offset1-1.16995003×GreyLevelNonuniformity_angle45_offset7-0.97908198×HaralickCorrelation_angle90_offset1-0.14120719×HighGreyLevelRunEmphasis_AllDirection_offset7_SD。图1显示了3种机器学习技术的预测性能,其中logstic回归构建的标签的AUC值最高,为0.832;支持向量机、贝叶斯构建的标签的AUC值分别为0.822和0.816。根据公式计算影像组学评分,训练组和测试组PD患者和HC人群影像组学评分比较差异均有统计学意义(均P<0.05),见图2。影像组学评分在训练组和测试组中均显示了良好的预测效果,AUC分别为0.849和0.824,灵敏度分别为0.75和0.78,特异度分别为0.87和0.87,见图3。
2.2 影像组学标签性能 效验曲线表明,影像组学标签在训练组和测试组中预测PD概率和实际PD概率具有良好的一致性。Hosmer-Lemeshow检验表明,训练组和测试组的拟合优度比较差异无统计学意义(P>0.05)。此外,ROC曲线评估了所有数据集中影像组学标签的准确性,该曲线显示AUC为0.823。DCA曲线也显示了良好的净效益,这表明标签具有较高的诊断准确性,见图4。根据影像组学标签计算所有患者的PD风险,将所有研究数据按模型的最佳诊断阈值(截断值=0.133 8)分为高危组144例和低危组196例。其中高危组PD患者123例,HC人群21例;低危组PD患者44例,HC人群152例;两组PD患者例数比较差异有统计学意义(P<0.05)。
3 讨论
本研究结果证实与HC人群相比,PD患者早期白质的微观结构发生了改变。此外,基于大脑白质的影像组学标签可以作为一个新的生物学标志物用于PD的早期诊断。

图1 3种机器学习的ROC曲线和决策曲线(DCA)(a:基于训练组数据评估3种机器学习的诊断效能的ROC曲线;b:3种机器学习的净效能的DCA曲线)

图2 训练组和测试组帕金森病(PD)患者和健康对照(HC)人群影像组学评分比较(a:训练组;b:测试组)
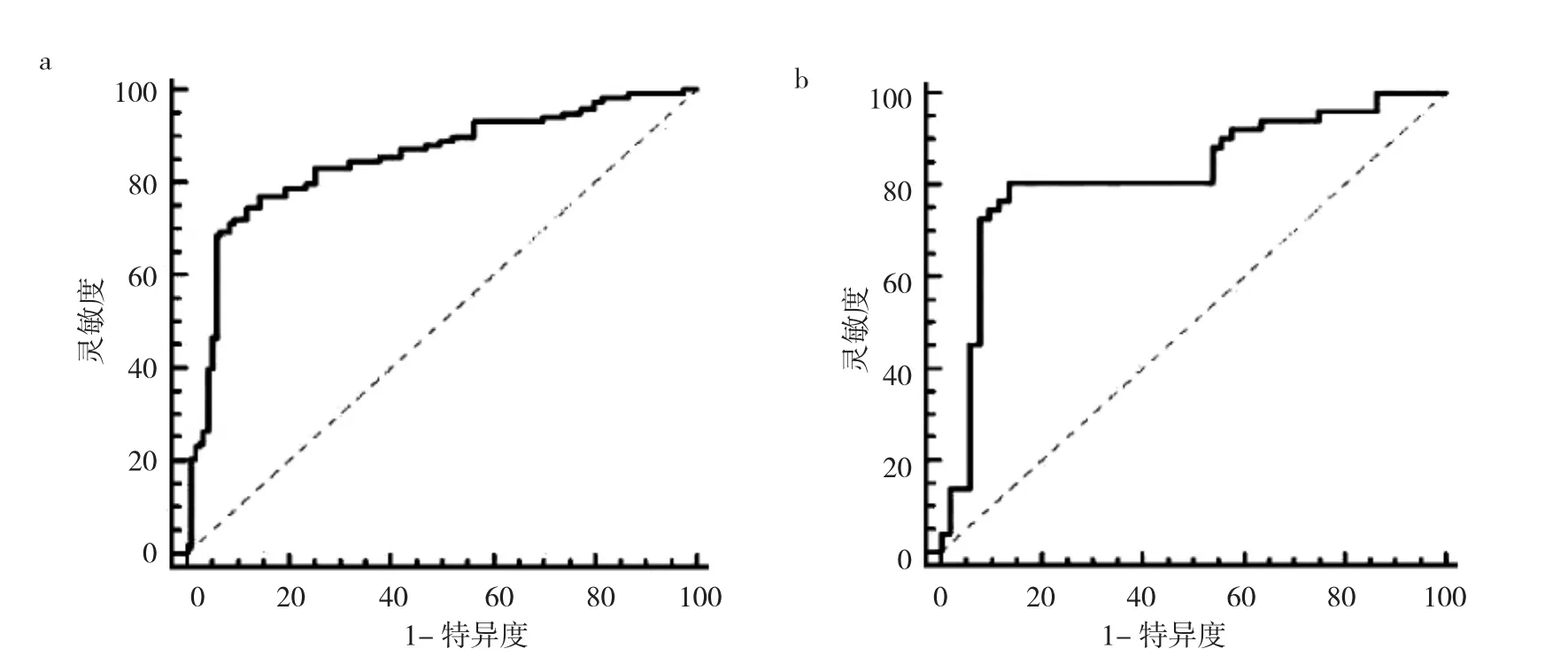
图3 影像组学评分在训练组和测试组中的诊断效能的ROC曲线(a:训练组;b:测试组)
脑MRI通常用于临床评估脑结构解剖和病理,也用于PD的诊断检查[19]。然而,当临床诊断不确定时,常规MRI并不能提高诊断价值,尤其是在PD的早期阶段[20]。虽然T1加权成像(T1WI)显示额叶和颞叶皮质萎缩可能提示与PD痴呆的发生有关[21]。然而,对于常规的临床诊断工作,没有明确的诊断标准前使用传统的MRI序列诊断PD是不可靠的。虽然基于T1WI的体素形态学分析可用于评估PD患者的大脑密度或体积差异从而识别灰质萎缩[22],而灰质萎缩是PD患者的重要表现,但这一现象仅与同时患有痴呆症的PD患者有关[23]。因此,大脑体素形态学分析可能不够灵敏,无法检测出PD患者和HC人群之间不同程度的局部脑改变或脑结构的细微短期变化[24]。但本研究显示基于影像组学分析可以使用T1WI区分PD患者和HC人群,这可能进一步扩大MRI常规序列在PD早期诊断中的应用。虽然T1WI是基于影像组学分析技术,但不可否认的是,T1WI在临床实践中是非常容易获得的。此外,使用白质的影像组学标签来区分PD患者和HC人群显示了良好的性能,这进一步表明白质的变化对PD的高度敏感。这可能是由于白质的改变表现为轴突的退化和髓鞘的损伤,而这通常发生在疾病进展的早期阶段[25]。另一方面,白质并不是PD的主要病理基础,白质特征的差异进一步证明了早期PD患者在脑组织中存在一种补偿机制[26],这一机制有待进一步研究。
Adeli等[27]将MRI和单光子发射计算机断层成像术(SPECT)结合,对PD的诊断准确率高达97.5%,这一结果超过了本研究结果。但是,Adeli等[27]研究的准确性主要依赖于SPECT,MRI数据对诊断能力的贡献很小。而本研究结果完全依赖于MRI数据分析,因此具有很大的优势。另外,本研究中影像组学标签反映了大脑白质的结构改变,而之前的影像组学研究主要是基于黑质的横截面分析[28-29]。Li等[30]利用黑质的影像组学特征,获得了区分早期PD患者和HC人群的AUC值为0.89。Takahashi等[31]也使用黑质的影像组学分析获得AUC为0.86。虽然这些研究结果均高于本研究结果,但单纯黑质可能无法反映PD早期典型的病理变化,大脑改变可能更能代表与疾病相关的整体变化。此外,像黑质这样的神经核团的轮廓在常规序列中是很难观察到的。因此,完善神经核团在常规序列中的显像,规范PD影像标志物识别的研究方案还需要进一步完善。
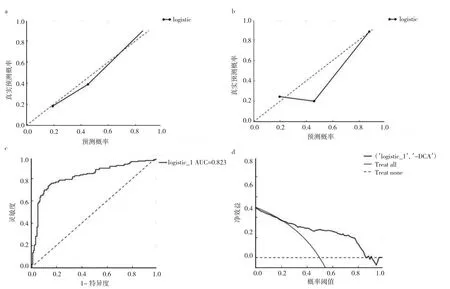
图4 影像组学标签性能(a:影像组学标签在训练组中的效验曲线;b:影像组学标签在测试组中的效验曲线;c:影像组学标签在所有数据中的ROC曲线;d:影像组学标签在所有数据中的决策曲线)
本研究的一个主要优势是用于PD早期诊断的影像组学标签是基于多阶影像组学特征使用机器学习方法构建的,并且在本研究中笔者通过不同机器学习方法构建标签的性能来筛选出最优机器学习方法,总体来说各个机器学习的标签性能结果差异并不大,也进一步说明了机器学习在构建影像组学标签中的稳定性。本研究结果还表明,所构造的标签特征均来自二阶特征,这支持了以前的研究结论,即二阶特征对于PD患者的分类比一阶特征更准确和敏感[30]。在这些二阶特征中也包含了熵,它代表了肿瘤微结构变化引起的异质性。因此,与HC人群相比,PD患者白质的微观结构可能已经被破坏。事实上,这也可以在其他与白质物质相关的游程矩阵(RLM)特征中观察到,这些涉及方向性的特征在某个特定角度具有较长的运行长度[32],这一点很重要,因为健康的白质纤维束是定向和调节的,但是受损的髓鞘会导致正常结构的丢失,使其变厚和模糊。
本研究仍然有一些局限性。首先,需要来自多个研究中心的较大样本量来验证和完善现有的工作;其次,本研究数据集均来自欧美的公用数据库,没有考虑亚洲和欧美的人种差异;最后,本研究没有考虑慢性多巴胺能药物对研究结果可能产生的影响,神经精神病患者在患病期间的药物治疗方案可能会影响大脑结构[33],因此,长期服用药物对患者的潜在影响,应在未来仔细研究和考虑。
综上所述,本研究证明了基于机器学习的大脑白质影像组学标签可以有效地将PD患者和HC人群分开,并可用于早期PD的准确诊断。本研究结果也可能促进影像组学在其他神经系统疾病的进一步研究。
