滋阴熄晕丸提取工艺研究*
2020-10-15李海松
张 玮,李海松
(河南省中研医药科技有限公司,河南 郑州 450004)
滋阴熄晕丸为临床经验方,由熟地黄、酒萸肉、山药、赤芍、茯苓、牡丹皮、泽泻、菊花、天麻、枸杞子、钩藤十一味中药组成,具有滋肾养肝、息晕止眩的功效,可用于肝肾阴虚所致眩晕、头痛、视物昏花、双目干涩、腰膝酸软、失眠多梦、心烦口干等的治疗,拟将其开发成医院制剂投入临床应用。根据方中药物的有效成分理化性质,采取部分药材提取精制,部分药材粉碎后直接入药。方中酒萸肉中含有马钱苷等苷类成分[1-2],赤芍中含有皂苷类成分[3],具有较好的水溶性,可采用加水煎煮提取。据报道,山茱萸中马钱苷等环烯醚萜苷类成分[4-5]具有抑制神经退行性病变(抑制Ca2+失衡、抗氧化应激的损伤、神经保护作用、抑制细胞凋亡、抗炎)、抗血栓等作用[6],芍药苷具有抗炎、镇痛、抗肿瘤、保肝、保护神经、调节免疫、镇静催眠等多种药理作用[7]。《中国药典》2015版一部山茱萸和赤芍药材分别测定了马钱苷和芍药苷的含量,在实验中采用正交实验法,选取酒萸肉中的马钱苷、赤芍中的芍药苷作为评价指标,优选提取工艺。
1 药品、试剂与仪器
滋阴熄晕丸处方组成:熟地黄、酒萸肉、山药、赤芍、茯苓、牡丹皮、泽泻、菊花、天麻、枸杞子、钩藤。药材由亳州市康博中药饮片有限公司提供,经河南省中医药研究院中药所马开副研究员鉴定为正品。马钱苷对照品(批号111640-201303)、芍药苷(批号110754-201621),均购自中国食品药品检定研究院。色谱用甲醇、乙腈,德国Merck公司产品;水为重蒸水;其他试剂为分析纯。Waters高效液相色谱仪,配有2695分离单元、2996二极管阵列检测器和Empower Ⅱ色谱工作站软件,美国Waters公司产品;LIBROR-160DPT万分之一分析天平,日本岛津公司产品;AE240十万分之一分析天平,瑞士METTLER公司产品;GT-350W超声波提取器,济宁科技超声电子有限公司产品;DLSB低温冷却循环泵,郑州凯鹏实验仪器有限公司产品;SHZ-D(Ⅲ)循环水式真空泵, 巩义市英峪仪器厂产品;恒温水浴锅,北京中兴伟业仪器有限公司产品。
2 方法和结果
2.1 正交试验设计
采用正交试验法,对煎煮的主要影响因素和水平进行筛选,以煎煮次数 (A)、 煎煮时间(B)和加水量(C)为考察因素,确定的因素水平表见表1。
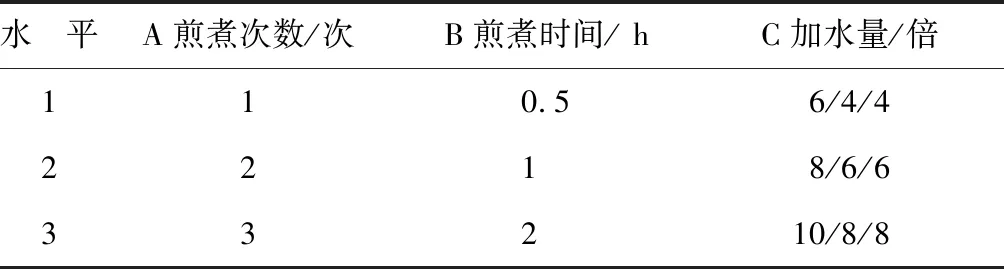
表1 因素水平表
按处方比例平行称取熟地黄、酒萸肉、泽泻、枸杞子、赤芍和茯苓,共9份,按表1设定的因素水平表中参数进行实验,将提取液滤过浓缩后,定容至100 mL,摇匀,作为正交试验样品溶液。
2.2 马钱苷的测定
参考《中国药典》2010版一部山茱萸药材项下有关含量测定方法[8-10],采用高效液相色谱(HPLC)法对正交试验样品溶液中马钱苷的含量进行测定。
2.2.1 色谱条件
色谱条件:色谱柱为Aligent Zobax C18柱(4.6 mm × 250 mm,5 μm ),流动相为乙腈-体积分数3 mL /L磷酸溶液(12 ∶ 88),体积流量1 mL/min,柱温35 ℃,检测波长240 nm。
2.2.2 溶液的制备
对照品溶液:精密称取马钱苷对照品1.30 mg,置于25 mL量瓶中,加甲醇溶解并稀释至刻度,摇匀,即为质量分数为0.052 g/L的马钱苷对照品溶液。
供试品溶液:取2.1项下正交试验1~9号样品溶液各2 mL,分别置25 mL量瓶中,缓缓滴加乙醇,振摇后定容至刻度,静置过夜,滤过,取续滤液即得。
2.2.3 测定方法
分别精密吸取对照品溶液2,5,10,20,25 μL,正交试验供试品溶液各10 μL注入液相色谱仪进行测定。
2.2.4 结 果
波长的选择:按上述色谱条件分别进样马钱苷对照品溶液10 μL和正交试验供试品溶液10 μL,对色谱中马钱苷色谱峰在210~400 nm 进行光谱扫描,结果在238~239 nm处有强吸收,且供试品和对照品色谱中马钱苷峰的紫外吸收光谱基本一致。参照《中国药典》2015版一部山茱萸[11]27项下含量测定,将测定波长选择为240 nm。
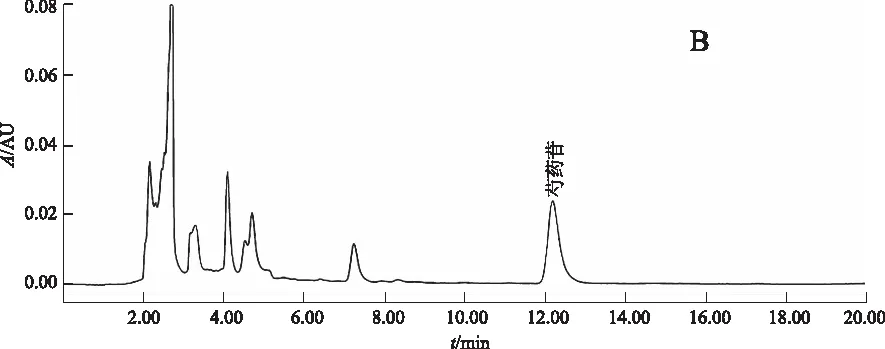
阴性对照试验:按比例称取除酒萸肉外的其他药物,加水浸泡后煎煮3次,每次1 h,合并煎液,浓缩至100 mL,作为缺酒萸肉阴性对照药。按2.2.2项下方法制备缺酒萸肉阴性供试品溶液,精密吸取对照品溶液10 μL、正交试验供试品溶液3 μL和缺酒萸肉阴性供试品溶液3~5 μL,按2.2.1项下色谱条件分析,结果:供试品溶液在与马钱苷对照品色谱相对应的保留时间有相对应的色谱峰,而缺酒萸肉阴性对照品色谱则在相对应的保留时间无吸收峰检出。结果提示:处方中除酒萸肉外的其他药物对测定无干扰。见图1。
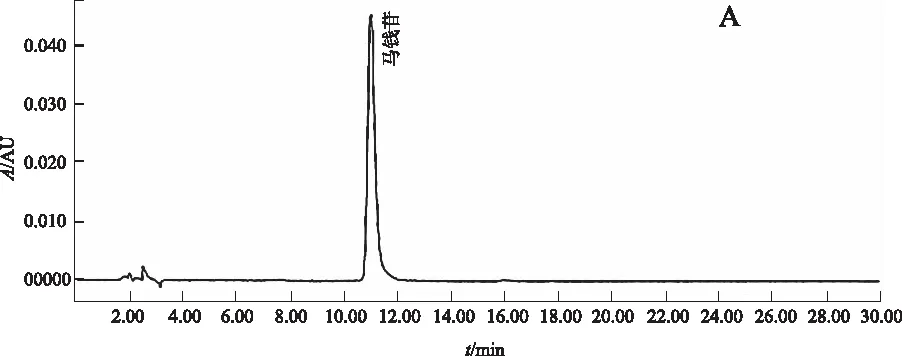

A.对照品;B.正交试验供试品; C. 缺酒萸肉阴性对照品 图1 马钱苷测定的HPLC色谱图
线性关系考察:马钱苷对照品溶液进样2,5,10,20,25 μL,以进样量为横坐标(X),峰面积为纵坐标(Y),绘制的标准曲线为:Y=1.70×106X-1.74×104,r=0.999 9。结果表明:马钱苷在0.104~1.300 μg范围内,进样量与峰面积呈较好的线性关系。
精密度试验:取同一份正交试验样品的供试品溶液10 μL,按2.2.1项下色谱条件,连续进样6次,测定马钱苷吸收峰的峰面积积分值。 结果RSD为0.83%,表明本法精密度较好。
重复性试验:取同一正交试验样品,按2.2.2项下方法制备6份供试品溶液,精密吸取10 μL,按2.2.1项下色谱条件测定马钱苷吸收峰的峰面积积分值,计算供试品中马钱苷的浓度。 结果RSD为0.79%,表明本法重复性较好。
稳定性试验:取同一正交试验样品的供试品溶液10 μL,于制备完成分别放置0,1,2,4,6 h,按2.2.1项下色谱条件,进样测定马钱苷吸收峰的峰面积积分值。 结果RSD为0.89%,表明供试品溶液放置6 h基本稳定。
加样回收率试验:精密吸取已知马钱苷质量分数为0.615 g/L的正交试验样品6份,每份1 mL,置25 mL量瓶中,精密加入用乙醇配制的质量分数为0.650 g/L的马钱苷对照品溶液1 mL,以下按2.2.2项下方法操作制备加样回收供试品。按2.2.1项下色谱条件进行测定,计算供试品溶液中马钱苷的总量和马钱苷的加样回收率。结果:马钱苷的平均加样回收率为96.28%,RSD=1.53%,n=6。
2.3 芍药苷的测定
参照《中国药典》2015版一部赤芍[11]158项下有关含量测定方法,采用HPLC法对正交试验样品溶液中芍药苷的含量进行测定。
2.3.1 色谱条件
色谱条件:色谱柱为Aligent Zobax C18柱(4.6 mm ×250 mm,5 μm );流动相为乙腈-水(14 ∶ 86),体积流量1 mL/min,柱温35 ℃,检测波长230 nm。
2.3.2 溶液的制备
对照品溶液:精密称取芍药苷对照品5.25 mg,置100 mL量瓶中,加甲醇溶解并稀释至刻度,摇匀,得到质量分数为0.052 5 g/L的芍药苷对照品溶液。
供试品溶液:同2.2.2项下供试品溶液的制备。
2.3.3 测定方法
分别精密吸取对照品溶液2,5,10,15,20,25 μL,正交试验供试品溶液各3 μL注入高效液相色谱仪进行测定。
2.3.4 结 果
测定波长的选择:按上述2.3.1项下色谱条件分别进样芍药苷对照品溶液10 μL和正交试验供试品溶液3 μL,对色谱中芍药苷色谱峰在210~400 nm 进行光谱扫描,结果均在231~232 nm处有强吸收。参照《中国药典》2015版赤芍项下含量测定,将测定波长选择为230 nm。
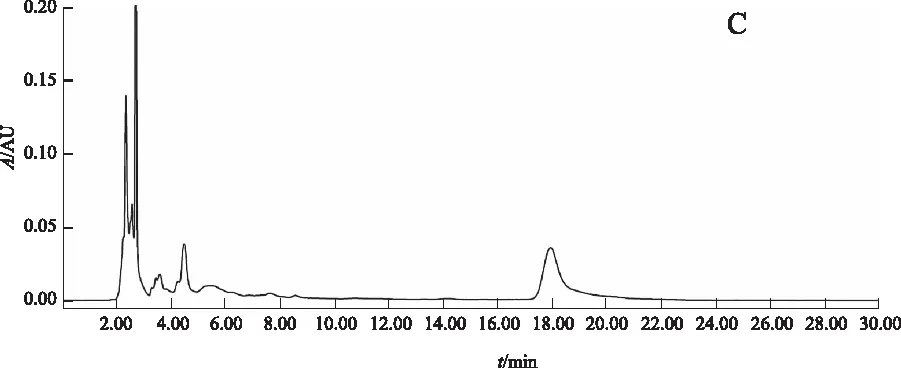
阴性对照试验:按比例称取除赤芍外的其他药物,加水浸泡后煎煮3次,每次1 h,合并煎液,浓缩至100 mL,作为缺赤芍阴性对照药。按2.2.2项下方法制备缺赤芍阴性供试品溶液。精密吸取对照品溶液10 μL、正交试验供试品溶液3 μL和缺赤芍阴性供试品溶液3~5 μL,按2.3.1项下色谱条件进行分析。结果:供试品溶液在与芍药苷对照品色谱相对应的保留时间有相对应的色谱峰,而缺赤芍阴性对照品色谱则在相对应的保留时间无吸收峰检出。结果表明:处方中除赤芍外的其他药物对测定无干扰。见图2。
线性关系考察:芍药苷对照品溶液进样2,5,10,15,20,25 μL,以进样量为横坐标(X),峰面积为纵坐标(Y),得到标准曲线为Y=1.70×106X-2.69×103,r=0.999 1。结果表明:芍药苷在0.105 0~1.312 5 μg范围内,进样量与峰面积呈较好的线性关系。
精密度试验:取同一份正交试验样品的供试品溶液3 μL,按2.3.1项下色谱条件,连续进样7次,测定芍药苷吸收峰的峰面积积分值。结果RSD为2.07%,表明本法精密度较好。

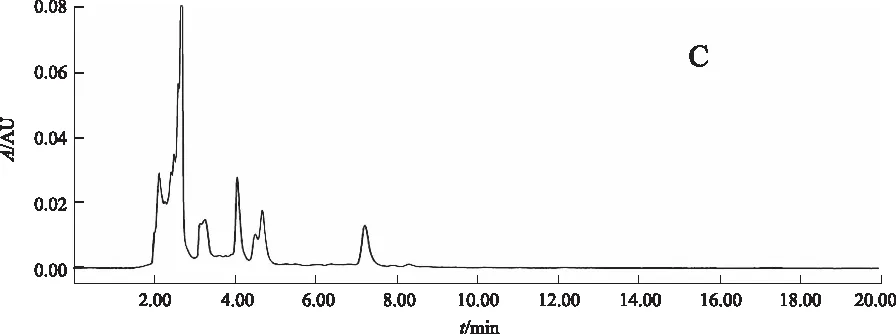
A.对照品;B.正交试验供试品; C.缺赤芍阴性对照品 图2 芍药苷测定的HPLC色谱图
重复性试验:取同一正交试验样品,按2.3.2项下方法制备6份供试品溶液,精密吸取3 μL,按2.3.1项下色谱条件测定芍药苷吸收峰的峰面积积分值,计算供试品中芍药苷的浓度。结果RSD为1.44%,表明本法重复性较好。
稳定性试验:取同一份正交试验样品的供试品溶液3 μL,分别放置0,1,2,4,6 h,按2.3.1项下色谱条件进样,测定芍药苷吸收峰的峰面积积分值。结果RSD为1.51%,表明供试品溶液放置6 h基本稳定。
加样回收率试验:精密吸取已知芍药苷质量分数为1.208 5 g/L的正交试验样品6份,每份1 mL,置于25 mL量瓶中,精密加入用乙醇配制的质量分数为1.782 g/L的芍药苷对照品溶液1 mL,以下按2.3.2项下方法操作制备加样回收供试品。按2.3.1项下色谱条件进行3 μL测定,计算供试品溶液中芍药苷的总量和芍药苷的加样回收率。计算出的平均回收率为98.74%,RSD=1.18%,n=6。
正交试验结果:1~9号供试品溶液进样10 μL,按上述2.2和2.3项下色谱条件和供试品溶液制备方法,分别测定正交试验供试品溶液中马钱苷和芍药苷的峰面积和浓度,计算正交试验样品供试品溶液中马钱苷和芍药苷的总量,结果见表2。
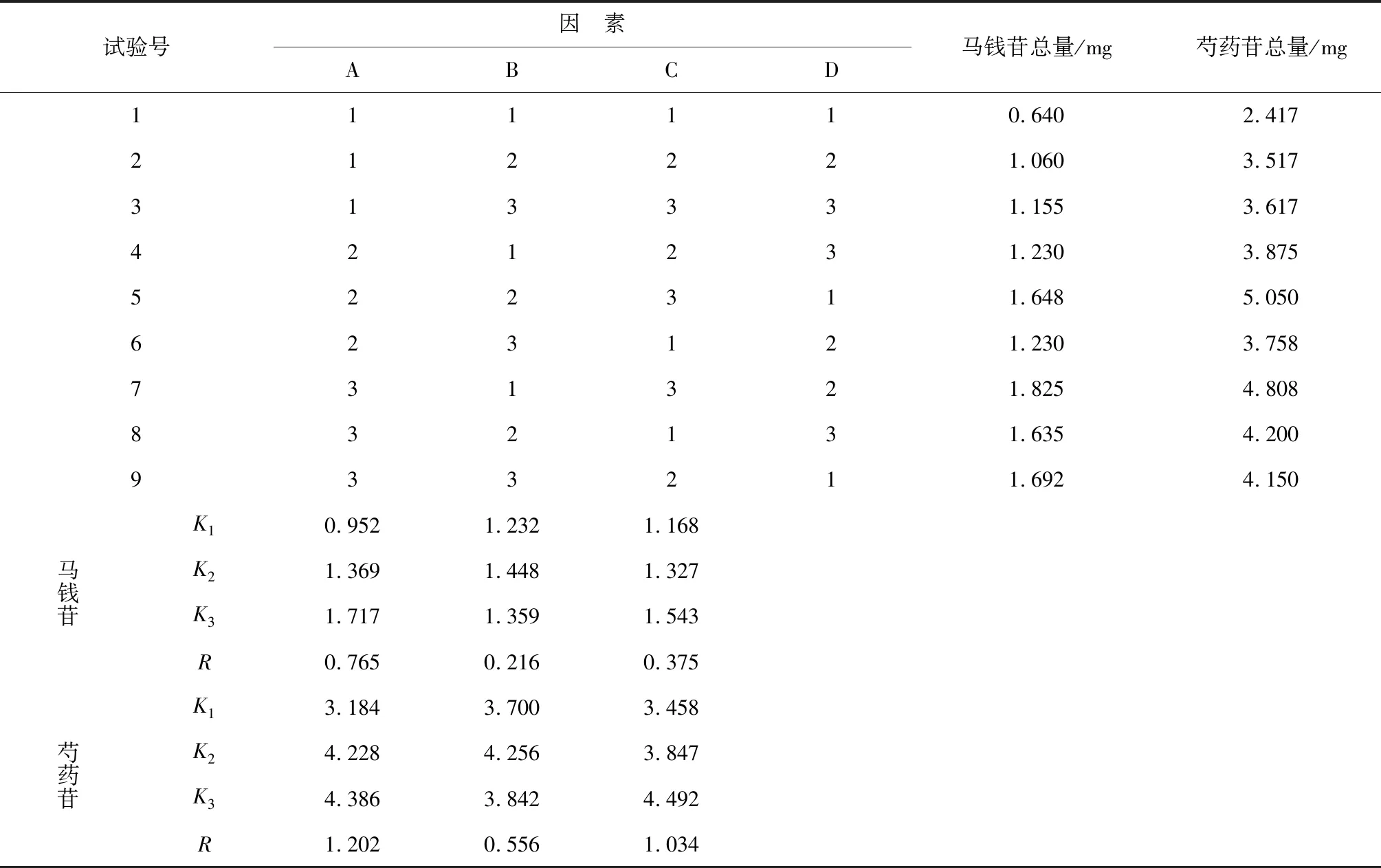
表2 正交试验结果
以空白列D列作为误差列,用SPSS统计软件对A、B、C列进行方差分析和显著性检验,各因素统计处理分析结果见表3。

表3 马钱苷正交试验数理统计分析结果
对马钱苷和芍药苷各因素的不同水平测定结果进行两两比较,结果:以马钱苷为指标,因素A的一水平与二、三水平间有显著性差异,二、三水平间有显著性差异。以芍药苷为指标,因素A的一水平与二、三水平间有显著性差异,二、三水平间无显著性差异。
分别以马钱苷和芍药苷为指标,因素B的一水平与二水平间有显著性差异,一水平与三水平之间、二水平与三水平间均无显著性差异。
以马钱苷为指标,因素C的一、二、三水平间均有显著性差异。
以芍药苷为指标,因素A的一水平与三水平间,二水平与三水平间有显著性差异,一水平与二水平间无显著性差异。
2.4 实验结果的综合分析
综合上述2.2和2.3项下实验结果,以马钱苷为指标优选出的最佳工艺条件为A3B2C3,以芍药苷为指标优选出的最佳的工艺条件均为A3B2C3,两者一致,即熟地黄、酒萸肉、泽泻、枸杞子、赤芍和茯苓的最佳工艺条件是:药材加水浸泡2 h后煎煮3次,每次1 h,加水量分别为10倍、8倍和8倍。
2.5 正交试验结果验证
按2.4优选出的最佳煎煮工艺条件,称取2份熟地黄20 g、酒萸肉10 g、泽泻10 g、枸杞子10 g、赤芍10 g和茯苓10 g,加水浸泡2 h,煎煮3次,每次1 h,加水量分别为10倍、8倍和8倍,合并煎液,滤过,浓缩滤液至100 mL,得到工艺验证用样品溶液。精密吸取该溶液2 mL,分别置25 mL量瓶中,缓缓滴加乙醇,振摇后定容至刻度,静置过夜,滤过,取续滤液,得到工艺验证用供试品溶液。按上述正交试验测定方法,分别测定供试品溶液中马钱苷和芍药苷的含量,计算供试品溶液中马钱苷和芍药苷的总量。结果见表4。结果表明,按优选出的最佳煎煮条件制备的供试品溶液中马钱苷和芍药苷的测得量接近或超过了正交试验的最佳结果,较为理想。

表4 工艺验证结果
3 小 结
本研究采用正交试验设计,采用HPLC法测定正交试验样品中马钱苷和芍药苷的含量,经统计学处理,综合分析,筛选出了滋阴熄晕丸的最佳制备工艺。经工艺验证,本研究所制定的制备工艺适合工业化生产,工艺稳定性较好。
