鱼肉中兽药残留的UPLC-MS/MS同时检测方法
2020-10-15陈祥贵马志强魏雪林
陈祥贵,王 玮,马志强,钟 艳,魏雪林,刘 雪,杨 潇
(西华大学食品与生物工程学院,四川 成都 610039)
我国是渔业大国,消费者历来有食鲜鱼的习惯,相当部分消费者喜食淡水鱼。由于市场需求大,淡水鱼的养殖规模也不断扩大,我国逐渐成为全球唯一一个水产养殖量超过捕捞量的国家。但随着渔业的发展,渔药滥用的问题也越来越严重。鱼类中抗生素残留问题日渐威胁着人们的健康[1]。现有的动物及动物性产品中多种兽药残留的检测方法几乎都存在检测效率低、覆盖范围小、耗时长、干扰物质多等亟需攻克的问题[2],因此需要进一步发展具备同时检测多种兽药残留的定量分析方法。而常用的液相色谱法受限于色谱分离效率已不能满足这一要求,随着液相质谱的不断普及使得基于质谱的多目标化合物同时分析方法越来越受到研究者的重视。
此外我国农业部235号公告[3]以及GB31650—2019都制定了动物性食品中兽药最高残留限量标准,但没有就动物性食品中残留物测定方法制定统一的评价标准。而欧盟颁布的2002/657/EC法令更完整、统一地表述和解释了有关分析方法及结果的说明,并对基于质谱的检测方法有了更明确的要求[4]。因此利用该法令对建立的分析方法进行方法学评价,也有利于提高我国兽药残留检测方法与结果在外贸中的认可度。
本文采用ESI离子源及多反应监控模式建立了鱼肉样品中氟苯尼考、氟苯尼考胺、盐酸土霉素、磺胺甲恶唑的UPLC-MS/MS同时检测方法,并依据2002/657/EC进行了方法学评价。同时利用该方法对市售鱼肉样品中兽药残留进行了检测。
1 材料与方法
1.1 材料
88个鱼肉样品(鲫鱼、草鱼各44个),购自成都市新都区不同乡镇市场。氟苯尼考(FF,98%,分子量:358.2)、氟苯尼考胺(FFA,99.8%,分子量:375.2)、盐酸土霉素(OTC,97%,分子量:496.9)、磺胺甲恶唑(SMZ,98%,分子量:253.3)、氘代氯霉素(CAP-d5,100 ng/μL),购自酷尔化学科技(北京)有限公司。乙腈、甲酸(均为色谱纯)、氨水、乙酸乙酯、正己烷(均为分析纯),购自成都市科隆化学品有限公司。
H-Class超高效液相色谱仪,购自美国Waters公司;3 500三重四级杆质谱系统,购自美国ABSCIEX公司。
1.2 方法
1.2.1 测试条件
1.2.1.1 色谱条件
色谱柱为Waters XTerra C18 UPLC柱(100 mm×2.1 mm,1.8 μm);柱温20 ℃,进样量为3 μL,使用含有0.1%甲酸的(A)乙腈和(B)水为流动相,通过梯度洗脱进行分离,流动相洗脱梯度条件如表1所示 。

表1 梯度洗脱程序
1.2.1.2 质谱条件
在ABSCIEX 3 500三重四极杆质谱仪(带Turbo V源和气帘气接口)上进行检测,使用ESI离子源,质谱检测参数见表2。出于同时检测多种抗生素含量的目的,样本采用多反应监测(MRM)模式进行分析,MRM参数见表3。
1.2.2 溶液的配制
使用乙腈将FF配制成1 mg/mL的母液,然后再用乙腈稀释成20、50、100、200、400、800 ng/mL的标准溶液;同理将FFA用乙腈配制成1 μg/mL的母液,再稀释成1、5、10、20、50、100 ng/mL的标准溶液,并将内标CAP-d5用乙腈配制成100 ng/μL的母液,再稀释到1 ng/μL待用。所有母液置于4 ℃冰箱冷藏,标品使用前用0.22 μm有机滤膜过滤。

表2 质谱检测参数

表3 MRM参数
1.2.3 样品前处理
取鱼肉切碎,用高速匀浆机打成肉糜,真空包装后在-80 ℃下储存。处理样品前,将冻存样品于室温下解冻至室温。精密称取4.000 g 样品置于50 mL离心管中,加入100 μL内标液(250 ng/mL的D5-氯霉素)、5 g无水硫酸钠(视样品含水来定)、15 mL 乙酸乙酯、0.3 mL氨水;涡旋混匀1 min,2 500×g离心5 min,上清液转移至100 mL梨形瓶。再次加入15 mL 乙酸乙酯、0.3 mL 氨水,涡旋混匀1 min,2 500×g离心5 min;上清液合并至100 mL梨形瓶;45 ℃真空旋干,加入2.00 mL 水,涡旋或超声1 min助溶,加入5 mL正己烷涡旋30 s,分层后弃去上层正己烷,再加入5 mL正己烷重复操作1次,水层经0.22 μm水系滤膜过滤后,置于样品瓶内待测[5]。
1.2.4 鱼肉样品中抗生素的定量分析计算
氟苯尼考、氟苯尼考胺、土霉素、磺胺甲恶唑采用同位素内标法进行定量检测,分别以4种抗生素标品的定量离子峰面积与内标物定量离子峰面积的比值为Y坐标,以4种抗生素质量浓度为X坐标作标准曲线,经过计算得到回归方程。将检测结果通过标准曲线换算为浓度,并按下式计算样品中4种抗生素残留的含量:

式中:CA为鱼肉样品中抗生素的含量,μg/kg;MA为样品提取液中抗生素的质量浓度,ng/mL;2为样品提取中加入2.00 mL水定容;Ms为取样量,g。
1.2.5 方法学评价
根据2002/657/EC欧盟标准,分别从线性范围、选择性和基质效应、检出限和定量限、CCα、CCβ、准确度、精密度7个方面进行方法学评价[4]。
1.2.5.1 线性范围
根据4种抗生素标准系列溶液所得数据,进行回归方程的线性拟合,并通过相关性系数R评价4种抗生素在标准系列溶液浓度范围内的线性。
1.2.5.2 选择性与基质效应
选择性是指1种方法可对多种成分产生不同响应[6],主要成分响应可与其他成分区分。2002/657/EC对方法选择性做出的要求是,检测到的离子的相对丰度比,应当与标品中的离子相对丰度一致,且基峰与次强碎片离子应满足相应的丰度比要求。基质指的是样品中除分析物以外的组分,由于基质常常对分析物的分析过程有显著的干扰,并影响分析结果的准确性;因此,这些影响和干扰被称为基质效应(matrix effect)。以下公式用于估计百分比基质效应(ME/%):
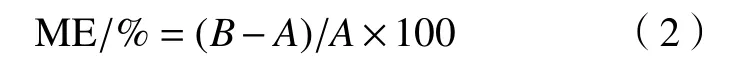
式中:A为溶剂标样的平均峰面积;B为基质标样的平均峰面积;正值表示信号增强,负值表示信号抑制。每个加标水平(50、100、150 μg/kg)进行6次重复(n=6)。
1.2.5.3 检出限(LOD)、定量限(LOQ)
通过在空白鱼肉中添加目标化合物的方法,每种抗生素做6个平行,测基准线噪音值,通过计算检测限(LOD,3倍信噪比)和定量限(LOQ,10倍信噪比)对该方法的灵敏度进行评价。
1.2.5.4 决定限度(CCα)和检出容量(CCβ)
CCα指等于或高于此值时,可以用α误差概率得出认为样品不符合规定的结论的限度[4]。CCβ指可以用β误差概率检测、鉴别或定量样品中物质的最小含量。对于FF、FFA、OTC、SMZ,这些抗生素在鱼肉中的允许限度已经建立。此时α=5%,通过分析空白基质中添加了允许限度的抗生素的样品,以允许限度时的浓度加上相应标准差的1.64倍来计算,用于分析的重复数应大于20。
CCα和CCβ的计算方法[7]如下:

式中:SD为重现性标准差;MRL 为最大残留限量。
1.2.5.5 准确度和回收率
回收率的测定方法:选择18等份空白样品,分别以0.5、1、1.5倍MRL添加到6等份样品;测定并计算回收率和CV。
计算公式如下:

式中:Recovery/%为加标回收率;X2为加标试样测定值;X1为试样测定值;XADD为加标量。
1.2.5.6 精密度
精密度是通过相对标准偏差(relative standard deviation,RSD)的比值来评估的。日内精密度通过1 d内测定3个加标水平下的6个平行样品得到,日间精密度是用不同的标准曲线(每天现配)及同一台仪器,由连续3 d (每天测定1次) 测定3个加标水平下的样品得到。
通过在3个验证天内使用6次重复测定添加样品中4种分析物的回收率来评估准确度和精密度。根据2002/657/EC,FF、FFA、OTC和SMZ的峰值水平分别为0.5×MRLs、1×MRLs和1.5×MRLs。
计算公式如下[8]:

式中:CV为变异系数;C为样品添加浓度,μg/kg。
2 结果与讨论
2.1 色谱及质谱条件的优化
通过测试不同的流动相组成和梯度洗脱条件,优化了色谱分离条件。包含0.1%甲酸的流动相对检测FFA有了更高的敏感性[9],由于FF和CAPd5均含有电负性较高的卤素原子和羟基,在负离子模式下可获得较高的灵敏度;而带有氨基的FFA在正离子模式下更敏感。FF和CAP-d5的母离子选择负离子模式下脱质子的分子离子[M-H]-,FFA、OTC、SMZ的母离子为正离子模式下的质子化分子离子[M+H]+。
在多反应监测模式下对其质谱条件进行优化,选取丰度最高且互不干扰的2个子离子作为定性离子对,其中丰度较高的子离子为定量子离子,另外一个为定性子离子。优化后的4种抗生素的MRM色谱图如图1所示,MS/MS质谱图如图2所示。

图1 抗生素标准品的MRM XIC图
2.2 方法学验证
2.2.1 标准曲线、检出限和定量限、决定限度、检测容量和基质效应

图2 抗生素标品的MS/MS质谱图
如表4所示,4种抗生素类的相关系数R均大于0.99,表明4种抗生素在各自标准系列溶液浓度范围内具有良好的线性关系。LOD和LOQ均通过空白鱼肉提取物中4种抗生素的最低添加水平来估计。LOD是在信噪比为3∶1的情况下的最低添加量,LOQ是在信噪比为10∶1的情况下的最低添加量。本方法的LOQ为0.5~10 μg/kg,对4种药物的测定都相当灵敏,不仅小于国标中对4种抗生素类兽药的最大残留限量(MRLs)的规定(FF+FFA:1 000 μg/kg;OTC:200 μg/kg;SMZ:100 μg/kg)[10],而且低于欧盟标准中4种兽药的MRL(FF+FFA、OTC、SMZ均为100 μg/kg)[11]。表4中CCα和CCβ为按欧盟2002/657/EC的方法学评价要求,在95%的置信水平下,以欧盟标准中4种抗生素的MRL为基准,计算得到在该方法下的决定限度和检测容量[12]。与我国的相关标准相比,欧盟2002/657/EC法令中CCα与检出限的概念类似,但其在出现假阳结果时相对检出限更精准。
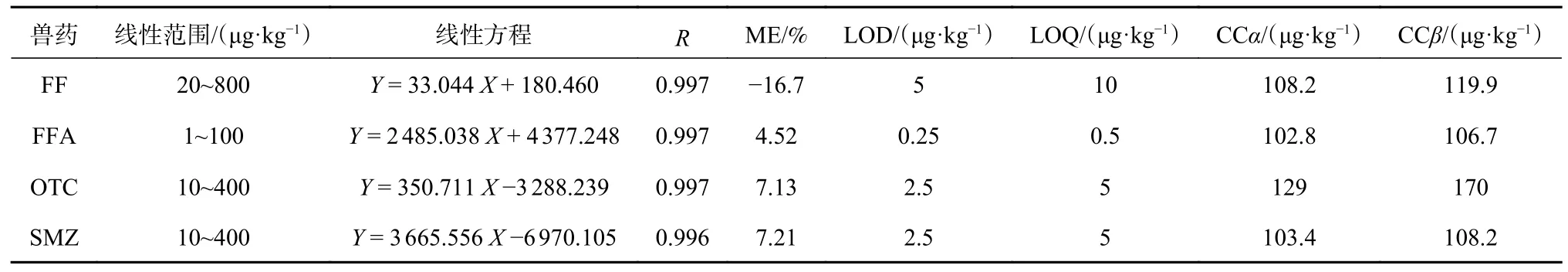
表4 FF、FFA、OTC、SMZ的线性范围、基质效应、LOD、LOQ、CCα和CCβ
FFA、OTC、SMZ的ME值在±10%内,说明这3种兽药无明显基质效应;但FF的ME值>10%且为负值,说明FF表现为基质抑制作用。推测其原因为流动相中加入的甲酸虽使正离子模式下,检测FFA、OTC、SMZ有了更高的敏感性,但却使FF在负离子模式下无法完全被喷雾电离,造成检测信号偏低的现象[13]。
欧盟2002/657/EC法令通过定性离子和定量离子的峰面积计算离子比来评估方法特异性。由鱼肉加标样品的XIC图图3和表5可知,实际样品中的定量离子对与定性离子对的相对丰度比与标准品中一致,且在目标化合物的基峰附近无杂峰,RSD值皆低于15%,离子丰度比率在欧盟规定的容许范围内。

图3 鱼肉加标样品的MRM XIC图
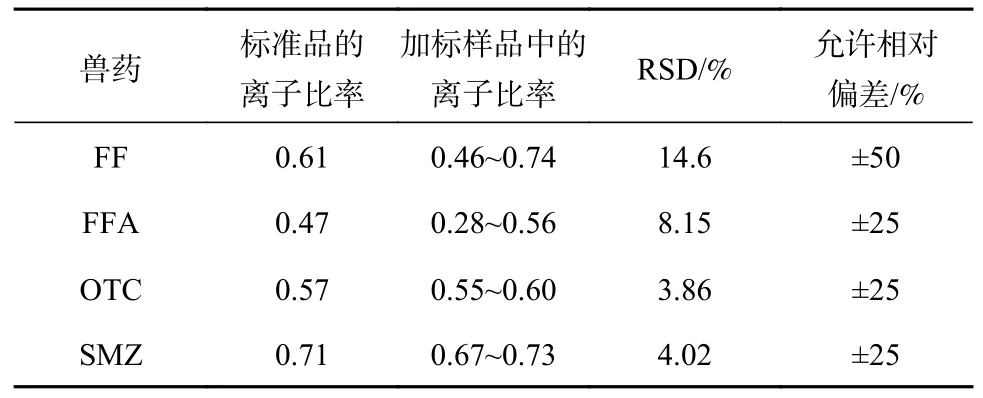
表5 离子对丰度比
2.2.2 准确度、回收率和精密度
FF、FFA、OTC、SMZ在 50、100、150 μg/kg 3个添加浓度下的回收率范围分别为99%~106.5%、90.2%~101.9%、97.3%~104.7%、89.7%~105.8%(见表6),能够较好地满足抗生素类兽药残留的现行标准要求。日内CV与日间CV也符合标准的要求。证明该方法能够有效、高速的检测4种抗生素兽药的残留。

表6 FF、FFA、OTC、SMZ回收率及CV
2.3 鱼肉样品中4种抗生素残留的检出情况
共采集鱼肉样品 88 个,其中FF检出范围为:未检出~317.087 μg/kg,中位数为未检出,检出率17.0%。鱼肉样品中FFA 检出范围为:未检出~61.605 μg/kg,中位数为3.133 μg/kg,检出率75.0%。研究表明FF在体内极易转化为FFA,FFA为FF的代谢产物[14]。在国标中规定FF的残留量以FF与FFA之和计,因此88个鱼肉样品中FF的检出范围为:未检出~322.920 μg/kg,检出率为75.0%。而OTC和SMZ在鱼样品中均未检出。由于氟苯尼考属氯霉素类抗生素,具有毒副作用低、抗菌活性好,价格相对便宜的优点;因此,早在2013年时,氟苯尼考在我国的使用数量已经超过1万t以上,其被广泛应用于水产、鸡、猪等的抗菌治疗中[15]。据李亚菲等[16]2017年的调查研究,广东地区,氟苯尼考的使用量已经成为继阿莫西林、恩诺沙星之后第3大用量的兽药,其走访的29个养禽场中,有14个正在使用或是曾经使用过氟苯尼考。胡建春等[17]调查表明,其在江苏盐城走访的大多数养殖场所均使用氟苯尼考,特别是水产养殖中基本都在使用氟苯尼考进行疾病预防和治疗。Musso等[18]调查表明,氟苯尼考是内蒙古地区肉牛细菌性感染疾病的首选治疗用药之一。张欣昕等[19]对当地农贸市场中472批次的鱼、鸡肉、鸡蛋、牛羊肉进行了检测,所有样品中氟苯尼考的检出率为15.9%,检出的品种主要集中于鸡肉、鸡蛋、部分大肠以及相应的腊制品和蛋类,其中部分批次超出了国家规定的限值。本文的检测数据也表明氟苯尼考是成都市新都区鱼肉样品中的主要抗生素残留,说明氟苯尼考在本地区水产养殖中被广范使用。另外,我国“GB31650—2019食品安全国家标准:食品中兽药最大残留限量”中规定的鱼肉中氟苯尼考的最大残留限量为1 000 μg/kg,虽然氟苯尼考在鱼肉样品中的检出率高达75%,但其残留水平仍然处于安全范围内。
3 结论
本研究建立了基于UPLC-QQQ-MS(超高效液相三重四极杆质谱仪)同时测定鱼肉中氟苯尼考、氟苯尼考胺、土霉素与磺胺甲恶唑等兽药残留的检测方法。其色谱、质谱检测条件和各项方法学评价指标均符合欧盟2002/657/EC法令的要求,对4种兽药残留在0.5~400 μg/kg浓度范围内线性良好,检出限为0.25~5 μg/kg,定量限为0.5~10 μg/kg,决定限度为102.8~129 μg/kg,检测容量为108.2~170 μg/kg,回收率为89.7%~106.5%,日内日间CV≤10.8%,能够较好地满足鱼肉样品中抗生素类兽药残留快速定量筛查的需求。利用该方法对成都市新都区随机抽取的88个鱼肉样品的分析表明,该区域鱼肉样品中主要的抗生素残留为氟苯尼考,但其残留量均低于国标规定的最大残留限量值。
