绒毛膜炎与早产儿神经发育结局的关系
2020-10-15许丽萍陈雯雯林丽聪方小红
许丽萍, 陈雯雯, 许 淳, 林丽聪, 方小红
全球早产儿发生率约为11%[1],胎龄28~34周的早产儿存活率可达90%以上,其中20%左右可能存在夭折、神经发育落后甚至脑瘫等不良预后[2],因而改善早产儿的生活质量尤为重要。早产儿脑损伤包括脑室周、脑室内出血及脑室旁白质损伤,是早产儿成长过程中发生神经发育落后的基础[3]。近年来,早产儿脑损伤的危险因素、病理生理、分子生物学基础及其预后越来越受重视。磁共振对早产儿脑损伤具有较好的诊断价值且对日后神经发育具有预测价值,联合全身运动质量评估可提高预测价值[4-5]。本研究通过对早产儿行头颅MRI检查,客观分析34周以下早产儿脑损伤的发病率及相关危险因素,并随访神经发育结局,报道如下。
1 对象与方法
1.1对象 收集2014年3月-2016年3月收治的早产儿201例,男性110例(54.7%),女性91例(45.3%),出生时胎龄(31.6±1.7)周(28~34周),出生体质量(1 604±242)g(1 000~2 200 g)。排除以下情况:(1)母亲合并妊娠期糖尿病、高血压、严重心肝肾疾病、前置胎盘、胎盘早剥、外伤、多胎妊娠等;(2)胎儿有遗传代谢疾病、先天畸形(如脊肌萎缩症)、21-三体综合征等。本研究经医院伦理委员会同意,患儿父母均签署知情同意书。
1.2方法
1.2.1胎盘组织病理检查 胎盘及胎膜于娩出后取材,甲醛固定,石蜡包埋切片,苏木精-伊红染色,以中性粒细胞浸润羊膜、绒毛膜、蜕膜为组织学绒毛膜羊膜炎(histologic chorioamnionitis, HCA)。HCA的诊断标准:胎盘及胎膜出现多形核白细胞浸润,缺乏临床表现,而表现为慢性或亚临床型。符合两种诊断标准之一者纳入病例组。分度:少量中性粒细胞浸润为轻度;较多中性粒细胞浸润为中度;大量中性粒细胞浸润为重度[6]。阅片均由同一医师完成。
1.2.2影像学检查 所有早产儿均于出生后3~7 d首次行头颅超声检查,每周复查1次,至纠正胎龄34周,生命征平稳后行头颅MRI检查,以确定是否存在脑损伤,包括脑室周、脑室内出血及脑室旁白质损伤。出血分级:1级,丘脑尾部切迹内出血;2级,丘脑尾部切迹外至侧脑室壁出血,不伴侧脑室扩大;3级,伴有侧脑室扩大;4级,脑实质出血或伴囊性病变。脑白质损伤:1级,脑室周围白质小点状病变,病灶≤3 mm;2级,病变累及双侧皮质脊髓束或每半球有≥3个病变;3级,沿侧脑室壁的广泛病变;4级,侧脑室旁囊性病灶。脑损伤以出现的高级别判定[7]。
1.2.3神经行为评定 出院后早产儿随访至纠正胎龄2岁,由经过培训的同一个医师进行Gesell评分,对神经发育行为进行评估,以DQ≤85分判定为神经发育障碍。
1.3统计学处理 采用SPSS 19.0软件进行统计分析,组间比较采用t检验,率的比较采用卡方检验,连续型计数资料进行线性回归分析,计量资料进行Logistic回归分析,P<0.05为差别有统计学意义。
2 结 果
2.1人口学信息分析 201例患儿的HCA检出率为59.7%,男性和女性患儿检出率分别为56.4%和63.7%,差别无统计学意义;胎龄<32周和≥32周的早产儿的检出率分别为67.0%和52.9%,差别有统计学意义(P=0.041);体质量<1 500 g和≥1 500 g的早产儿中的检出率分别为76.9%和51.1%,差别有统计学意义(P=0.001)。所有患儿均完成出生后3~7 d的头颅B超检查。5例患儿转院或放弃治疗,196例患儿出院,并于出院前接受头颅MR检查,行MR检查时纠正胎龄为(35.5±1.4)周。18例Gesell评分至少有1项DQ≤85分,其中2例达脑瘫诊断标准。出院后,失访2例,最终194例随访至纠正胎龄2周岁,出生时胎龄(31.7±1.6)周(28~34周),平均出生体质量(1 615±235)g(1 000~2 200 g)。
2.2脑损伤相关危险因素 经统计分析,孕周<32周、体质量<1 500 g(即极低出生体质量儿)、新生儿呼吸窘迫综合征(respiratory distress syndrome, RDS)、1 min及5 min的Apgar评分≤7分及HCA是早产儿脑损伤的危险因素(表1)。将是否发生脑损伤与有序分类变量孕周及HCA(无炎症或轻度、中度、重度炎症)拟合Logistic回归模型。因体质量与孕周存在线性相关,故不列入方程中拟合。结果发现,孕周每减少2周,脑损伤的风险增加1.21倍[2.21(1.51~3.22)],HCA每增加1度,脑损伤的风险增加0.92倍[1.29(1.34~2.75)]。不同孕龄、不同分度HCA脑损伤情况见图1。
2.3早产儿脑损伤与纠正胎龄至2周岁期间发生神经发育障碍的相关性 脑损伤早产儿具有较高的神经发育障碍的风险,OR值为5.69,95% CI为1.80~18.02。将是否发生神经发育障碍与脑损伤分度拟合Logistic回归发现,脑损伤分度每增高1度,神经发育障碍的风险增加3.68倍[4.68(2.69~8.15)]。18例早产儿在随诊至纠正胎龄2周岁的过程中发现Gesell评分一项或几项DQ≤85分(图2)。
3 讨 论
为提高早产儿的生存质量,降低早产儿脑损伤的发生率,探讨脑损伤的危险因素尤为重要。研究证实,母孕期间应用硫酸镁可降低早产儿脑瘫风险[8],可能与硫酸镁可使早产儿的出生延迟有关。国外针对早产儿的随访及预后的研究更关注24~27周的超早早产儿,孕周越小,早产儿死亡及脑瘫发生的风险就越高[9-11]。然而,脑损伤在28~34周的早产儿中并不少见,这些早产儿在纠正胎龄2周岁时也有可能发生运动、学习、记忆、语言障碍及注意力缺陷等,需要早期觉察和干预。本研究表明,小胎龄、低体质量增加了这些早产儿脑损伤的风险,而脑损伤增加了早产儿纠正胎龄2周岁以内神经发育障碍的风险。有些研究认为,男性性别是脑损伤的危险因素[12],而本研究显示,男性与女性患儿脑损伤的发生率的差别并无统计学意义。
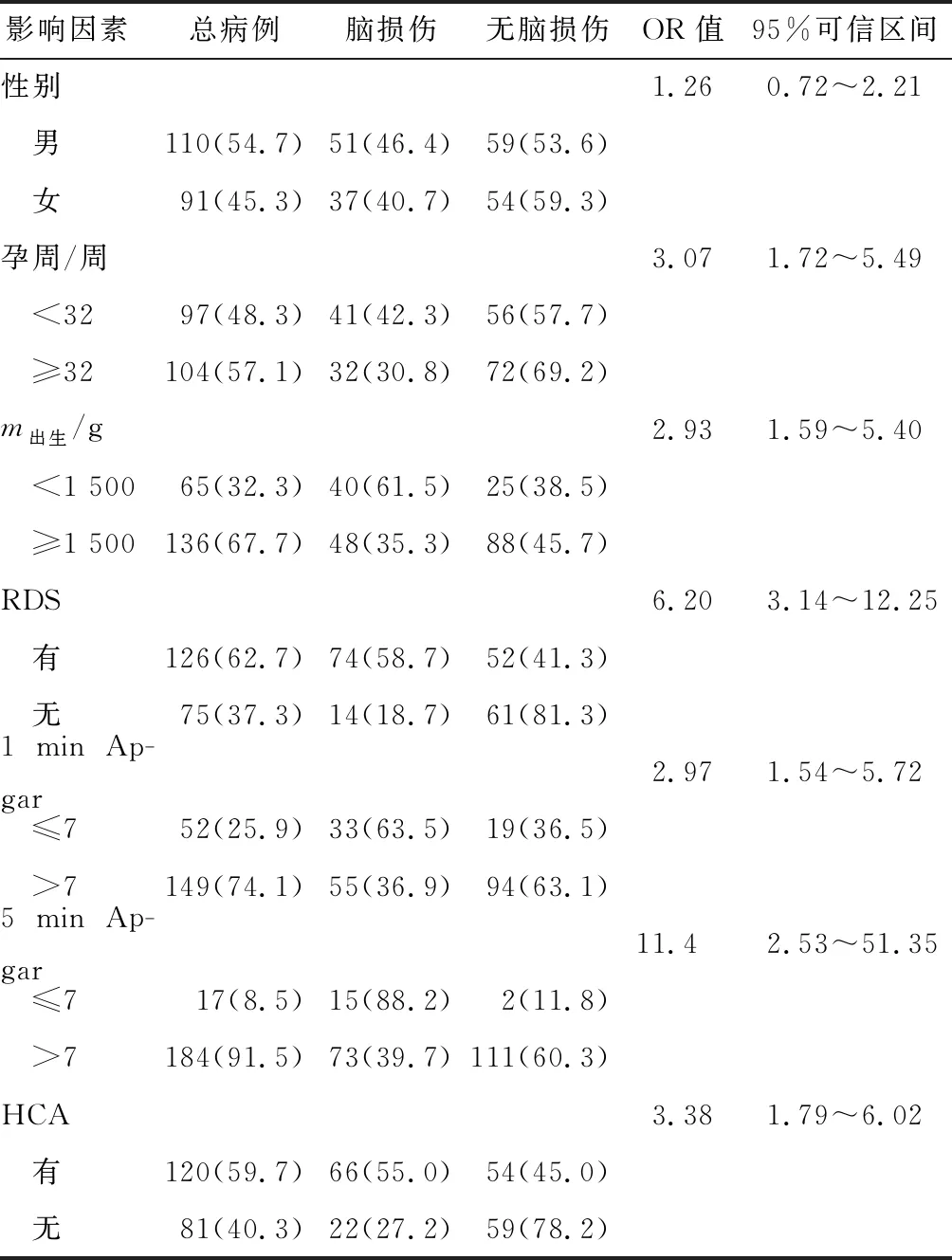
表1 201例28~34周早产儿脑损伤危险因素相关性分析
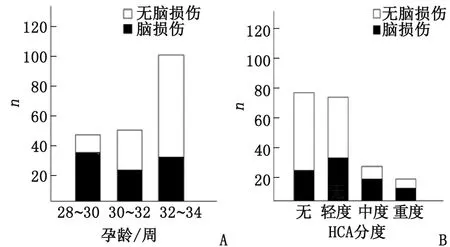
HCA:组织学绒毛膜羊膜炎. A:不同孕龄早产儿;B:不同程度胎盘绒毛膜炎早产儿.图1 不同孕龄及不同程度HCA早产儿脑损伤情况Fig 1 Brain injury in premature infants with different gestational age and degree of chorioamnionitis

图2 18例早产儿Gesell评分DQ≤85分项目分布Fig 2 Item distribution of Gesell score (DQ≤85) in 18 preterm infants
许多早产儿在刚娩出时无有效的自主呼吸,需要产房复苏,尤其是正压通气,出生1 min及5 min Apgar评分仍≤7可能预示持续缺氧-缺血。RDS是早产儿常见的首发并发症,RDS增加了缺氧-缺血性脑损伤的风险[13]。本研究表明,RDS、1 min及5 min Apgar评分≤7分是早产儿脑损伤的危险因素,考虑与缺氧-缺血的病理机制有关。缺氧-缺血是导致今后以运动、认知、感觉功能障碍为特点的神经发育障碍的基础。早产儿的损伤易感区在脑室旁白质,胎龄越小,不成熟脑的脑室旁白质对缺氧-缺血性损伤越敏感,损伤机制包括氧化应激的级联反应、线粒体功能障碍、连续凋亡坏死、自噬和细胞死亡等[14]。
宫内感染为早产的常见原因,HCA则是宫内感染的常见表现形式。HCA的临床表现有发热、寒战、心动过速、子宫压痛、胎膜早破等,然而亚临床型绒毛膜炎往往无上述表现,而仅仅表现为胎盘组织学炎症改变[3]。笔者发现,在胎盘明确为绒毛膜炎的孕母中,近一半为亚临床型,甚至没有胎膜早破的表现,但其孕母的血清C-反应蛋白可能已有所增高。HCA使胎儿暴露于炎症介质中,激发胎儿炎症反应,除引起早产外,还可造成肺、脑、视网膜等相关脏器损伤。炎症反应是早产儿脑损伤的相关危险因子已得到证实,其机制可能包括炎性介质介导的缺血性损害、兴奋性神经递质损害、氧自由基损害和钙离子超载损害等[4-5]。本研究发现,HCA是早产儿脑损伤的危险因素,与上述文献一致,暴露于HCA的早产儿具有较高的脑损伤概率,且炎症等级越高,发生脑损伤的概率越大,炎症等级越高,脑损伤程度越高。
在婴幼儿期,神经系统发育一直十分活跃,尤其是神经细胞树突及神经髓鞘的发育,大脑在结构和功能上具有很强的可塑性,在外界环境和经验的作用下不断塑造其结构和功能[15]。基于此,早期家庭功能干预包括按摩、被动操、视听觉训练、交往训练等,可能有助于改善早产儿预后[16]。建议规范早产儿的随访制度,对出院后早产儿定期进行神经发育评估,及时发现可能存在的神经发育障碍问题,指导家长进行有效的早期干预,以期在神经系统发育的关键时期内,促进大脑的结构和功能往有利的方向发展。
