TNFAIP8在子痫前期胎盘组织中的甲基化情况及表达
2020-10-15柳之彦阮舆鑫董洁琼
林 靓, 柳之彦, 林 容, 阮舆鑫, 董洁琼, 郑 晶
子痫前期(preeclampsia,PE)是一种妊娠期特发的可能导致多器官多系统损害的高血压疾病,发病机制与早期胎盘形成缺陷有关。DNA甲基化是一种相对稳定的表观遗传修饰,为解释胎盘基因的异常表达以及相关信号通路的变化机制提供了良好的切入点。肿瘤坏死因子诱导蛋白8(tumor necrosis factor α-inducing protein 8,TNFAIP8)是一种参与调节细胞增殖和分化的蛋白,在维持细胞稳态和调控自身免疫方面起着重要作用。本研究拟通过人类全基因组芯片筛选胎盘组织候选基因,探讨PE发病机制的表观遗传背景,为子痫的防治和管理提供理论基础。
1 对象与方法
1.1对象 选取2016年3月—2017年8月在笔者医院产科分娩的46例孕妇,其中早发型PE组(early-onset preeclampsia,EOPE)16例,晚发型PE组(late-onset preeclampsia,LOPE)12例,正常足月分娩孕妇组(normal pregnancy,NP)18例。PE诊断参考《妊娠期高血压疾病诊治指南(2020)》的诊断标准,在妊娠34周前因PE终止妊娠者为PE。排除标准:(1)妊娠合并症及并发症:妊娠合并慢性高血压病、糖尿病、肾病、免疫系统疾病、内分泌疾病及肿瘤等;(2)辅助生殖技术受孕;(3)畸胎或死胎;(4)多胎妊娠(≥2胎);(5)嗜酒、吸毒及滥用药物者。本研究经笔者医院伦理委员会批准,研究对象均签署知情同意书。
1.2方法
1.2.1外周血及胎盘组织采集 入院后抽取肘静脉血液2管各3 mL,置于EDTA抗凝管中。胎盘娩出 15 min内从4个不同胎盘小叶取材,用无菌 PBS 缓冲液反复冲洗血污,直至冲洗液接近无色,将组织剪碎至1 mm3,置于冻存管液氮预处理,送-80 ℃冰箱保存。
1.2.2DNA及RNA抽提 采用DNA提取试剂盒(批号:No.59124,德国Qiagen公司)抽提样本DNA,用琼脂糖凝胶电泳检测DNA浓度(≥2 μg)。采用RNA提取试剂盒(Cat#CW0581,中国CWbio公司)提取样本总RNA。
1.2.3Illumina Human 450K甲基化芯片检测 从EOPE组、LOPE组、NP组中选取年龄及孕周相匹配的胎盘各3例,均为单胎自然受孕,孕次1~2次,产次0~1次,进行甲基化芯片检测。
1.2.3.1实验步骤 对提取的胎盘组织DNA进行亚硫酸氢盐处理,针对每个甲基化位点同时设计两种探针,进行芯片杂交、洗脱、延伸、成像,并对探针杂交及亚硫酸氢盐转化效率进行质控。
1.2.3.2数据分析 采用Illumina公司的Genome Studio软件进行原始数据处理分析,包括差别性分析、DeltaBeta筛选及Diffscore筛选。以下为各衡量指标的计算公式:
(1)β值是衡量该位点甲基化程度的指标,该值区间(0,1),越接近于1该位点甲基化程度越高,越接近于0该位点甲基化程度越低。Illumina甲基化平台的计算公式为:
(2)M代表每个探针在IP DNA和input DNA中的相对富集程度,计算公式为:
M=lgβ
1.2.4焦磷酸测序验证 根据候选基因位点序列信息,采用PyroMark Assay Design 2.0设计引物序列(表1)。每个样本各取1~2 μg DNA,用EpiTect Plus DNA Bisulfite Kit甲基化转化试剂盒进行转化,以转化后的DNA样本做模板进行PCR检测。取15~20 μL PCR产物上PyroMark Q24实时定量焦磷酸系列分析仪,PyroQ-CpG软件分析该位点甲基化状态。

表1 焦磷酸测序引物名称及序列
1.2.5RT-PCR检测TNFAIP8-mRNA 取5 μL RNA,用1%琼脂糖凝胶进行电泳检测RNA的完整性。采用DNaseⅠ试剂盒(Cat# CW2090,中国CWbio公司)对RNA中残留的DNA进行消化处理,用HiFi-MMLVcDNA第一链合成试剂盒(Cat#CW0744,中国CWbio公司)进行反转录,上ABI 7500型荧光定量PCR仪检测,用2-△△CT法进行数据相对定量分析。

表2 RT-PCR引物名称及序列
1.2.6Western-blot检测TNFAIP8蛋白 制备 SDS-PAGE胶,提取胎盘及血液蛋白,进行蛋白样品变性电泳及凝胶转膜,测定蛋白浓度,采用Image J软件分析灰度值。

2 结 果
2.1临床资料比较 3组患者的年龄、妊娠和分娩次数、孕早期BMI比较,差别无统计学意义(P>0.05);与NP组比较,EOPE组及LOPE组的平均动脉压和24 h尿蛋白定量升高,分娩孕龄和胎儿出生体质量降低,差别有统计学意义(P<0.05)。
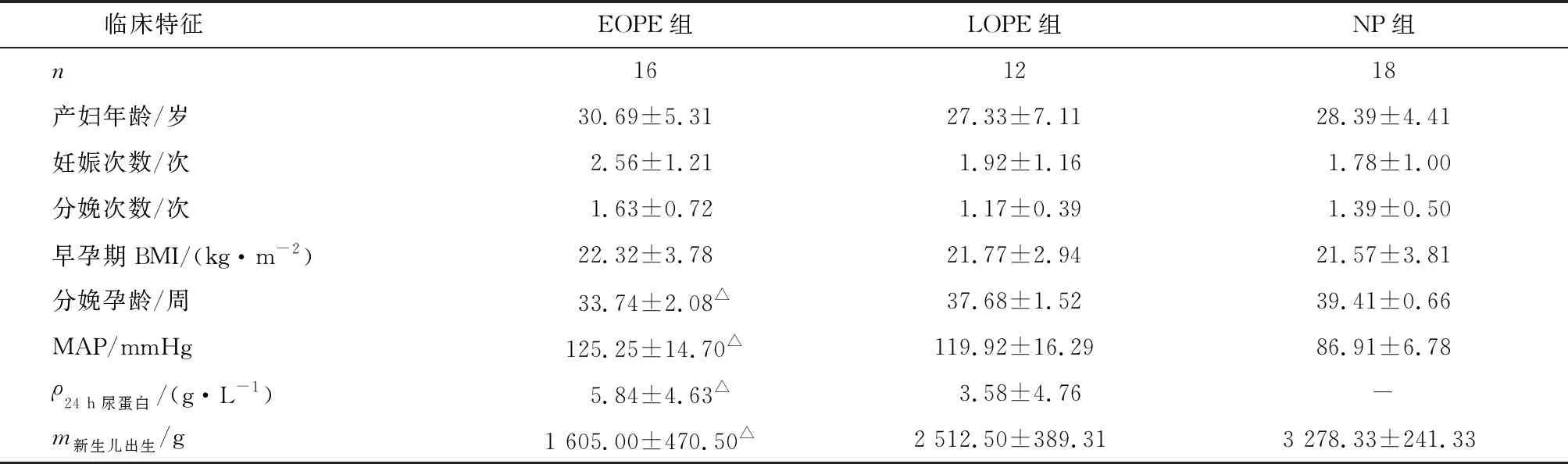
表3 临床资料比较
2.2胎盘组织整体及TNFAIP8位点的甲基化芯片检测结果 胎盘组织TNFAIP8位点探针主要分布在5’UTR区,甲基化芯片共检测485 577个位点。EOPE组、LOPE组和对照组的胎盘整体平均甲基化程度分别为0.47,0.46,0.46。3组的TNFAIP8甲基化程度和富集程度比较,差别有统计学意义(F=6.992,P=0.027;F=6.985,P=0.027)。与LOPE组、NP组比较,EOPE组的甲基化程度和富集程度显著降低,差别有统计学意义(P<0.05);而LOPE组与NP组比较,差别无统计学意义(P>0.05,表4)。

表4 3组胎盘芯片TNFAIP8甲基化水平差别
2.3焦磷酸测序验证TNFAIP8位点甲基化水平
2.3.1焦磷酸测序峰图 设计TNFAIP8的甲基化测序序列为YGGTAATYGTTTTTGTAGTTGGTTAT。测序峰图中蓝色矩形阴影上方对应的黄色方块提示检测效果稳定,所标数值是以百分率表示的该位点甲基化程度(图1)。

图1 TNFAIP8的焦磷酸测序峰图Fig 1 Spectrum of TNFAIP8 pyrosequencing
2.3.23组的TNFAIP8甲基化程度及差别 3组TNFAIP8 基因的两个位点平均甲基化程度见表5。3组的位点1甲基化程度比较,差别有统计学意义(F=6.361,P=0.004);而位点2甲基化程度比较,差别无统计学意义(F=2.984,P=0.061)。EOPE组中出现多例TNFAIP8未甲基化,即甲基化程度为0。位点1中EOPE组4例(25%)未甲基化,LOPE组和NP组无此现象;位点2中EOPE组5例(31.25%)未甲基化,LOPE组1例(8.33%),NP组1例(5.56%)。与NP组比较,EOPE组及LOPE组位点1甲基化程度显著降低,差别有统计学意义(P<0.05);而LOPE组和NP组比较,差别无统计学意义(P>0.05)。

表5 3组间TNFAIP8焦磷酸测序甲基化水平差别
2.4RT-PCR及Western-blot检测胎盘及外周血TNFAIP8蛋白表达 3组胎盘组织的TNFAIP8-mRNA相对定量和蛋白表达比较,差别均有统计学意义(F=243.252,P=0.000;F=38.594,P=0.000)。外周血TNFAIP8-mRNA相对定量和蛋白表达比较,差别均有统计学意义(F=405.209,P=0.000;F=143.199,P=0.000,表6)。组间采用Turkey HSD检验比较,差别有统计学意义(P<0.05)。胎盘和外周血TNFAIP8蛋白电泳图呈现按照EOPE→LOPE→NP顺序表达逐渐下降的趋势(图2)。

表6 3组胎盘和外周血TNFAIP8表达及差别
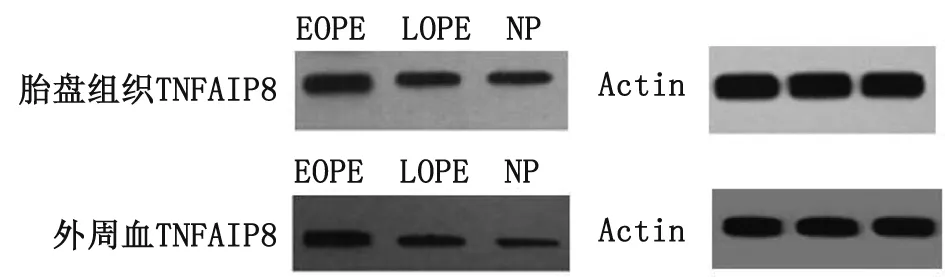
TNFAIP8:肿瘤坏死因子诱导蛋白8; EOPE:早发型子痫前期;LOPE:晚发型子痫前期;NP:正常妊娠.图2 胎盘组织和外周血TNFAIP8电泳条带Fig 2 Electrophoretic bands of TNFAIP8 in the placenta and peripheral blood
3 讨 论
PE是一种妊娠期特有的母亲-胎儿-胎盘疾病,各种发病机制通路之间复杂的相互作用很大程度上阻碍了有效干预靶点的探寻。胎盘在以母体全身性炎症、内皮损伤、高血压和蛋白尿为特征的终末通路中起着关键作用[1]。新近研究不断揭示表观遗传机制在PE发生发展中的作用,特别是DNA甲基化成为胎盘源性疾病研究的焦点所在。甲基化介导的转录失调基序(methylation-mediated transcriptional dysregulation motifs,methTDMs) 可能参与PE的发病机制[2],因此,建立DNA甲基化与PE之间的关联将为探索PE的临床监测指标和药物靶点提供科学依据。
本研究通过人类全基因组Illumina Human 450K甲基化芯片筛选异常甲基化候选基因并用焦磷酸测序验证。虽然3组胎盘总体甲基化程度相近,但是本课题组前期研究显示,特定基因的甲基化程度却各有显著性差别,并涉及免疫及生长发育的多条途径[3]。同源盒基因在人类胎盘中广泛表达,调控胚胎和胎盘发育,而且大多数同源盒基因在整个妊娠过程中都是低甲基化的[4]。本研究结果与此相似,PE尤其是EOPE胎盘组织中TNFAIP8基因显著低甲基化甚至未甲基化。约70%的CpG岛位于人类基因启动子的5’端区域,大多数CpG岛未甲基化,而未甲基化则代表基因具有潜在活性[5]。PE可分为EOPE和LOPE两种亚型。EOPE主要与胎盘重塑、胎盘功能障碍有关;LOPE主要与代谢紊乱、肥胖、糖尿病、脂代谢紊乱和炎症影响内皮功能有关[6]。本研究TNFAIP8的甲基化焦磷酸测序验证结果也显示,相对于LOPE和NP组,EOPE组胎盘的甲基化程度显著降低;但是LOPE和NP组却未显示出差别,这可能与两种亚型发病机制存在不同有关。既往认为两者是同一种疾病的两种阶段,但是现在更多的研究结论倾向于两者是机制截然不同的两种疾病。
1997年,Patel等在人类头颈鳞状细胞癌株上首先发现并鉴定出TNFAIP8蛋白[7],也称为SCC-S2、GG2-1和NDED,它是一种和细胞凋亡密切相关的免疫调节蛋白。TNFAIP8包含一个假定的死亡效应域,可影响各种类型细胞的凋亡和自噬[8]。TNFAIP8的表达与前列腺癌、肝癌、肺癌、乳腺癌、结肠癌、食道癌、卵巢癌、宫颈癌、胰腺癌等多种癌症的发病机制密切相关[9],且影响化疗耐药性及生存预后[10]。在胎盘形成早期,滋养细胞的行为极其类似于肿瘤细胞,具有形成血管、迁移、侵袭等功能。
有研究显示,降低肿瘤细胞TNFAIP8的表达,将降低血管内皮生长因子受体VEGFR-2、基质金属蛋白酶MMP-1及MMP-9的表达[11]。若用小干扰RNA沉默成纤维细胞上TNFAIP8的表达,MMP-1产生水平也明显降低[12]。既往研究已证实,系列MMPs分子与PE发病相关,MMP-3与EOPE有关,而与LOPE无关;升高的MMP-2和MMP-13及降低的MMP-9均与早发及晚发型重度PE有关[13]。本研究中,PE尤其是EOPE胎盘组织中TNFAIP8-mRNA和蛋白的过表达导致系列MMPs分子异常表达,影响母胎界面血管床重塑障碍出现胎盘形成缺陷。另外,PE孕妇外周血管过表达MMPs受体,MMP可通过该受体发挥强大的收缩血管功能,准确模拟PE全身外周血管痉挛的病理特征;而MMPs介导的胶原蛋白不平衡性刺激溶胶原活性,也会造成血管壁通透性增加引起PE特有的症状水肿和蛋白尿[13]。因此,TNFAIP8作为MMPs分子导致PE发病的上游原因之一,可作为深入探索发病机制以及纠正血管和胶原蛋白功能的切入点,改善PE预后。
本研究还发现,与NP组比较,EOPE组和LOPE组的外周血中TNFAIP8蛋白表达差别也很显著。Xiang等发现,正常孕妇外周血中TNFAIP8家族成员TIMP-3完全甲基化,而发生PE时胎盘中TIMP-3则明显低甲基化或未甲基化[15],由此,检测母血中由胎盘释放的异常甲基化TIPM-3浓度有望实现早期诊断和预测PE。本研究也证实了外周血TNFAIP8的表达水平能切实反映胎盘的病理性甲基化情况,后续研究将探讨不同孕周孕妇外周血中TNFAIP8的甲基化情况,进一步验证TNFAIP8作为诊断和预测的外周血生物学指标的可行性。
PE是妊娠期特有的严重影响母婴预后的疾病之一,TNFAIP8在胎盘中的表达以及和PE是否存在关联,目前研究还很有限。本课题组在后续已完成的胎盘组织miRNA测序研究中也发现了TNFAIP8的上游微调控开关,后续将把TNFAIP8作为关键蛋白,推测异常转录翻译的信号通路,探索上游和下游的调控机制,丰富PE的发病理论,并验证其作为预测指标的可行性,这对于完善PE的分子生物学机制具有重要的理论意义和潜在的应用价值。
