MicroRNA-802对胰岛素抵抗的骨骼肌细胞PI3K/Akt通路的影响
2020-10-14甄云凤冯静唐勇齐翠娟甘可欣费雯婕温丰华宋光耀
甄云凤,冯静,唐勇,齐翠娟,甘可欣,费雯婕,温丰华,宋光耀
河北省人民医院内分泌科,石家庄 050031
随着生活方式的改变,我国2型糖尿病发病率呈现快速增长的趋势,且合并的心、脑、肾等器官的慢性并发症严重威胁人民群众的身心健康[1]。胰岛素抵抗(insulin resistance,IR)是2型糖尿病的重要发病机制,也是糖尿病早期预防的关键环节。IR主要表现为胰岛素敏感的组织或器官(如肝脏、骨骼肌、脂肪组织等)对胰岛素的反应性或敏感性降 低[2-3]。骨骼肌是葡萄糖、脂质摄取及利用的主要器官,体内约80%的糖代谢是在骨骼肌内完成的,因此阐明骨骼肌IR的机制非常重要。
MicroRNA(又称miRNA)是一类参与基因转录后水平调控的非编码小分子单链RNA,其表达具有高度保守性、组织特异性及发育阶段特异性[4]。目前,对于miRNA的研究主要集中在心血管疾病、糖尿病、肥胖、肿瘤等领域[5-8]。研究显示,miRNA与糖脂代谢、IR关系密切,多种miRNA的表达异常与IR有关,如miRNA-802。深入研究miRNA可能为2型糖尿病的治疗带来全新的方法[9]。Higuchi等[10]研究发现,与糖耐量正常的人群相比,2型糖尿病患者血清miR-802的水平明显升高,肥胖小鼠血清、肝脏及骨骼肌组织中的miR-802表达水平高于正常体重小鼠,提示miR-802可能与糖代谢及IR有关,其具体作用机制值得进一步研究。本研究通过建立IR的L6成肌细胞模型,探讨miR-802对骨骼肌细胞糖代谢的影响,以期寻找2型糖尿病的潜在治疗靶点。
1 材料与方法
1.1 主要材料及试剂 大鼠L6成肌细胞系购自上海生命科学院,保存于河北省人民医院临床医学研究中心/河北省代谢病重点实验室。DMEM培养基(美国Hyclone公司),胎牛血清(FBS,美国ScienCell公司),Trizol试剂、Lipofectamine 2000转染试剂(美国Invitrogen公司)。miR-802模拟物、miR-802抑制剂及转染对照均由锐博(广州)生物科技有限公司构建。miR-802引物、microRNA提取、Real-Time PCR反转录及PCR试剂盒(天根生化试剂公司)、棕榈酸(美国Sigma公司)、磷脂酰肌醇3-激酶(phosphatidylinositol 3-kinase,PI3K,货号ab32089)、p-PI3K(货号ab182651)及葡萄糖转运蛋白(glucose transport protein 4,GluT4,货号ab216611)均购自英国Abcam公司,蛋白激酶B(protein kinase B,又称Akt,货号3063)及p-Akt(Ser473,货号4060)均购自美国Cell Signaling 公司。
1.2 方法
1.2.1 L6细胞培养、分化及鉴定 从液氮中取出冻存的L6成肌细胞,迅速放入37 ℃左右的水中复温,使冻存的细胞尽快融化后转移至含有培养基(10%胎牛血清,DMEM,1%青霉素、链霉素)的培养瓶中,吹打混匀后置入37 ℃、5% CO2培养箱中培养,次日更换新的培养基。当L6成肌细胞生长达到贴壁面积的60%左右时,此时期的L6肌细胞为未分化组,更换细胞培养基为分化培养基(2%胎牛血清,97%DMEM,1%青霉素、链霉素),细胞分化5 d后为分化组。收集细胞并提取其总RNA,采用RT-PCR方法检测分化组与未分化组的骨骼肌分化标志性基因Desmin及Myogenin的mRNA表达量,从基因水平鉴定分化是否成功。
1.2.2 L6成肌细胞IR体外模型的建立及鉴定 细胞分化成功后,更换培养基为不含FBS的DMEM培养12 h。用0.4 mmol/L棕榈酸(palmitic acid,PA)孵育细胞24 h,为棕榈酸干预组,对照组加同样体积的空白溶液。模型鉴定方法如下[11]:弃去原培养基,PBS洗涤细胞3次,用含有100 nmol/L胰岛素的正常培养基孵育两组细胞24 h后,采用葡萄糖氧化酶法测定培养基中剩余葡萄糖含量。
1.2.3 L6成肌细胞的转染及miR-802、PI3K、Akt和GluT4 mRNA表达水平检测 当诱导分化成功的L6成肌细胞浓度达到约60%时,按照转染试剂Lipofectamine 2000的操作说明分别转染miR-802的模拟物和抑制剂。将细胞分为5组:正常对照组、棕榈酸组、棕榈酸+miR-802模拟物组、棕榈酸+ miR-802抑制剂组、棕榈酸+转染对照组。转染成功后分别提取miRNA和总RNA,反转录后采用realtime PCR分析miR-802、PI3K、Akt和GluT4 mRNA表达水平。
1.2.4 骨骼肌细胞蛋白的提取 将待处理的细胞用含100 nmol/L胰岛素的培养基刺激30 min后,弃去原有培养基,用预冷的PBS洗涤2次,倒置于冰板上约10 min,每瓶内加入800 μl裂解液,4 ℃裂解45 min,使细胞充分裂解。裂解结束后,用细胞轻刮培养瓶底,整个过程均在冰板上进行。然后将细胞悬液转移至1.5 ml EP管中,4 ℃下12 000×g离心30 min。离心结束后,将上清液转移至另一EP管,按蛋白样品:5×上样缓冲液为4:1的比例加入上样缓冲液,充分混匀后,95 ℃加热5 min,每管100 μl分装,得到蛋白样品电泳加样液,-20 ℃储存备用。
1.2.5 Western blotting检测各组PI3K、Akt及GluT4蛋白的表达水平 配制6%浓缩胶及12%分离胶备用,湿转至PDF膜上,用含5%脱脂奶粉的TBST溶液于37 ℃孵育30 min。加入兔抗PI3K、抗p-PI3K抗体、抗Akt、抗p-Akt、抗GluT4-抗体和抗β-action抗体孵育(1:6000),4 ℃过夜,最后加入碱性磷酸酶标记的山羊抗兔IgG,37 ℃孵育1 h,TBST洗涤3次,β奈酚磷酸显色,通过凝胶成像系统对X线片照相,用AlphaEase FC软件进行条带分析。
1.3 统计学处理 采用SPSS 13.0软件进行统计分析。实验数据均以±s表示,两样本均数呈正态分布且方差齐时,两组间比较采用t检验,多组间比较采用方差分析,进一步两两比较采用LSD-t检验。P<0.05为差异有统计学意义。
2 结 果
2.1 L 6 成肌细胞的分化鉴定 分化组细胞的Desmin mRNA表达水平(3.56±0.63)明显高于未分化组(0.80±0.09),Myogenin mRNA表达水平(4.01±0.59)亦明显高于未分化组(0.78±0.42),差异有统计学意义(t=13.496、13.297,P<0.05),提示L6成肌细胞分化成功。
2.2 L6成肌细胞IR体外模型的建立 棕榈酸组培养基中葡萄糖浓度[(20.46±1.52) mmol/L]明显高于正常对照组[(14.36±1.38) mmol/L],差异有统计学意义(t=11.522,P<0.05),提示其胰岛素敏感性下降,IR模型建立成功。
2.3 各组L6成肌细胞中miR-802 mRNA表达水平比较 与正常对照组(1.458±0.264)相比,棕榈酸组(3.108±0.513)、棕榈酸+miR-802模拟物组(11.743±0.933)、棕榈酸+转染对照组(3.442±0.104)的miR-802 mRNA表达均升高;与棕榈酸组相比,棕榈酸+miR-802模拟物组的miR-802 mRNA表达明显升高,而棕榈酸+miR-802抑制剂组的miR-802 mRNA表达(1.069±0.056)明显降低;与棕榈酸+miR-802模拟物组相比,棕榈酸+转染对照组及棕榈酸+miR-802抑制剂组的miR-802 mRNA水平均降低;与棕榈酸+转染对照组相比,棕榈酸+miR-802抑制剂组的miR-802 mRNA水平降低 (图1),提示miR-802的模拟物或抑制剂转染成功。
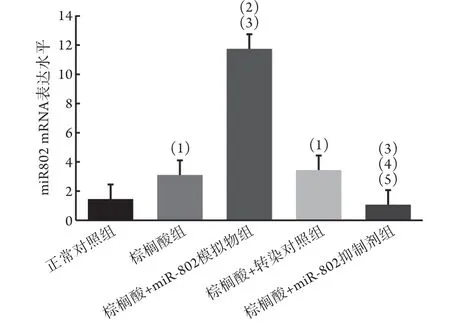
图1 各组L6成肌细胞miR-802 mRNA表达水平比较(±s, n=6)Fig.1 Comparison on mRNA expression of miR-802 in L6 myoblasts (±s, n=6)
2.4 各组PI3K、Akt及GluT4 mRNA表达水平比较 与正常对照组相比,棕榈酸组、棕榈酸+miR-802模拟物组、棕榈酸+转染对照组L6成肌细胞PI3K、Akt及GluT4 mRNA表达水平下降;与棕榈酸组相比,棕榈酸+miR-802模拟物组PI3K、Akt及GluT4 mRNA表达下降,棕榈酸+miR-802抑制剂组PI3K、Akt及GluT4 mRNA表达升高;与棕榈酸+miR-802模拟物组相比,棕榈酸+转染对照组及棕榈酸+miR-802 抑制剂组PI3K、Akt及GluT4 mRNA表达均升高;与转染对照组相比,棕榈酸+miR-802抑制剂组PI3K、Akt和GluT4 mRNA表达水平升高,差异均有统计学意义(P<0.05,表1)。
2.5 各组PI3K、p-PI3K、Akt、p-Akt及GluT4的蛋白表达水平比较 与正常对照组相比,棕榈酸组、棕榈酸+miR-802模拟物组、棕榈酸+转染对照组L6成肌细胞p-PI3K/PI3K、p-Akt/Akt及GluT4蛋白表达水平均下降;与棕榈酸组相比,棕榈酸+miR-802模拟物组p-PI3K/PI3K、p-Akt/Akt及GluT4蛋白表达水平下降,棕榈酸+miR-802抑制剂组p-PI3K/PI3K、p-Akt/Akt及GluT4蛋白表达水平均升高;与棕榈酸+miR-802模拟物组相比,棕榈酸+转染对照组及棕榈酸+miR-802抑制剂组p-PI3K/PI3K、p-Akt/Akt及GluT4蛋白表达水平均升高;与转染对照组相比,棕榈酸+miR-802抑制剂组p-PI3K/PI3K、p-Akt/Akt及GluT4蛋白表达水平升高,差异均有统计学意义(P<0.05,图2,表1)。
表1 各组PI3K、Akt及GluT4 mRNA及蛋白的表达水平比较(±s, n=6)Tab.1 The mRNA and protein expressions of PI3K, Akt and GluT4 in each group (±s, n=6)
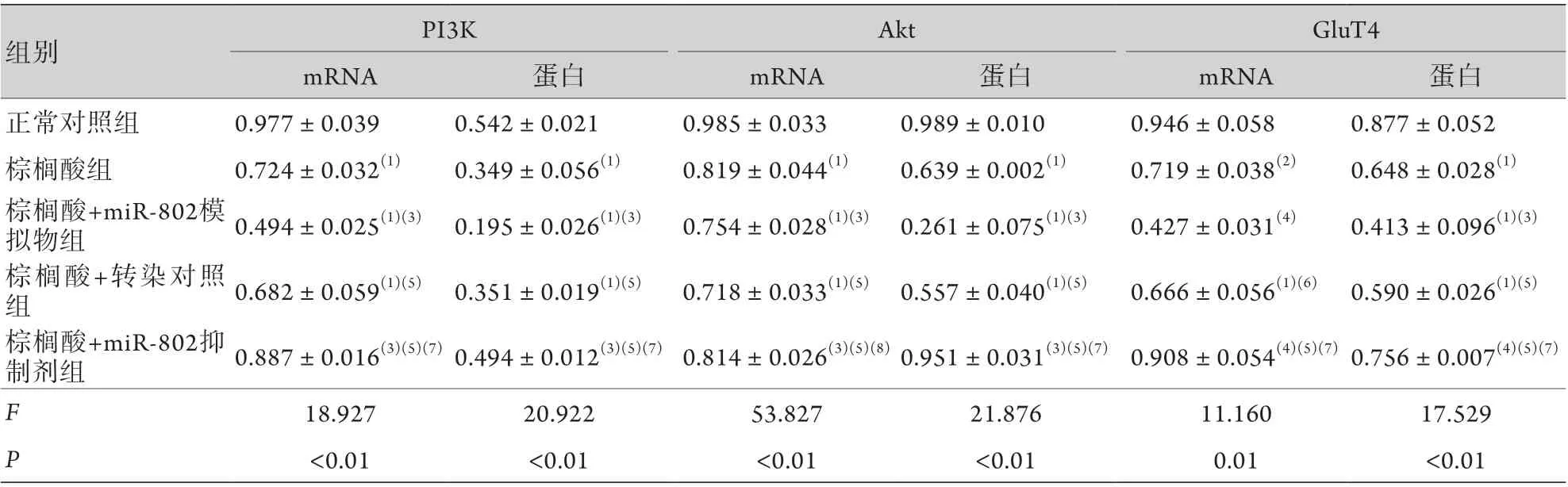
表1 各组PI3K、Akt及GluT4 mRNA及蛋白的表达水平比较(±s, n=6)Tab.1 The mRNA and protein expressions of PI3K, Akt and GluT4 in each group (±s, n=6)
与正常对照组比较,(1)P<0.01,(2)P<0.05;与棕榈酸组比较,(3)P<0.01,(4)P<0.05;与棕榈酸+miR-802模拟物组比较, (5)P<0.01,(6)P<0.05;与棕榈酸+转染对照组比较,(7)P<0.05,(8)P<0.01。
组别 PI3K Akt GluT4 mRNA 蛋白 mRNA 蛋白 mRNA 蛋白正常对照组 0.977±0.039 0.542±0.021 0.985±0.033 0.989±0.010 0.946±0.058 0.877±0.052棕榈酸组 0.724±0.032(1) 0.349±0.056(1) 0.819±0.044(1) 0.639±0.002(1) 0.719±0.038(2) 0.648±0.028(1)棕榈酸+miR-802模拟物组 0.494±0.025(1)(3) 0.195±0.026(1)(3) 0.754±0.028(1)(3) 0.261±0.075(1)(3) 0.427±0.031(4) 0.413±0.096(1)(3)棕榈酸+转染对照组0.682±0.059(1)(5) 0.351±0.019(1)(5) 0.718±0.033(1)(5) 0.557±0.040(1)(5) 0.666±0.056(1)(6) 0.590±0.026(1)(5)棕榈酸+miR-802抑制剂组 0.887±0.016(3)(5)(7) 0.494±0.012(3)(5)(7) 0.814±0.026(3)(5)(8) 0.951±0.031(3)(5)(7) 0.908±0.054(4)(5)(7) 0.756±0.007(4)(5)(7)F 18.927 20.922 53.827 21.876 11.160 17.529 P<0.01 <0.01 <0.01 <0.01 0.01 <0.01
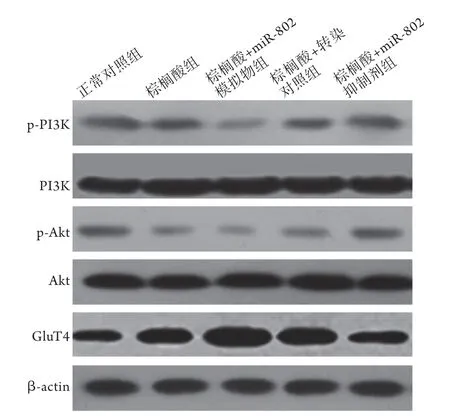
图2 各组PI3K、p-PI3K、Akt、p-Akt及GluT4蛋白表达 水平Fig.2 The protein expressions of PI3K, p-PI3K, Akt, p-Akt and GluT4 in each group
3 讨 论
MiRNA是内源性非编码小分子RNA,在哺乳动物转录后基因表达中起重要作用,可通过结合mRNA 3'端非翻译区(3'-UTR)抑制靶基因转录或使其降解[12-13]。近年来有学者发现,miRNA与IR、糖尿病及其微血管并发症密切相关,在胰岛素合成、分泌及胰岛素在周围组织中的抵抗中也起重要作 用[14-15]。研究发现,miR-375是胰岛β细胞葡萄糖代谢和胰岛素分泌的有效调节因子,可能是β细胞发育成熟的决定因素[16]。体内实验研究发现上调miR-155的表达后,小鼠空腹及餐后血糖均下降,且伴有体重减轻[17],提示miR-155的表达与IR呈负相关。与正常对照者相比,伴有微血管并发症的2型糖尿病患者血清中miR-661、miR-571和miR-892b等表达明显升高,提示这些miRNA与微血管并发症显著相关[18]。
IR是指外周靶器官(骨骼肌、脂肪组织、肝脏)对生理剂量胰岛素的反应减弱,最终导致糖代谢能力下降[19-20]。骨骼肌是胰岛素作用的主要靶器官之一,体内约80%的糖代谢是在骨骼肌内完成 的[21],因此阐明骨骼肌IR的机制非常重要。研究发现,糖尿病患者血清、肝脏、胰腺及骨骼肌组织中miR-802的表达水平均较糖耐量正常组升高,体内及体外实验发现调节胰腺中miR-802的表达可以影响胰岛素的转录和分泌,进而引起葡萄糖代谢的异常,表明miR-802与胰岛素分泌及糖代谢密切相关,但对其在骨骼肌组织中的作用未进一步进行验 证[10,22]。本研究发现,IR模型的L6肌细胞中miR-802表达水平较正常对照组升高,胰岛素信号通路的关键基因(PI3K、Akt)及骨骼肌葡萄糖转运蛋白(GluT4)表达均减少,因此,笔者推测miR-802可能通过调控骨骼肌胰岛素信号通路而影响葡萄糖 代谢。
胰岛素作用的主要信号通路是PI3K-Akt途径,PI3K是调节糖代谢的关键蛋白,Akt是位于其下游的重要的蛋白激酶,参与多种信号通路,在糖原和蛋白合成、葡萄糖转运、细胞凋亡等方面发挥重要的作用。GluT4主要表达于骨骼肌和脂肪组织,在骨骼肌细胞膜中负责葡萄糖的转运和摄取,进而在糖代谢过程中发挥重要作用。IR可影响骨骼肌细胞PI3K、Akt和GluT4的表达及功能,进而调节骨骼肌细胞的葡萄糖摄取能力,引起糖代谢紊乱[23]。
本研究采用棕榈酸孵育L6成肌细胞的方法构建IR模型,在此模型上通过质粒转染技术上调miR-802的表达后,发现骨骼肌细胞中PI3K及Akt的表达是降低的,且伴有GluT4表达降低,提示胰岛素敏感性下降,且伴有骨骼肌细胞对葡萄糖转运能力的下降;在棕榈酸组,通过转染miR-802抑制剂下调miR-802表达后,骨骼肌细胞PI3K及Akt的磷酸化水平均升高,GluT4的表达增加,改善了骨骼肌细胞胰岛素信号的传导,增加了葡萄糖摄取及转运。提示miR-802可能通过调节骨骼肌细胞PI3K-Akt通路来影响胰岛素敏感性及葡萄糖代谢。
综上所述,棕榈酸诱导IR的L6成肌细胞中miR-802表达升高,调节miR-802的表达可以影响胰岛素信号传导及葡萄糖稳态,但其作用的具体靶基因尚不清楚。笔者下一步将通过基因芯片技术或靶基因预测网站筛选并验证miR-802调节骨骼肌糖代谢及胰岛素敏感性的靶基因,为2型糖尿病及肥胖的治疗提供新的理论基础及作用靶点。
