纳洛酮腹腔注射对蛛网膜下腔出血大鼠学习记忆能力及海马CA1区神经细胞自噬的改善作用
2020-10-14李小亮李林孙林林李君陈扬付爱军
李小亮,李林,孙林林,李君,陈扬,付爱军
1华北理工大学附属医院,河北唐山 063000;2郑州市第七人民医院;3开滦总医院林西医院
各种原因引起脑底部或脑表面血管发生病理性改变,导致血管壁损伤并破裂,血液进入蛛网膜下腔而引起一系列临床综合征,此种综合征在临床上被称为蛛网膜下腔出血(SAH),严重威胁患者的生命健康[1]。SAH是一种比较严重的神经系统疾病,在脑血管疾病中,占比约为10%,具有较高的致残率及病死率[2]。近期研究结果显示,自噬在SAH后脑组织细胞损伤的一系列病理生理机制中具有重要作用,能够增强细胞对损伤性刺激的耐受能力进而稳定细胞的结构和功能。临床研究[3,4]发现,阿片类受体拮抗剂纳洛酮注射液具有一定的神经保护作用及神经营养功效,但对SAH后神经细胞自噬的影响尚不明确。2016年10月~2019年2月,本实验通过血管内穿刺法制作SAH模型,并给予纳洛酮注射液干预,观察纳洛酮注射液对SAH大鼠行为学变化及海马区神经细胞中自噬相关蛋白Beclin-1和LC3-Ⅱ表达的影响,探讨纳洛酮注射液对脑组织保护作用的可能机制。
1 材料与方法
1.1 动物、试剂及仪器 清洁级SD雄性大鼠36只,周龄9~12周,体质量300~400(236.21±4.75)g,购自北京华阜康生物科技股份有限公司(许可证号SCXK(京)2014-0004)。饲养温度在19~25 ℃、湿度55%~65%的环境下,保证日常光照10~12 h,噪音<60 dB,定期清洗并消毒鼠笼,对大鼠进行适应性喂养1周后开始实验。 药品与试剂:纳洛酮(四川青木制药有限公司,国药准字H20113359),兔抗Beclin-1多克隆抗体和兔抗LC3-Ⅱ多克隆抗体(日本株式会社)、DAB显色试剂盒(北京中杉金桥生物技术有限公司)。仪器:TP-1型摊片机、820-Ⅱ型切片机(德国Leica公司),显微镜(日本奥林巴斯公司),图像采集及分析系统、凝胶成像分析系统(美国Bio-Rad公司)。
1.2 大鼠分组、SAH模型建立及纳洛酮给药方法 36只实验大鼠随机等分为纳洛酮组、SAH组、假手术组。称重后,以0.3 mL/100 g的标准计算10%水合氯醛用量,采用腹腔内注射的给药方式进行麻醉。待大鼠对刺激无反应后,取仰卧位,将门齿及四肢固定于操作台。纳洛酮组、SAH组参照文献[4]的颈内动脉穿刺法建立SAH模型,颈部备皮后,消毒贴膜,沿正中纵行切开颈部皮肤,作皮下组织钝性分离,分离颈部神经血管,结扎并剪断颈外动脉,纤芯自颈外动脉近端穿入,并经颈内动脉穿入颅内刺破血管,造成蛛网膜下腔出血,建模成功后,拔出纤芯,碘伏棉球进行消毒,并于造模完成后将大鼠正常饲养。假手术组按上述步骤进行操作,但不刺破血管。纳洛酮组造模成功后立即腹腔注射纳洛酮注射液(150 mg/kg),每12 h重复1次,SAH组及假手术组给予等量的0.9%氯化钠溶液。
1.3 各组学习记忆能力观察 采用穿梭箱实验。实验大鼠于造模前2 d开始进行穿梭箱练习,2次/d,建立大鼠的条件反射。造模成功后24 h行穿梭箱实验,首先环境熟悉5 min,然后予声光刺激5 s,接着电击20 s(1.5 mA),完成一次实验。两次实验之间休息20 s,共计30次。记录大鼠逃到安全区的时间和逃到安全区的次数。
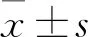
1.4 各组海马神经细胞形态学观察 采用HE染色。穿梭箱实验后,各组随机选出6只大鼠,麻醉后4%多聚甲醛灌注,剥离出大鼠脑组织并固定3 d。石蜡包埋后切取带海马CA1区的切片(5 μm),60 ℃恒温烤箱过夜处理,取出切片后放于二甲苯中进行脱蜡,乙醇脱水,苏木素浸泡1 min,流动水冲洗后1%盐酸乙醇分化,流动水冲洗,1%伊红染液处理2 min,乙醇梯度脱水5 min,二甲苯透明5 min,取出切片后,显微镜下观察染色满意,滴入中性树胶,盖玻片封闭。每块脑组织取6张切片进行HE染色。显微镜(×400)下观察海马CA1区神经细胞形态及结构,Motic-6.0图像分析系统统计正常形态及结构的神经细胞数量。
1.5 各组海马神经细胞Beclin-1、LC3-Ⅱ蛋白检测 采用免疫组织化学染色法。石蜡切片,60 ℃烤箱过夜,脱蜡、水化,高压修复120 s,PBS缓冲液冲洗。取6张切片滴加Beclin-1抗体(1∶150),另取6张切片滴加LC3-Ⅱ抗体(1∶150),4 ℃冰箱过夜,PBS洗涤,加入组化二抗,37 ℃温箱孵育30 min,PBS洗涤,DAB显色,脱水、透明、封片。光学显微镜(×400)下观察神经细胞,随机选取3个不同视野采集图片,Image Pro Plus 6.0图像分析软件计算Beclin-1、LC3-Ⅱ阳性神经细胞数量。
1.6 各组海马组织中Beclin-1、LC3-Ⅱ蛋白检测 采用Western blotting法。取每组剩余的6只大鼠,断头后即刻冰上剥离海马组织,RIPA裂解研磨好的海马组织,高速低温离心后提取上清液,BAC法测定蛋白浓度。依次进行电泳、湿法转膜、脱脂牛奶抗原封闭,滴加Beclin-1一抗(1∶1 000)、LC3-Ⅱ一抗(1∶1 000),4 ℃冰箱振荡过夜,洗膜,加入二抗,再次洗膜,滴加显影液,凝胶成像分析系统发光显影。以β-actin作为内参,采用Quantity One软件对结果进行分析,计算Beclin-1、LC3-Ⅱ的相对灰度值。
2 结果
2.1 各组逃到安全区时间、逃到安全区次数比较 假手术组大鼠行为学功能(学习记忆能力)良好,面对声光及电流刺激具有较好的应对能力,能够以较短的时间及较多次数躲避到安全环境中。与假手术组比较,SAH组逃到安全区时间延长、逃到安全区次数减少(P均<0.05);与SAH组比较,纳洛酮组逃到安全区时间缩短、逃到安全区次数增加(P均<0.05),详见表1。

表1 各组大鼠逃到安全区时间、逃到安全区次数比较
2.2 各组大鼠海马区神经细胞数目比较 假手术组海马CA1区神经细胞多数外形及结构正常,胞膜、胞核外形规整,胞核梭形固缩、深染情况很少,未发现核破碎情况。SAH组海马CA1区神经细胞胞核梭形固缩、深染情况明显增多,并有较多核破碎及溶解现象(见图1)。纳洛酮组与SAH组相比,胞核梭形固缩、深染、核破碎情况均明显较少。纳洛酮组、SAH组、假手术组海马区神经细胞数目分别为(96.78±3.83)、(79.00±6.07)、(120.83±7.63)个/HP。与假手术组比较,SAH组正常形态及结构的神经细胞数目减少(P<0.05);与 SAH 组比较,纳洛酮组正常形态及结构的神经细胞数目增多(P<0.05)。

图1 各组海马CA1区神经细胞形态(HE染色,×400)
2.3 各组大鼠海马CA1区Beclin-1、LC3-Ⅱ阳性细胞数及海马组织中Beclin-1、LC3-Ⅱ蛋白表达比较 假手术组可见少数细胞的胞质中显现出淡黄色、浅褐色或淡棕色的细沙样颗粒状物质;与假手术组比较,SAH组Beclin-1、LC3-Ⅱ阳性细胞数目均增加(P均<0.05);与SAH组比较,纳洛酮组Beclin-1、LC3-Ⅱ阳性细胞数目均增加(P均<0.05),详见图2、图3及表2。
假手术组Beclin-1、LC3-Ⅱ蛋白量处于较低水平。与假手术组比较,SAH组海马组织中Beclin-1、LC3-Ⅱ蛋白表达升高(P均<0.05);与SAH组比较,纳洛酮组海马组织中Beclin-1、LC3-Ⅱ蛋白表达升高(P均<0.05),详见图4、表2。
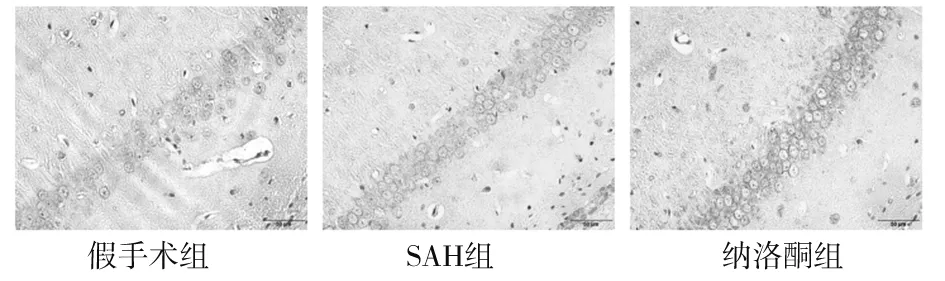
图2 各组大鼠海马CA1区Beclin-1阳性细胞(免疫组织化学染色,×400)

图3 各组大鼠海马CA1区LC3-Ⅱ阳性细胞(免疫组织化学染色,×400)
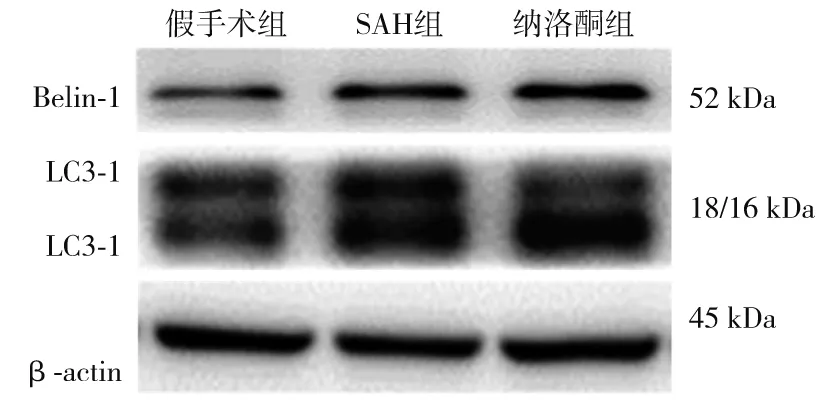
图4 各组大鼠海马区Beclin-1、LC3-Ⅱ蛋白电泳图

表2 各组大鼠海马区自噬相关蛋白Beclin-1、LC3-Ⅱ阳性细胞数目及蛋白表达
3 讨论
各种病因引发颅内血管破裂是导致SAH的主要原因,大部分患者为颅内动脉瘤破裂所致。SAH发生后会出现全脑组织供血供氧的减少[5]、微循环结构和功能的破坏[6]以及血细胞崩解后毒性物质的释放[7],在这些因素的作用下会出现血脑屏障通透性增加、脑细胞能量代谢障碍、氧化应激加剧以及炎症反应增强等损害性结果的发生,最终导致脑组织水肿、颅内压增高及脑血管痉挛等[8],属于严重的脑血管疾病之一,具有较高的致死率[9]。大部分存活下来的患者存在一定的神经损伤及神经功能障碍。近年来,随着医疗技术不断发展,药物治疗、手术治疗等治疗方法的不断改进,SAH的病情能够得到有效控制,但远期神经学结果仍未取得显著改善[10,11]。因此,明确SAH发病后的损伤机制,减少神经功能损害,是临床急需解决的问题[12,13]。
纳洛酮属于羟二氢吗啡酮衍生物,为特异性阿片受体拮抗药物,本身不具有激动阿片受体活性[14,15]。纳洛酮能够解除类阿片药物过量中毒和全麻术后持续的呼吸抑制[16,17]。研究[18,19]显示,纳洛酮能够与中枢神经系统3种阿片受体结合形成特异性拮抗,减轻β-内啡肽和强啡肽等对脑组织的损伤,促进神经功能恢复。研究报道显示,纳洛酮对SAH患者具有脑保护作用,但相关机制尚不明确。本实验采取颅内动脉穿刺法造模,同时给予纳洛酮干预。穿梭箱实验结果显示,与假手术组相比,SAH组逃到安全区时间延长、逃到安全区次数减少;与SAH组相比,纳洛酮组逃到安全区时间缩短、逃到安全区次数增多,表明纳洛酮能够有效保护SAH后大鼠的学习记忆。HE染色结果显示,与假手术组相比,SAH组海马CA1区神经细胞形态和结构很多出现异常,胞核梭形固缩、深染情况明显增多,并有核破碎及溶解现象;与SAH组相比,纳洛酮组异常形态和结构的细胞明显减少,说明纳洛酮注射液能够减轻SAH对神经细胞形态结构的损害。
目前对SAH损伤机制研究的结果显示,自噬参与到SAH后的病理进程中。自噬是真核细胞内特有的一种自我保护机制[20],借助自噬机体能够及时有效地降解细胞内功能不良或无功能的细胞器及有害物质,并能够为细胞供应所需的物质,以合成机体所需的蛋白质或协助完成相应细胞器的代谢,进而稳定细胞的内环境并避免细胞发生破碎[21]。但是自噬也具有双面性,在一定程度上发生的自噬能够有效稳定内环境、降低死亡细胞的数量、最大程度维护机体功能[22],但自噬反应过于强烈或明显不足,就会导致内环境稳态遭到破坏,死亡细胞数量明显上升,进而损害机体的一系列功能[23]。目前,自噬在脑缺血性疾病、心脏疾病及帕金森等多种疾病的病理过程中有着较为深入的研究[24,25]。但在SAH中,自噬的作用机制研究还仍处于开始阶段[26,27]。有学者发现,给予不良刺激诱导组织细胞发生自噬后6 h就能检测出自噬标志蛋白Beclin-1及LC3的表达,24 h达到峰值,72 h的自噬标志蛋白检测结果在统计学上仍有意义。本实验取细胞自噬后24 h为时间节点,结果显示SAH组Beclin-1、LC3-Ⅱ阳性细胞数目及Beclin-1、LC3-Ⅱ蛋白表达均高于假手术组,而纳洛酮组高于SAH组,表明纳洛酮可以增强SAH大鼠脑细胞自噬。
综上所述,纳洛酮能够改善大鼠的学习记忆能力,增强SAH大鼠海马区神经细胞自噬,有效稳定SAH大鼠海马区神经细胞的形态结构,提高正常神经细胞数量。但本次实验未能进一步探讨纳洛酮对SAH大鼠海马区神经细胞自噬的具体作用机制,有待深入研究。
