小鼠脑出血后继发性脑损伤调节因子Lpar1 mRNA和miR-200b的筛选、靶向关系预测验证
2020-10-14侯小红周桂银向成明樊银春姚声涛
侯小红,周桂银,向成明,樊银春,姚声涛
遵义医科大学附属医院,贵州遵义563000
脑出血(ICH)是神经外科常见的脑血管疾病,是一种破坏性的脑卒中亚型,致死率、致残率高,同时伴有不同程度的神经功能障碍[1~3]。在我国,ICH呈逐年上升的趋势,常见于40~70岁中老年患者[4]。ICH确切病因目前尚不清楚,研究发现与原发性高血压、动脉粥样硬化及血管畸形等因素紧密相关,ICH后脑损伤和患者不良预后密切相关,给社会、家庭带来极大经济负担。ICH后脑损伤机制复杂,其中包括最初的物理损伤和血肿的占位效应所引起的原发性脑损伤,以及氧化应激、炎症反应及细胞毒性损伤等病理生理反应造成血脑屏障的破坏、脑水肿和神经细胞的死亡为特征的继发性脑损伤。现已证实,多种炎症反应都存在于ICH后的继发性损伤中,而小胶质细胞在继发性损伤中扮演重要的角色[5, 6]。小胶质细胞是中枢神经系统重要的免疫细胞,主要极化为M1、M2型, M1型小胶质细胞主要可以分泌IL-1β、IL-6、TNF-α等促炎因子而发挥促炎作用, M2型小胶质细胞可以分泌TGF-β、IL-10等抑炎因子发挥抑炎作用,恢复体内平衡[7, 8],在ICH后继发性脑损伤中发挥着关键作用。影响小胶质细胞分泌炎症因子的因素众多,其中非编码RNA中的miRNA占据关键一环,在多种疾病的发生发展、病理、生理中扮演着重要作用,但是miRNA在ICH中的研究尚少。2019年4~5月,我们通过C57小鼠建立ICH模型,对ICH小鼠及假手术小鼠进行全转录组测序分析,筛选两种小鼠中差异表达的mRNA、miRNA,并筛选出关键基因溶血磷脂酸受体1(Lpar1)及其上游靶基因miR-200b,进一步在ICH小鼠及LPS处理的小胶质细胞中观察Lpar1 mRNA、miR-200b的相对表达量,以验证筛选结果,同时观察了miR-200b对炎性因子的影响。
1 材料与方法
1.1 材料 实验动物及细胞:C57无特定病原体级健康雄性小鼠18只,体质量20~25 g,由重庆腾鑫生物技术有限公司提供。所有小鼠分笼饲养在通风良好的恒温环境,水和食物充足。数据库:STRING数据库、CTD数据库(http://ctdbase.org/)、TargetScan(http://www.targetscan.org/vert_72/)和miRDB(http://mirdb.org/)。小鼠小胶质细胞系(BV-2)细胞从上海生科院细胞资源中心购买。试剂及仪器:MEM培养基购自武汉普诺赛公司,脂多糖(LPS)购自美国Sigma公司,胎牛血清购自美国Gibco公司,丙酮酸钠购自北京索莱宝公司,由上海生工完成相关引物的设计与合成,实时荧光定量聚合酶链反应(qPCR)购自日本TaKaRa公司,Ⅶ型胶原酶购自美国Sigma公司。小动物立体定向注射仪购自德国莱卡公司。
1.2 ICH模型的建立及分组 将小鼠按照简单随机法分为假手术组(Sham组)6只、ICH组12只,其中3只Sham组小鼠和3只ICH组小鼠用于全转录组测序,其余小鼠用于表达验证。
取10~12周龄雄性C57成年小鼠,3.5%水合氯醛按10 mL/kg腹腔注射麻醉后,暴露颅骨和前囟;于前囟后约0.2 mm,中线右旁开2.5 mm,用注射器针头钻一直径约0.5 mm的圆形骨窗,不损伤硬脑膜,微量注射器针头沿骨窗垂直进针,深度约4.0 mm,缓慢均速推注胶原酶0.5 μL,整个注射过程10 min内完成,注射完毕后停针10 min,再缓慢退出微量注射器针头,再次消毒皮肤后缝合切口。假手术组只进针,不注射胶原酶,操作步骤同ICH组。
1.3 ICH组及Sham组小鼠差异表达基因、ICH后脑损伤相关关键基因及miRNA的筛选 取3只Sham组小鼠和3只ICH组小鼠处理侧基底节区脑组织通过二代测序方法进行全转录组测序分析。R软件对测序的mRNA和miRNA进行筛选,筛选出差异表达的基因(DEGs),并将DEGs通过相应的热图和火山图可视化,筛选条件为LogFC绝对值>1,P<0.05。采用STRING数据库对上调差异表达的mRNA进行蛋白-蛋白相互作用网络(PPI)构建,物种选择人,相互作用关系置信度大于0.4。利用“MODE”插件查找关键基因簇并确定感兴趣的关键基因,得到ICH相关关键基因为Lpar1。同时在Comparative Toxicogenomics Database(CTD)数据库(http://ctdbase.org/)中预测关键基因与神经系统疾病的相关性。
对差异表达的miRNA与Lpar1做Person相关性分析,条件为P<0.05,相关系数绝对值≥0.5。同时利用TargetScan(http://www.targetscan.org/vert_72/)、miRDB(http://mirdb.org/)数据库预测Lpar1可能的上游miRNA, 最终将与Lpar1呈负相关的miRNA取交集。选出Lpar1上游可能结合的靶向miRNA为miR-200b
1.4 ICH小鼠基底节区脑组织及LPS诱导的小胶质细胞中Lpar1 mRNA、miR-200b的检测 分别于建模后第1、3、7天采用实时荧光定量PCR(qPCR)检测Sham组、ICH组基底节区脑组织Lpar1和miR-200b,根据说明书进行加样,每组设3~4个复孔;以U6为内参,采用miRNA相对定量,即2-ΔΔCt方法计算靶基因相对表达量。PCR引物序列见表1。分别用PBS(2 mL)、LPS(100 μg/mL)刺激BV-2细胞48 h,采用qPCR检测Lpar1和miR-200b。

表1 受检基因的PCR引物序列
1.5 转染miR-200b模拟物的BV-2小胶质细胞中Lpar1 mRNA和炎症因子的检测 将BV-2细胞接种于完全培养基(89 mL MEM培养基+9 mL胎牛血清+1 mL双抗+1 mL丙酮酸钠)中,分为miR-200b对照组和miR-200b过表达组,每组3个复孔,在37 ℃、5%CO2培养箱中进行培养。将1~5×105个细胞接种在6孔板中,使转染时的细胞密度能达到30%~50%;miR-200b过表达组将稀释好的miR-200b模拟物加入板中,miR-200b对照组不加任何物质。随后将培养板置于37 ℃ CO2培养箱中继续培养48 h,通过qPCR检测转染效果,并检测Lpar1 mRNA和炎症因子(IL-6、IL-1β和TNF-α)。PCR引物序列见表1。检测方法同1.4。
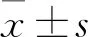
2 结果
2.1 Lpar1、miR-200b的获取 两组共得到869个差异表达mRNA和106个差异表达的miRNA, 包括545个下调mRNA和424上调mRNA,55个下调miRNA和51上调miRNA。利用上调差异表达的mRNA构建的蛋白互作网络中共153个相互作用蛋白,235个蛋白间相互作用关系,区域蛋白聚类指数为0.71,蛋白相互作用关系显著(P<0.05),Lpar1是关键基因之一见图1,也作为本次研究感兴趣的基因,与ICH密切相关,见图2。通过两数据库的上游预测,分别得到693个和96个miRNA可能与Lpar1靶向结合,通过相关性分析,得到22个与Lpar1呈正/负相关关系的miRNA,见图3,与负相关的miRNA取交集后得到miR-200b。
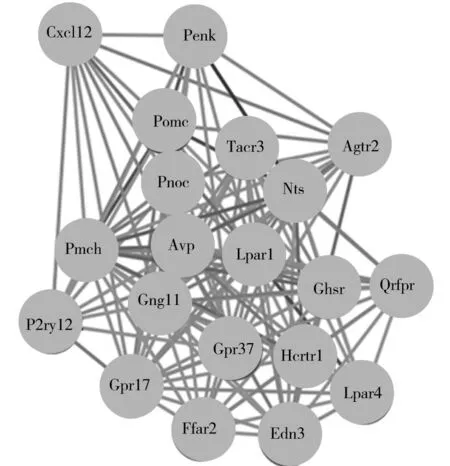
图1 上调差异表达mRNA的PPI中关键基因簇
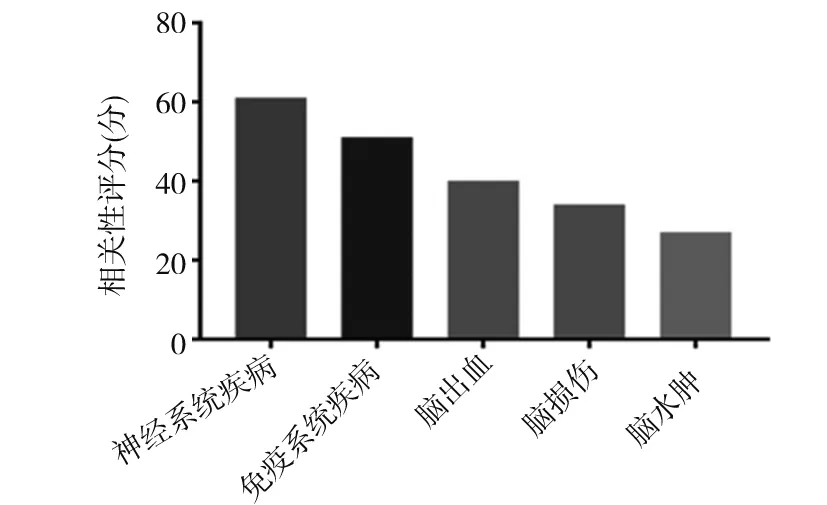
图2 CTD数据库中预测的Lpar1基因与神经系统疾病的相关性

图3 Lpar1与差异表达miRNA相关性网络图
2.2 Lpar1、miR-200b在ICH 小鼠及LPS诱导的小胶质细胞中的表达 ICH组建模后第1、3、7天Lpar1 mRNA相对表达量分别为2.05±0.12、2.97±0.11、2.96±0.09,miR-200b相对表达量分别为0.52±0.07、0.38±0.06、0.40±0.04;Sham组Lpar1 mRNA、miR-200b相对表达量分别为1.01±0.05、1.03±0.09。与Sham组比较,ICH组各时间点Lpar1 mRNA相对表达量升高,miR-200b相对表达量降低(P均<0.05)。
LPS诱导的小胶质细胞中Lpar1 mRNA、miR-200b相对表达量分别为2.93±0.38、0.55±0.06,加入PBS后的小胶质细胞中Lpar1 mRNA、miR-200b相对表达量分别为1±0.19、1±0.05,两种细胞Lpar1 mRNA、miR-200b相对表达量比较,P均<0.05。
2.3 miR-200b过表达组及miR-200b对照组 Lpar1 mRNA、炎症因子表达比较 与miR-200b对照组比较,miR-200b过表达组Lpar1 mRNA、IL-6 mRNA、IL-1β mRNA、TNF-α mRNA相对表达量降低(P均<0.05),见表1。

表1 miR-200b过表达组及对照组 Lpar1 mRNA、炎症因子相对表达量比较
3 讨论
ICH是一种常见的破坏性脑血管疾病,ICH后继发性脑损伤是预后不良的因素[9],其发生涉及多种机制,研究[10, 11]发现miRNA是其中影响继发性脑损伤重要因素。近年来,非编码RNA的研究备受关注,在人类的所有基因中,非编码基因约占98%,在我们对非编码基因的研究探讨中发现,非编码基因在多种疾病的发生发展、病理、生理中起重要作用。miRNA是一种内源基因编码的非编码单链RNA,长度约22个核苷酸。
本研究我们通过高通量测序联合生物信息学分析,最终确定本研究的基因Lpar1和miR-200b。测序数据结果显示miR-200b在小鼠ICH组中表达下调,而Lpar1表达上调,表达呈负相关关系,这一结果在本次研究中得到了验证。 在Lpar1与疾病的相关性分析中,发现Lpar1与免疫系统疾病、ICH、脑水肿、脑损伤都具有很大的相关性,表明Lpar1可能是神经系统疾病的关键基因。神经系统疾病中G蛋白偶联受体和小胶质细胞关系密切,G蛋白家族中成员可通过影响G蛋白偶联受体的活化状态影响小胶质细胞的极化,从而调节神经系统的炎症反应[12,13],Lpar1来自EDG受体,是G蛋白偶联受体超家族的成员,具有由六个不同的G蛋白偶联受体(LPAR1-6)作为细胞外信号转导分子的能力,是脑发育和神经系统功能所必需[14]。研究发现LPA相对表达量增加可促进小胶质细胞迁移反应,从而增加炎症反应[8]。本研究中,Lpar1在小鼠脑出血和LPS诱导的小胶质细胞模型中高表达,与既往在神经系统中的研究结果一致,表明Lpar1可能是ICH继发性炎症反应的关键调节因子。
miRNA与mRNA的3′UTR区靶向结合可使靶基因表达沉默或翻译受抑制,最终影响疾病的发展[15,16]。Wen等[17]在对脑梗死研究中,发现miR-200b的表达可影响小胶质细胞的活化,进而影响脑水肿程度及神经炎症反应。Jadhav等[18]在对神经系统炎症反应的研究中,发现miR-200b的过表达可通过MAPK信号通路抑制神经炎症反应。本研究发现,miR-200b在小鼠ICH模型和LPS处理的小胶质细胞模型中都表现为低表达,这一结果与文献报道结果相符,进一步在LPS诱导的小胶质细胞模型中过表达后发现可抑制促炎因子IL-6,IL-1β和TNF-α释放,结合以上结果,我们推测在ICH后,miR-200b表达下降减轻对Lpar1的表达抑制,促使Lpar1表达上调,进而促进促炎因子释放,加重ICH继发性炎症反应,但具体机制需进一步研究探索。
综上所述,相比Sham组小鼠,ICH组小鼠mRNA有545个下调和424个上调,miRNA 有55个下调和51个上调。在ICH组小鼠及LPS处理的小胶质细胞中,关键基因Lpar1高表达、miR-200b低表达,miR-200b可抑制小胶质细胞炎症反应。Lpar1、miR-200b可能是ICH后继发性炎症反应的关键调节因子,并可能成为将来ICH潜在的治疗靶点。
