免疫抑制剂治疗对阿尔茨海默病大鼠海马自噬蛋白Beclin-1和LC3表达的影响*
2020-10-13王晓平李晓佳
王晓平, 黄 斌, 马 帅, 黄 睿, 李晓佳
四川省人民医院神经内科,成都 610072
阿尔茨海默病(Alzheimer’s disease,AD)是最常见的神经退行性疾病,以渐进性的认知功能障碍及行为损害为典型的临床特征[1-2]。目前对阿尔茨海默病尚无特效治疗药物。临床有采用免疫抑制剂治疗阿尔茨海默病的报道,且取得一定疗效。免疫抑制剂中较为典型的是吗替麦考酚酯(mycophenolate mofetil),但免疫抑制剂治疗阿尔茨海默病的机理仍不明确[3]。报道显示自噬活性降低是阿尔茨海默病的特点之一,自噬通路相关蛋白中研究较为明确的是微管相关蛋白1轻链3(microtubule associated protein 1 light chain 3,LC3)与Beclin-1蛋白,2种蛋白在阿尔茨海默病患者脑内呈低表达[4-5],吗替麦考酚酯治疗阿尔茨海默病对自噬是否存在影响,较少报道。本研究制备阿尔茨海默病大鼠模型,观察免疫抑制剂治疗对阿尔茨海默病的疗效及对2种自噬蛋白表达的影响,现将结果报道如下。
1 材料与方法
1.1 实验动物
雄性SD大鼠,体质量(250±30)g,购于北京军事医学科学院实验动物中心,合格证号:SCXK-(军)2012-0004。温度(25±5)℃,相对湿度(40±10)%下,所有大鼠适应性饲养1周后进行实验。
1.2 受试药、仪器和试剂
吗替麦考酚酯胶囊(无锡福祈制药有限公司,国药准字:H20080642,规格:0.25 g/片,以C23H31NO7计);多奈哌齐片[卫材(中国)药业有限公司,国药准字:H20050978,规格:5 mg/片];DW-5型大鼠脑立体定位仪(成都泰盟科技有限公司);Morris水迷宫(中国医学科学院药物研究所);FluoView FV1200激光共聚焦显微镜(日本Olympus公司);ChemiDocTMXRS+凝胶成像系统(美国Bio-Rad公司);兔抗鼠LC3、Beclin-1和β-actin(美国Abcam公司);Aβ25-35(美国Sigma公司)。
1.3 制备阿尔茨海默病大鼠模型、分组及给药
采用戊巴比妥钠腹腔麻醉大鼠,将头部固定在立体定位仪上,剪开头部皮肤,暴露颅骨,定位前囟,于前囟后1.5 mm及旁开0.8 mm定位侧脑室,颅骨钻钻孔,骨窗直径约2 mm,将2 μL凝聚态Aβ25-35以微量注射器缓慢进针,深度4 mm,回退1 mm,缓慢注射5 min,留针5 min,退针并缝合皮肤,碘伏消毒皮肤。对照组在侧脑室注射生理盐水2 μL,注射方式同前。存活大鼠用于实验。将制备的阿尔茨海默病大鼠随机分为4组:模型组、吗替麦考酚酯高剂量组、吗替麦考酚酯低剂量组和阳性药组,每组10只。除对照组和模型组给予生理盐水,吗替麦考酚酯高剂量组(0.8 g/kg)、吗替麦考酚酯低剂量组(0.4 g/kg)和阳性药组(多奈哌齐0.5 mg/kg)在大鼠清醒后给药,所有大鼠均连续灌胃给药4周。
1.4 识别实验
不透明检测箱,规格80 cm×60 cm×60 cm,将大鼠进行3个阶段的训练:适应阶段、训练阶段与检测阶段。适应阶段:将大鼠置于无任何物体的检测箱内,自由活动5 min,放回笼中;24 h后进入训练阶段:在检测箱内放置2个相同的物体,将大鼠背对2物体置于检测箱内,大鼠熟悉2个物体,10 min后,取出大鼠;24 h后进入检测阶段:将检测箱内的2物体中的1个换为不同形状的新物体,将大鼠再次放入检测箱内5 min,记录大鼠用鼻子凑近新物体≤ 1 cm的范围或舔咬或用身体擦蹭新物体的时间,即为大鼠对新物体和旧物体的探索时间。以识别指数(discrimination index,DI)来评价大鼠对2个不同测试物体的探索时间,计算公式:DI=(N-F)/(N + F)×100%,N:大鼠探索新物体所耗费的时间,F:大鼠探索熟悉物体所耗费的时间。每次每只大鼠放入检测箱后,都用75%乙醇溶液擦拭检测箱和2个物体。
1.5 水迷宫实验
水迷宫桶内注入温度(24±2)℃的清水,水面高于平台2 cm,滴加蓝黑墨水,排除视觉干扰。于水桶上缘,等距离划分4个入水点,将大鼠面向池壁从其中一个入水点放入水中,记录大鼠游到平台并站在平台的时间,即为逃避潜伏期,若寻找平台时间超过120 s,记录逃避潜伏期记为120 s,放回笼中。每天每只大鼠记录逃避潜伏期1次,连续5 d,记录5 d的逃避潜伏期及5 d的游泳距离,取均值。第6天撤去平台,任选一个入水点将大鼠置于水中,记录大鼠60 s内穿越原平台位置的次数,用以检测大鼠对原平台的记忆。
1.6 Tunel染色
行为学实验结束后,大鼠断头取脑,冰上分离海马组织并提取蛋白,剩余的脑组织采用水合氯醛固定,经30%蔗糖沉降48 h后,用振动切片机制备30 μm小脑组织切片,用于Tunel染色,光镜下观察小脑细胞凋亡情况。
1.7 Western blot检测
取“1.6 Tunel染色”项下从海马组织提取的蛋白行Western blot检测,制胶、上样、电泳、转膜、封闭、孵LC3和Beclin-1一抗,工作浓度均为1∶1000,内参为β-actin(工作浓度为1∶200),过夜、二抗室温1 h,将膜置于凝胶成像仪中,加入ECL发光剂,曝光显影,采用Image J软件分析LC3和Beclin-1蛋白表达情况。
1.8 统计学处理
采用SPSS 19.0软件对数据进行分析,识别实验指标及水迷宫指标等计量资料以“均数±标准差”表示,各组均数比较采用单因素方差分析,组间均数比较采用LSD-t检验,以P<0.05为差异有统计学意义。
2 结果
2.1 各组大鼠的识别指数、潜伏期、游泳距离及穿环次数比较
与对照组比较,模型组的识别指数和穿环次数明显降低(均P<0.05),潜伏期和游泳距离明显增高(均P<0.05);与模型组比较,吗替麦考酚酯低剂量组、高剂量组和阳性药组的识别指数和穿环次数明显增高(均P<0.05),潜伏期和游泳距离明显降低(均P<0.05),见表1。

表1 各组大鼠的识别指数、潜伏期、游泳距离及穿环次数比较Table 1 Comparison of recognition index,latency,swimming distance and frequency of piercing cycles of rats in each
2.2 各组大鼠的小脑神经细胞凋亡情况
镜下显示,凋亡的小脑神经细胞呈棕色。与对照组比较,模型组凋亡的小脑神经细胞明显增多;与模型组比较,吗替麦考酚酯低剂量组、高剂量组和阳性药组凋亡的小脑神经细胞有明显减少;免疫抑制组中,凋亡的小脑神经细胞呈剂量依赖性降低趋势。见图1。
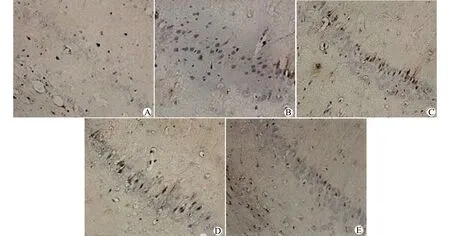
A:对照组;B:模型组;C:吗替麦考酚酯低剂量组;D:吗替麦考酚酯高剂量组;E:阳性药组图1 各组大鼠小脑神经细胞凋亡TUNEL染色(×200)Fig.1 Detection of cerebellar nerve cell apoptosis by Tunel staining in rats of each group(×200)
2.3 各组大鼠海马的自噬蛋白表达
与对照组比较,模型组大鼠海马的Beclin-1和LC3表达明显降低(均P<0.05);与模型组比较,吗替麦考酚酯低剂量组、高剂量组和阳性药组Beclin-1和LC3表达明显增高(均P<0.05),且吗替麦考酚酯低剂量组、高剂量组存在剂量依赖性趋势,见表2和图2。

表2 各组大鼠海马的自噬蛋白表达Table 2 Expression of autophagy protein in hippocampus of rats in each

1:对照组;2:模型组;3:吗替麦考酚酯低剂量组;4:吗替麦考酚酯高剂量组;5:阳性药组图2 各组大鼠海马Beclin-1和LC3表达Fig.2 Expression of Beclin-1 and LC3 in hippocampus of rats in each group
3 讨论
本研究通过侧脑室注射Aβ25-35制作阿尔茨海默病大鼠模型,分别采用识别实验及水迷宫实验检测阿尔茨海默病大鼠的学习记忆能力,结果显示与进行假手术的对照组大鼠比,阿尔茨海默病大鼠的学习记忆能力显著降低,表现出明显的认知障碍,表明阿尔茨海默病大鼠模型可用于研究。
自噬是一种存在于真核细胞中的细胞代谢现象,通过降解错误折叠及老化的蛋白质,维持细胞内代谢环境稳定。但自噬过度或自噬损伤等自噬异常时反而对细胞功能带来不利影响。大量研究显示,自噬异常间接地为有害物质损伤神经提供了保护,因此自噬异常参与了很多神经系统疾病的发生发展过程,如阿尔茨海默病、帕金森症及亨廷顿病。阿尔茨海默病重要的神经病理特点之一是大脑存在显著Aβ蛋白沉积,且Aβ蛋白积聚程度与阿尔茨海默病的严重程度紧密关联[6-8]。研究显示阿尔茨海默病患者及阿尔茨海默病动物模型脑组织中可编码Beclin-1蛋白的Beclin-1基因含量降低,Beclin-1基因转录减少及其蛋白表达缺失,致使自噬水平及活性降低,自噬体形成减少,Aβ蛋白生成而不被降解,形成异常沉积,最终导致阿尔茨海默病。可见Beclin-1减少与自噬缺陷及阿尔茨海默病发病紧密关联[9-11]。LC3是定位于自噬泡内膜的自噬调节蛋白,细胞启动自噬,LC3前体被加工为LC3-Ⅰ并溶在细胞质内,LC3-Ⅰ与自噬泡膜表面的磷脂酰乙醇胺结合生成LC3-Ⅱ,并定位于自噬泡膜,发挥调节功能,故LC3蛋白表达可直接反映细胞自噬活性[12-13]。本研究结果显示,与对照组比较,阿尔茨海默病模型大鼠海马的Beclin-1和LC3蛋白表达明显降低,提示阿尔茨海默病大鼠海马组织的自噬功能或活性降低,与报道结果类似。
吗替麦考酚酯属于免疫抑制剂,药代动力学显示,吗替麦考酚酯属于前体药物,进入人体后水解为霉酚酸而发挥免疫抑制的功效。有研究报道采用吗替麦考酚酯可有效地控制阿尔茨海默病病情的进一步发展[14]。本研究结果显示,给予阿尔茨海默病大鼠吗替麦考酚酯连续4周,大鼠的识别实验及水迷宫实验均获得较好的结果,且存在吗替麦考酚酯剂量依赖性关系,提示吗替麦考酚酯具有改善阿尔茨海默病大鼠认知障碍的效果。
通过进一步检测吗替麦考酚酯对大鼠小脑凋亡细胞及海马自噬蛋白表达的结果显示,与阿尔茨海默病模型大鼠比较,吗替麦考酚酯可缓解大鼠小脑细胞凋亡,增高阿尔茨海默病大鼠海马Beclin-1和LC3蛋白表达,提示吗替麦考酚酯有助于提高阿尔茨海默病大鼠在海马区的自噬活性。报道显示,Aβ蛋白积聚可促使炎症反应,脑内的小胶质细胞及星形胶质细胞可被激活,参与体内某种免疫应答反应,分泌大量的炎性因子,如白介素-6(interleukin-6,IL-6)和干扰素(interferon-γ,IFN-γ),进而介导神经炎性反应[15-16],导致阿尔茨海默病发生发展。吗替麦考酚酯可抑制小胶质细胞的活性[17],小胶质细胞活性与Beclin-1和LC3蛋白表达呈负相关关系。我们在实验中观察到吗替麦考酚酯对Beclin-1和LC3蛋白表达的干预效果可能与抑制小胶质细胞有关。但吗替麦考酚酯对Beclin-1和LC3蛋白表达的干预机制仍需更多的进一步实验研究。
综上所述,吗替麦考酚酯可以改善阿尔茨海默病大鼠的学习认知能力,其机制可能与增强自噬水平和提高自噬蛋白Beclin-1和LC3表达相关,具体作用机制仍需进一步研究。
