关节软骨细胞与CD105阳性滑膜间充质干细胞共培养并促进其成软骨分化*
2020-10-13王鹏程胡海清
张 松, 王鹏程, 胡海清
1武汉大学附属同仁医院(武汉市第三医院)骨科,武汉 430060 2武汉大学中南医院急救中心,武汉 430071
创伤、退行性病变等各种原因都易造成软骨损伤。软骨的再生修复能力很差,损伤后的缺损一般通过瘢痕增生修复,从而失去原有的形态功能。组织工程学的兴起、研究和进展为此治疗提供了可能[1]。
种子细胞是组织工程的研究基础之一,既往的研究曾选用自体软骨细胞或骨髓间充质干细胞,但因它们存在获取困难、易老化、丢失表型等缺点,应用比较困难[2-3]。相比之下,滑膜间充质干细胞(SMSC)是近年来兴起的一种细胞。因其来源容易(可从关节镜手术中大量取得),体外易于扩增,成软骨分化能力很强,使其在软骨组织工程中的应用逐渐受到青睐。然而,因它是滑膜细胞来源,在分化过程中可能伴随着炎症反应。CD105是转化生长因子-β3(TGF-β3)的受体,既往的研究报道证实,经过磁珠分选(MACS)所得的CD105+SMSC具有更强的成软骨能力[4]。
组织工程学研究中,使用间接共培养培养细胞,可研究细胞之间通过外分泌的相互作用。软骨细胞在培养时,为维持其表型可分泌TGF-β3。而在SMSC成软骨分化过程中,TGF-β3也是必不可少的[5]。
本研究拟使用Transwell小室进行CD105+SMSC和关节软骨细胞(ACC)共培养,探索共培养条件下ACC促进CD105+SMSC成软骨的能力,以及在此过程中炎症反应的情况,并为进一步研究其作用的分子机制和体内实验等提供依据。
1 材料与方法
1.1 实验材料
4周龄清洁级SD大鼠,雄性,体质量60 g左右[武汉大学动物实验中心,许可证号:SCXK(鄂)2008-0004]。双抗(青霉素+链霉素)(武汉博士德公司),PBS(Hyclone公司),0.25%胰蛋白酶(不含EDTA)(Gibco公司),0.25%胰蛋白酶(含0.05%EDTA)(Gibco公司),Ⅱ型胶原酶(Biosharp公司),40 μm细胞滤器(BD公司),胎牛血清(FBS)(Gibco公司),DMEM/F12 1∶1培养液(Hyclone公司),间充质干细胞成骨诱导培养液、成软骨诱导培养液、成脂诱导培养液(赛业公司),CD105兔抗大鼠多克隆抗体(Abcam公司),羊抗兔Microbead IgG和MS分选柱(美天旎公司),牛血清白蛋白(BSA)(博士德公司),羊抗兔cy3荧光抗体(CST公司),抗荧光淬灭封片剂(博士德公司),FITC流式抗体(三鹰公司),甲苯胺蓝染液(谷歌生物公司),引物合成(Invitrogen公司),细胞RNA小量提取试剂盒(Omega公司),逆转录试剂盒(Toyobo公司),SYBR Green(Toyobo公司),DEPC(Sigma公司),Transwell小室(康宁公司)。
1.2 SMSC细胞培养、分选、鉴定
1.2.1 SMSC细胞分离 SD大鼠经颈椎脱臼处死后,浸泡于75%乙醇10 min消毒,无菌条件下取膝关节髌上囊内侧滑膜组织,以预冷预加1%双抗的灭菌PBS冲洗干净,剪除肉眼可见的脂肪和结缔组织,将分离出的滑膜组织剪成约1 mm3大小的碎块。加入0.25%胰蛋白酶(不含EDTA)并置于37℃培养箱中消化30 min,离心弃上清液,用0.1%Ⅱ型胶原酶于37℃,5%CO2培养箱中消化4 h,40 μm细胞滤器过滤,1000 r/min×8 min离心弃上清。用含有10%FBS的DMEM/F12 1∶1重悬后计数,培养瓶中接种培养。观察细胞形态,每2~3天换液1次。倒置显微镜观察细胞生长及形态,至90%左右融合,以0.25%胰蛋白酶(含0.05%EDTA)消化后按1∶3比例进行传代。取传代培养的第3代SMSC备用[4]。
1.2.2 SMSC的诱导 分化成骨诱导:使用成骨诱导培养液对平面培养的第3代SMSC进行诱导培养,完成后用茜素红染色鉴定。成脂诱导:使用成脂诱导培养液对平面培养的第3代SMSC进行诱导培养,完成后用油红O染色,对脂滴染色鉴定。成软骨诱导:使用成软骨诱导培养液对Pellet培养的第3代SMSC诱导培养,培养完成后,取出Pellet小团,经固定、脱水、干燥、石蜡包埋后切片,使用阿利新蓝染色进行鉴定。
1.2.3 SMSC的磁珠分选 用0.25%胰蛋白酶(含0.05%EDTA)消化细胞制成细胞悬液,离心1000 r/min ×5 min后弃上清,使用兔多抗CD105(1∶100)于37℃培养箱孵育15 min,离心1000 r/min ×5 min后弃上清,并用PBS洗涤2次以去除未结合的一抗。计数后按每107个细胞对应20 μL羊抗兔Microbead IgG的比例,于37℃培养箱孵育15 min。使用配套的分选设备和MS分选柱进行细胞分选,所得洗脱的细胞即为CD105+SMSC。
1.2.4 免疫荧光鉴定 使用免疫荧光鉴定分选的细胞,将分选所得的细胞培养传代至12孔板内细胞爬片,使用4%多聚甲醛在4℃固定30 min,然后PBS洗涤3次,每次5 min,然后在常温下用0.1%Triton-X100处理20 min,经BSA封闭1 h后,孵育CD105兔多抗过夜。次日室温下孵育羊抗兔cy3二抗1 h,PBS洗涤后用抗荧光淬灭封片液封片,置于盖玻片上,荧光显微镜观察结果。
1.2.5 流式细胞学鉴定 收集培养的对数期CD105+SMSC,0.25%胰蛋白酶(含0.05%EDTA)消化后计数,重悬后以1000 r/min离心5 min,弃上清后加入CD105抗体和FITC标记的流式抗体,经孵育、固定后上机检测。
1.3 ACC细胞培养和鉴定
1.3.1 ACC细胞分离 培养大鼠用颈椎脱臼法处死,75%乙醇消毒10 min,在超净台中无菌条件下用手术刀片切取双侧膝关节胫骨平台软骨,放入预冷的预加1%双抗的灭菌PBS中洗2~3次。把软骨组织用显微剪切成约1 mm3的碎块,收集后加入0.25%的胰蛋白酶5 mL;放置于37℃细胞培养箱中消化30 min,离心1000 r/min×5 min后弃去胰酶;加入5 mL PBS洗涤2次,离心1000 r/min×5 min后弃上清。使用0.1%的Ⅱ型胶原酶5 mL重悬后置入25 cm2培养瓶,放于37℃细胞培养箱中孵育过夜,使用40 μm细胞滤器滤去未消化的软骨组织,过滤的液体以1000 r/min离心8 min,轻轻弃去上清液,加入5 mL含有10% FBS和1%双抗的DMEM/F12 1∶1完全培养液,混合后于25 cm2培养瓶中培养,每3天换液。倒置显微镜观察软骨细胞生长情况。长到90%左右融合即可进行传代。取传代培养的第3代软骨细胞备用[6]。
1.3.2 软骨细胞的甲苯胺蓝染色 软骨细胞传代后,按105/孔加至12孔板爬片中,使用4%多聚甲醛在常温固定30 min,PBS洗涤3次,每次5 min,在常温下甲苯胺蓝染液染色30 min,PBS洗涤3次后用乙醇梯度脱水,风干后中性树胶封片,显微镜观察及拍照保存。
1.4 Transwell小室间接共培养
使用Transwell小室(6孔,0.4 μm)(康宁,3450)进行CD105+SMSC和ACC的共培养,其中上室内为CD105+SMSC,下室内为ACC,各孔的细胞数目见实验分组(表1),另设置CD105+SMSC +成软骨诱导培养液(CCM)和单独平面培养的CD105+SMSC两组,分别记作CCM组和对照组。每间隔2~3 d换液1次,共14 d。
1.5 RNA提取和实时荧光定量PCR检测
培养14 d后收集各组细胞,用RNA小量提取试剂盒提取总RNA,Nanodrop定量检测RNA的浓度及纯度,逆转录成cDNA,使用实时荧光定量PCR分析各基因的表达量,以GAPDH作为内参校正,以熔解曲线单峰判断特异性扩增。所使用仪器:荧光定量PCR仪(Bio-rad IQ5),反应条件:95℃预变性60 s,PCR反应40个循环,95℃变性15 s,60℃退火10 s,72℃延伸40 s,之后55℃熔解曲线分析。所使用的引物序列见表2。

表1 Transwell小室间接共培养实验分组(×104/mL)Table 1 Experimental grouping of Transwell indirect co-cultivation(×104/mL)

表2 所用引物序列Table 2 Sequences of primers
1.6 统计学分析

2 结果
2.1 SMSC形态观察和成骨、成脂、成软骨分化鉴定
光镜下可见滑膜间充质干细胞呈现梭形的成纤维状,为干细胞的标准形态(图1A);成骨诱导后,茜素红染色可见钙结节呈红色为阳性(图1B);成脂诱导后,油红O染色可见空泡状脂滴呈橘红色为阳性(图1C);Pellet培养的细胞经成软骨诱导培养后,所得细胞团脱水后切片,阿利新蓝染色呈蓝色为阳性(图1D)。

A:SMSC光镜形态(×200);B:SMSC成骨分化(茜素红染色,×200);C:SMSC成脂分化(油红O染色,×200);D:SMSC成软骨分化(阿利新蓝染色,×100)图1 SMSC形态观察和成骨、成脂、成软骨分化Fig.1 Microscopic observation,osteogenic,adipogenic and chondrogenic differentiation of SMSC
2.2 CD105+SMSC的光镜观察、免疫荧光和流式细胞学鉴定
光镜下可见经过磁珠分选和未经磁珠分选的细胞形态并没有显著差别(图2A和2B),使用CD105为一抗做免疫荧光,可以观察到分选后的细胞cy3荧光阳性(图2C),未分选为阴性(图2D),流式细胞学鉴定提示,分选后的细胞表面标记CD105阳性率占99.82%(图2E)。
2.3 ACC形态观察和甲苯胺蓝染色鉴定
光镜下可见软骨细胞形态均一,呈三角形、不规则多边形或铺路石样外观(图3A),甲苯胺蓝染色后可见软骨细胞分泌丰富的细胞外基质(图3B)。
2.4 共培养后的CD105+SMSC成软骨和炎症指标评价
共培养各组mRNA结果分析(图4):与对照组相比,CCM组的CD105+SMSC可见各成软骨指标的表达量均明显上升,ADAMTS-5和RUNX-2表达增高,MMP-3表达基本不变,MMP-13表达降低,差异有统计学意义(均P<0.05)。
与对照组相比,各成软骨指标表达量总体为升高趋势,但各种比例的组别之间不尽相同,对于Col2A1,于1∶1比例共培养时的表达量最高,但仍低于CCM组。对于Aggrecan,于2∶1比例共培养时候比例最高,与CCM相近。SOX-9基因和Aggrecan相似,在2∶1比例培养时最高。TGF-β3与上述3个指标较为不同,是在4∶1组的比例最高。炎症指标方面,与对照组相比,ADAMTS-5在各组均无明显下降,RUNX-2在4∶1,2∶1和1∶2组无明显下降,其余各组有下降趋势,而对于MMP-3和MMP-13,各组均有明显的下降趋势,差异均有统计学意义(均P<0.05)。

A:分选后SMSC光镜形态(×200);B:未分选SMSC光镜形态(×200);C:分选后SMSC免疫荧光,可见cy3荧光阳性(×200);D:未分选SMSC免疫荧光(×200);E:分选后SMSC流式细胞学鉴定图2 CD105+SMSC的光镜观察、免疫荧光和流式细胞学鉴定Fig.2 Identification of CD105+SMSC by microscopic observation,immunofluorescence and flow cytometry
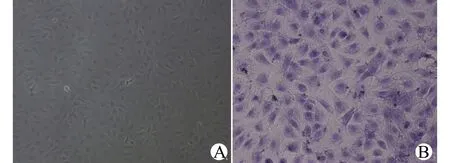
A:ACC光镜形态(×200);B:ACC甲苯胺蓝染色鉴定(×200)图3 ACC形态观察和甲苯胺蓝染色鉴定Fig.3 Microscopic observation and toluidine blue staining of ACC
3 讨论
目前,各种创伤和退变所导致的骨关节炎及软骨损伤、缺损类关节疾病在不断地增加,并严重影响着患者的生活质量。成熟的软骨组织自我修复能力很差,损伤后经常以瘢痕愈合的形式修复。形成的瘢痕组织缺乏弹性和组织结构特点,并不能达到原有的功能。因而最终会导致进一步的退变、缺损[7]。

与对照组比较,*P<0.05图4 各组成软骨指标与炎症指标表达情况Fig.4 Gene expression levels of chondrogenic and inflammation indicators
在针对病因治疗方面,虽然已经有很多相关研究,但至今并未取得逆转软骨退变等突破性进展。近年来组织工程技术的兴起与发展为此类疾病的治疗带来了新的治疗思路与希望,使用组织工程技术构建工程化软骨,用来替代受损的组织,可以达到治疗的目的[8]。
组织工程的三要素为支架、种子细胞和生长因子。基于之前的文献报道和我们的前期研究,我们选用了CD105+SMSC作为种子细胞。生长因子方面,TGF-β3可诱导其成软骨分化,但是细胞因子价格昂贵且不易保存从而限制了其使用范围,而如果使用质粒转染或病毒转染等方法,又常受其载体毒性、效率所限制。
常用的间接共培养技术即通过滤膜将2种细胞分隔开,滤膜的孔径不允许细胞通过,而细胞培养液上清液中的细胞因子等成分可以通过。软骨细胞在体外分泌的过程中,为了维持自身表型会分泌一些细胞因子,如胰岛素样生长因子-1(IGF-1)、TGF-β3等,因此我们推测,将这二者共培养,在共培养体系中,软骨细胞可能通过分泌这些因子而使CD105+SMSC向成软骨方向进行分化,而在此过程中一部分SMSC分化后,新生软骨细胞分泌的因子又能够进一步起正反馈作用。并在此过程中,对炎症反应也具有一定的影响作用。
本实验中已使用Real-time PCR证实了这一点,在2∶1和(或)1∶1组,其4种成软骨指标均呈上升趋势。但TGF-β3不同,它在4∶1组的表达最高,随着共培养体系中软骨细胞的增多而呈现出下降的趋势,这和我们预期中的,随着软骨细胞密度的增加,上清液中应该含有更多的成分这一点不符合,并且这个组内的Col2A1、Aggrecan、SOX-9等3个基因表达均不是最高的,这个矛盾点值得进一步完善实验来探究。
而关于其中炎症指标情况,MMP-3和MMP-13这2种基质金属蛋白酶,在关节炎的病理过程中起重要的作用。多个体内和体外实验均证实了它们对软骨细胞外基质,尤其是Col2A1的降解起作用[9-11]。它们的降低说明了经诱导或共培养,可以克服这些软骨分化的不利因素。ADAMTS-5又称Aggrecanase-2,它对于软骨细胞外基质尤其是Aggrecan的降解起作用,据报道和关节炎有关,有研究证实沉默ADAMTS-5的siRNA慢病毒注射大鼠关节腔可以治疗关节炎[6]。RUNX-2是一个转录因子,通常在成骨、骨肉瘤发生侵袭等病理生理过程中起作用,近些年来有报道证实了它在关节炎病理进程的软骨基质降解中所起的作用。这些因子表达水平的上升可能有两种解释,一是在SMSC分化的过程中伴发有炎性反应,从而阻碍其进一步分化作用,还有一种可能就是它们对新生软骨具有塑形作用,阻止了软骨的过度肥大[12-13]。
本实验对组织工程方法进行了初步的探索,既说明了选用SMSC的可行性,探索了一种简易有效的促成软骨分化方法和细胞比例。也为直接接触式共培养、支架上的三维共培养、体内实验等奠定了基础。本实验分析了Transwell共培养条件下各比例的结果,通过成软骨指标和炎症指标进行了两个方面的分析。在ACC与CD105+SMSC为2∶1的比例下,软骨细胞外基质Col2A1和Aggrecan水平均显著提高,而MMP-3及MMP-13水平均有明显降低。提示本组可能是进行共培养成软骨分化的最佳比例,对进一步的实验有一定的指导作用。
