卵蛋白诱导哮喘过程中尾静脉注射hucMSC来源外泌体的小鼠肺部及全身炎症反应观察
2020-10-13王璐邹应芬贾浩源
王璐,邹应芬,贾浩源
南京医科大学附属无锡人民医院,江苏无锡214023
哮喘患者反复发作的喘息、气促、胸闷和咳嗽给患者造成极大的痛苦,估计到2025年全球约有哮喘患者4亿[1]。哮喘发病机制主要是过敏反应、炎症/免疫细胞和气道高反应之间相互作用,导致支气管收缩,最终气道重构。哮喘的慢性变应性炎症涉及到多种细胞(如树突状细胞、B细胞、T细胞、嗜酸性粒细胞、中性粒细胞和肥大细胞)及炎症因子(主要是Th2样细胞因子)[2]。目前还没有一种治疗方法能够加速受损肺部的修复。
间充质干细胞(MSC)是具有自我更新能力的多能祖细胞,其来源广泛,且能够分化为多种细胞,如BM-MSCs、 AD-MSCs、UCB-MSCs等,这些细胞具有组织修复潜力,是免疫反应的主要调节者[3]。外泌体是一种由真核细胞分泌并释放到胞外环境中的纳米级膜性囊泡,可作为细胞间信息交流的传递使者通过表面分子与受体细胞表面受体结合,将其内含物递送给受体细胞[4]。人脐带间充质干细胞源性外泌体(hucMSC-ex)是间充质干细胞分泌的小囊泡,其易获得且能够模拟hucMSC生物学功能,具有促进组织修复或免疫调节等作用[5]。因此认为,hucMSC-ex可能对哮喘有治疗作用。为验证此猜测,2018年1月~2019年12月,我们首先分离培养hucMSC,提取hucMSC-ex,然后采用卵蛋白致敏的方式构建小鼠哮喘模型,在小鼠哮喘模型制作的过程中尾静脉注射hucMSC-ex,观察肺组织炎症细胞及血清炎性因子的变化,以探讨hucMSC-ex对哮喘小鼠全身及肺组织炎症反应的防治作用。
1 材料与方法
1.1 组织、动物及主要试剂与仪器 脐带组织标本来源于无锡市人民医院。BALB/c雌性小鼠 6~8周30只,购自常州卡文斯实验动物有限公司。小鼠放置在标准的实验室条件下[光照12 h,黑暗12 h,(21±2)°C] 进行饲养。α-MEM培养基(hyclone),特级胎牛血清(FBS)(bioind, 南美),35 mm细胞培养皿(corning,美国),100 kDa MWCO 超滤离心管(Millipore 公司,美国),细胞上清 ExoQuick 提取试剂盒(SBI 公司,美国),ELISA试剂盒(ImmunoWay),二氧化碳细胞培养箱(Thermo Scientific 公司,美国)。
1.2 hucMSCs的分离培养及外泌体的分离 根据前期建立的贴壁培养法[5]分离培养hucMSCs 。选取P2~P7代对数生长期的hucMSCs无血清外泌体培养上清,根据SBI试剂盒的说明书提取hucMSCs来源的外泌体。透射电镜结果显示hucMSC-ex为大小均一的囊泡,Nanosight结果显示hucMSC-ex分布在50~200 nm之间,直径大约为110 nm,符合hucMSC-ex的特征,因此鉴定为hucMSC-ex。
1.3 小鼠哮喘模型的构建、分组及hucMSC-ex的注射 BALB/c雌性小鼠第0天和第7天腹腔注射10%的卵蛋白和氢氧化铝混合液1 mL进行致敏。1周后将小鼠随机分为hucMSC-ex组、哮喘组、对照组各10只。将小鼠置于20 cm×30 cm×40 cm雾化箱内,hucMSC-ex组雾化吸入1%卵蛋白10 mL,每日1次,每次30 min,持续2周,并于每次雾化前尾静脉注射200 μg/mL的hucMSC-ex。哮喘组尾静脉注射hucMSC-ex同体积的PBS后,雾化吸入1%卵蛋白10 mL,每日1次,每次30 min,持续2周。对照组雾化吸入10 mL PBS,每日1次,每次30 min,持续2周。
1.4 各组肺组织病理变化观察 末次激发结束48 h后将小鼠进行麻醉,暴露胸腔,取出左肺,将其固定后制作石蜡切片,进行HE染色并在显微镜下观察其病理改变。
1.5 各组肺泡灌洗液(BALF)中白细胞分类计数 末次激发结束48 h后将小鼠进行麻醉,对各组大鼠经气管缓慢注射300 μL生理盐水到右肺,进行回抽,重复3次后获得BALF,进一步进行瑞氏染色,显微镜下观察200个高倍视野,对细胞进行计数,并根据细胞形态对细胞进行分类统计。
1.6 各组血清中IL-4、IL-5、IL-13的检测 采用ELISA法。末次激发结束48 h后将小鼠进行麻醉,用移液器经眼眶后静脉丛采血并及时分离血清。根据试剂盒说明书建立标准曲线,检测血清中IL-4、IL-5、IL-13。
2 结果
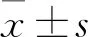
2.1 各组肺组织病理变化 与对照组相比,哮喘组气道壁增厚,管腔不规则,气道周围炎症细胞浸润明显增加,气道周围水肿明显加重;与哮喘组比较,hucMSC-ex组肺组织气管黏膜增厚情况及水肿减轻,细胞变性和炎症浸润减少(见图1)。
图1 肺组织病理结构(HE染色,×20)
2.2 各组BALF中白细胞总数及中性粒细胞、嗜酸性粒细胞比例比较 与对照组相比,哮喘组白细胞总数及中性粒细胞、嗜酸性粒细胞比例明显增加;与哮喘组比较,hucMSC-ex组BALF中白细胞总数、中性粒细胞、嗜酸性粒细胞比例降低(P均<0.05),详见表1。

表1 各组BALF中白细胞总数及中性粒细胞、嗜酸性粒细胞比例
2.3 各组血清炎症因子水平比较 与对照组相比,哮喘组血清中IL-4、IL-5、IL-13水平升高;与哮喘组比较,hucMSC-ex组IL-4、IL-5、IL-13水平降低(P均<0.05)(详见表2)。
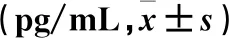
表2 各组血清IL-4、IL-5、IL-13水平
3 讨论
哮喘是一种多细胞参与的慢性呼吸道炎症性疾病。许多研究表明,间质干细胞具有免疫调节及抑制炎症反应的作用,MSC可以减轻过敏性哮喘患者的肺部炎症和组织重塑[6~8]。Bonfield等[9]证明人类BM-MSC能够降低卵蛋白诱导的哮喘小鼠模型中嗜酸性粒细胞的数量。这些研究表明在哮喘治疗中MSC具有一定的效果,但MSC存在一定的免疫原性,且易在肺部阻塞,体内移植存在一定的风险。近期有研究[10]表明,MSCs在哮喘中的免疫调节作用主要归因于其分泌的可溶性因子,而不是其分化潜能。外泌体作为MSCs重要的旁分泌介质不仅免疫原性低,且具有一定的趋化作用,它可以包含MSC源的多种RNA、蛋白和脂质,并将其传递给靶细胞模仿MSCs的免疫调节作用[11]。经过蛋白质谱分析和微小RNA测序分子发现,hucMSC-ex中包含有丰富的蛋白及mRNA、miRNA、lncRNA和circRNA。前期研究发现在体内外模型中hucMSC-ex能够预防顺铂诱导的急性肾损伤,进一步研究[5]发现其通过转运14-3-3ζ蛋白到达肾小管上皮细胞调节细胞自噬发挥保护作用。此外hucMSC-ex高表达let-7b,通过将其转运到肝脏星状细胞调控TGF-βR1的表达,抑制胶原的合成从而缓解肝纤维化。以上研究表明外泌体作为一种生物活性介质发挥着重要作用。
本研究发现,hucMSC-ex能够有效地降低肺部组织炎症浸润情况,降低BALF中白细胞总数以及嗜酸性粒细胞和中性粒细胞的比例。提示hucMSC-ex对小鼠哮喘有治疗作用。
有研究[12]报道,BM-MSC驱动的免疫调节是通过抑制促炎Th1反应,同时使Th1/Th2向Th2方向重新平衡而介导的。Kavanagh 等[13]发现,BM-MSC通过产生TGF-β和向肺部招募调节性T细胞(Tregs)以抑制Th2驱动的过敏反应。Th2样细胞因子IL-4能够促进IgE产生,然后与嗜碱性粒细胞和肥大细胞上FCεRⅠ结合,当再次接触过敏原时能够导致大量组胺释放,增加气道的通透性。IL-5通过促进嗜酸性粒细胞活化释放细胞因子破坏上皮层,促进支气管收缩。IL-13能够促进杯状细胞化生与气道高反应性。有研究表明MSC来源的外泌体能够上调外周血单个核细胞IL-10和TGF-β1的水平进而促进Tregs 细胞的增殖和免疫抑制活性[14]。本研究发现,hucMSC-ex能够降低肺组织分泌到循环血液中的IL-4、IL-5、IL-13的水平,表明hucMSC-ex能够有效防治哮喘小鼠肺部及全身的炎症反应,防止疾病的进一步进展。
综上所述,卵蛋白诱导哮喘过程中尾静脉注射hucMSC-ex的小鼠肺部及全身炎症反应减轻,hucMSC-ex能够防治小鼠肺部及全身炎症反应,改善哮喘症状,可能是一种新的治疗哮喘的选择。但是,hucMSC-ex是如何改善哮喘引发的炎症反应,传递何种分子发挥作用需要后续试验进一步探讨研究。
