寻常型银屑病表皮细胞中Sp1的表达及临床意义
2020-10-13王冬梅刘家蕊黄钰淇徐文聪陈永锋
钟 维,王冬梅,刘家蕊,朱 磊,黄钰淇,徐文聪,陈永锋
银屑病是一种具有遗传倾向的炎症性增殖性皮肤病,以表皮角质形成细胞过度增殖为特征,其发病机制尚未完全阐明。角质形成细胞(keratinocytes,KC)不仅作为局部免疫反应的终末靶细胞[1], 也是抗原递呈细胞,主动参与皮损中T细胞的再活化,目前认为与银屑病发病密切相关[2]。转录因子特殊蛋白1(transcription factors specificity protein 1,Sp1)可特异性识别并结合DNA中富含GC序列[3],其在人体皮肤、子宫等组织内呈结构性表达,许多管家基因及组织特异性基因的启动子区域因富含GC序列而受Sp1调控[4],从而参与细胞生长和凋亡、细胞周期发展等生理过程[5]。Sp1对KC细胞功能的影响及其如何参与银屑病发病的过程,目前国内外文献未见报道。该研究通过验证Sp1在银屑病表皮中的表达,初步探讨Sp1如何调节KC细胞导致银屑病的发病机制。
1 材料与方法
1.1 标本来源51例寻常型银屑病患者均为2018年8月~2019年5月广东省皮肤病医院皮肤科门诊患者,其中男41例,女10例,年龄12~67(47.25±16.6)岁。临床皮损和病理诊断均符合《中国临床皮肤病学》第二版[6]寻常型银屑病诊断标准。收集患者一般资料,评估皮损面积和严重程度指数,即PASI评分。排除标准:① 患有皮肌炎、类风湿性关节炎、硬皮病等自身免疫系统障碍的患者;② 其他对取材具有迷惑性的慢性皮肤病(如过敏性皮肤表现、细菌感染性皮肤病、真菌侵犯性疾病等);③ 近3个月接受过外用中强效糖皮质激素治疗(如丙酸氯倍他索乳膏、曲安奈德尿素乳膏等)、光化学治疗[如长波紫外线(ultraviolet A,UVA)、窄谱中波紫外线(ultraviolet B,UVB)、补骨脂素(psoralen,PUVA)等光照治疗]、系统性治疗的患者(如糖皮质激素、免疫抑制剂类药物等)。54例对照组为广东省皮肤病医院行整形手术的健康受试者,其中男25例,女29例,年龄12~76(33.88±15.75)岁,两组间性别及年龄相对匹配。研究方案根据赫尔辛基宣言的原则设计和实施,并经本院伦理审查委员会批准。在志愿者签署知情同意书后对其进行活组织检查,每人选取1 cm×1 cm皮肤组织。
细胞实验标本来源为人永生化表皮细胞株Hacat(BNCC100433)(永生化非肿瘤性KC),购自北纳创联生物科技有限公司。
1.2 主要试剂和仪器兔抗人-Sp1单克隆抗体(一抗)(#9389,1 ∶2 000,美国Cell Signaling Technology公司);DAKO酶标羊抗兔IgG抗体(二抗)(#ab672,1 ∶5 000,美国Abcam公司);GAPDH(#ab37168,1 ∶4 000,美国Abcam公司);LipofectamineTMRNAiMAX Transfection Reagent(美国Thermo Fisher Scientific公司);Nano Drop仪(美国Thermo Fisher Scientific公司); Light Cycler 480 PCR仪(瑞士Roche公司);BIO-RAD多色实时PCR检测系统(美国Bio-Rad公司)。
1.3 实验方法
1.3.1HE染色及免疫组化 取患者皮肤组织制成蜡块做4 μm切片待用;脱蜡后于3% H2O2染缸内室温孵育10 min,将玻片浸入1×抗原修复液中加热20 min;滴加50 μl兔抗人-Sp1抗体(1 ∶100),4 ℃过夜孵育;滴加二抗(1 ∶500),37 ℃水浴20 min;镜下显色后复染3 min;镜下观察Sp1蛋白的表达及分布(按照抗体说明书及文献,Sp1阳性表现为细胞内出现黄棕色颗粒状物质沉积)。Sp1蛋白表达水平以Image J软件检测平均光密度值(average optical density,AOD)表示。
1.3.2实时荧光定量聚合酶链式反应(real time quantity polymerase chain reaction,RT-qPCR) ① 提取组织中的总RNA(所有操作冰上进行):组织称重后研磨至粉末状;加入TRIzol试剂充分裂解;加氯仿萃取,离心20 min后取上清液,并加入等体积异丙醇混匀;再次离心见白色沉淀物即组织总RNA;加入DEPC水溶解RNA沉淀物;用NanoDrop仪检测RNA浓度;达标后使用逆转录试剂盒将RNA逆转录成cDNA;② 实时荧光定量PCR:以GAPDH为内参,Sp1前引物:5′-CCTTCAGGGATTTCCAACTG-3′,后引物:5′-GTCCAAAAGGCATCAGGGTA-3′;GAPDH前引物:5′-TGTTCGTCATGGGTGTGAAC-3′,后引物:5′-ATGGCATGGACTGTGGTCAT -3′;采用20 μl反应体系,在无RNA酶八联管中分别加入10 μl SYBR Prime Ex TaqTM、1 μl cDNA、7 μl DEPC水、前后引物各1 μl,采用BIO-RAD多色实时PCR检测系统行RT-qPCR实验,循环阈值(cycle threshold valve, Ct)值通过2-ΔΔCT相对定量法计算倍数变化。
1.3.3Western blot 提取组织总蛋白后选择10% SDS-PAGE胶,加样后恒压电泳;转PVDF膜后再次恒流电泳; 取出PVDF膜转至封闭液中浸泡,恒温37 ℃摇床匀速摇60 min;取膜置于一抗稀释液(Sp1 1 ∶2 000,GAPDH 1 ∶4 000)中4 ℃冰箱过夜;次日清洗后浸泡于羊抗兔IgG抗体(1 ∶5 000)中37 ℃摇床孵育60 min;置于暗房用胶片显影。
1.3.4si-RNA基因敲降技术 合成即用型化学合成双链小分子RNA(short interfering RNA,siRNA):将Hacat细胞计数后按3×104个/孔铺板,置于培养箱过夜使细胞贴壁后密度达到50%;使用LipofectamineTMRNAiMAX Transfection Reagent(#13778150) 按说明书制备成转染复合物混合液,按比例加入相应体积混合液于培养基中;置于37 ℃ CO2培养箱培养24~96 h,显微镜下观察Hacat细胞生长情况,以备下一步实验。
1.3.5绝对细胞计数法 按实验计划接种适合数量的细胞后行siRNA基因敲降实验;用0.05%胰蛋白酶-EDTA消化Hacat细胞,制成单个细胞悬液;在光学显微镜下计算细胞密度:每毫升原液中的细胞数=4部分细胞数的平均数×104×稀释倍数。通过比较Sp1敲低组和对照组之间的细胞数目差异值,研究Sp1对细胞增殖功能的影响。
1.3.6CCK-8计数法 以Hacat细胞5 000个/孔铺96孔板为例:细胞消化后计数,以5 000个/孔铺96孔板,每孔约100 μl细胞悬液;置于37 ℃ CO2培养箱过夜;按照实验设计要求转染siRNA后置于培养箱48 h;次日每孔加入10 μl CCK-8试剂,严格避光置于培养箱孵育4 h;使用酶标仪双波长测定OD值(检测波长450~490 nm,参比波长600~650 nm)。
2 结果
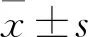
2.1 Sp1蛋白在银屑病组和对照组皮组织中的表达及分布免疫组化染色法定位Sp1在寻常型银屑病患者皮损中广泛分布于表皮各层细胞胞核,以棘层和基底层为主;在对照组皮肤中主要定位于棘层细胞胞核中,银屑病组中染色强度与范围高于对照组(图1)。Sp1的平均光密度值在银屑病组高于对照组,差异有统计学意义(n=24,P=0.012 7)。见图2A。
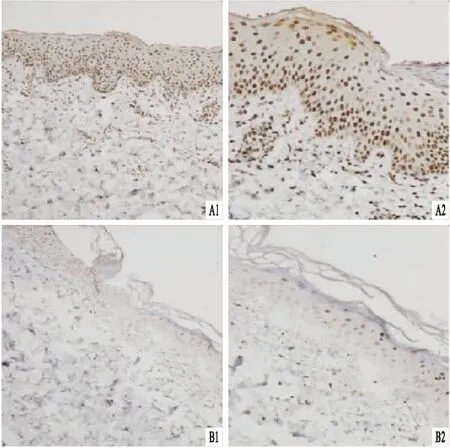
图1 银屑病组和对照组皮组织Sp1的表达
2.2 Sp1 mRNA水平的表达RT-qPCR检测皮组织中Sp1 mRNA表达量,结果显示Sp1 mRNA在两组中均有表达,但寻常型银屑病组Sp1 mRNA表达量高于对照组,两组差异有统计学意义(n=25,P=0.005 7)。见图2B。
2.3 Sp1蛋白水平的表达Western blot检测银屑病组和对照组皮组织中Sp1蛋白的表达差异,结果表明Sp1 mRNA在两组中均有表达,但寻常型银屑病组Sp1 mRNA表达量高于对照组,两组差异具有统计学意义(n=56,P<0.000 1)。见图2C、2D。
2.4 细胞水平验证Sp1的功能由于银屑病原代KC培养困难,故使用Hacat细胞系替代(永生化非肿瘤性KC,为目前公认可替代KC完成功能实验的细胞系)。通过siRNA基因敲降技术降低Hacat细胞Sp1的表达(图3A),并应用Western blot检测证实Sp1表达已被成功敲降,最后采用CCK-8计数法统计实验组和对照组的细胞数量(图3B),采用绝对细胞计数法记录各组之间Hacat细胞的生长曲线(图3C),结果表明实验组Hacat细胞增殖功能受到抑制,Sp1的表达降低能够抑制Hacat细胞的增殖,即反向证明Sp1可影响角质形成细胞增殖。本实验两组间差异具有统计学意义。
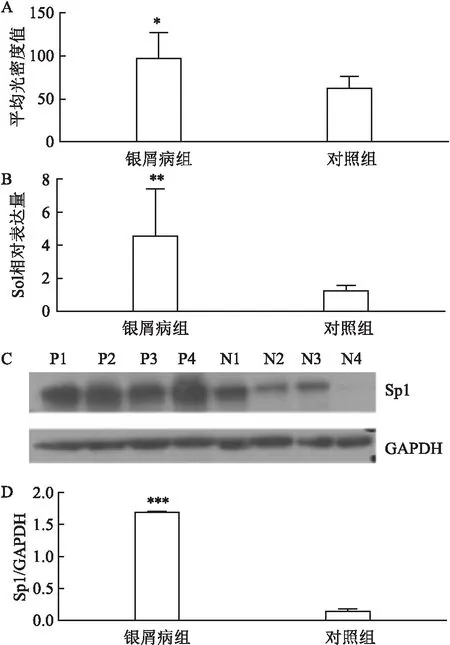
图2 Sp1在银屑病组和对照组皮组织中的差异性表达图示
3 讨论
银屑病是一种多基因参与的红斑鳞屑性皮肤病,通过免疫介导的多条通路最终引起KC增殖的慢性炎症性免疫性疾病。其病理特征为表皮角化过度和角化不全、棘层增厚、真皮炎症[7]。银屑病的发病机制累及多环节多通路,目前普遍认为IFN-γ/TNF-Th1轴在银屑病的发病中起重要作用[8]。TNF直接或间接诱导产生IFN-γ,后者通过与相应受体结合启动3条主要的免疫调控通路:NF-Kappa B活化和炎症的产生;MAPK(促分裂元活化蛋白激酶)通路活化KC的分化增殖、细胞的死亡信号,从而在同一个细胞内通过凋亡和抗凋亡信号共同调节,引起多种调控KC生长分化的细胞因子异常表达,导致免疫介导下KC过度增殖最终发生银屑病[9]。
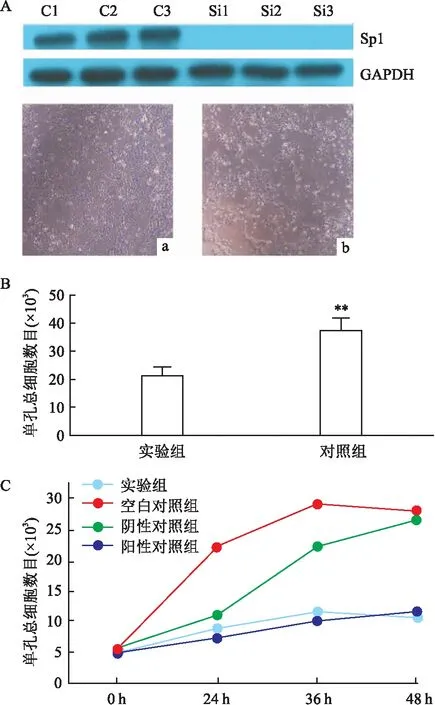
图3 对照组和敲低Sp1实验组统计分析结果
Sp1是Sp家族的重要成员之一,其成员与3个相邻的Cys2His2型锌指共享高度保守的DBD(序列同一性超过65%),因此它们以重叠的特异性和亲和力结合到GC或GT盒上。其成员包括Sp1、Sp3、Sp4,其中Sp1在人体皮肤、子宫等组织内呈结构性表达,许多管家基因及组织特异性基因的启动子区域因富含GC序列而受Sp1调控。其参与细胞生长和凋亡、细胞周期发展、血管生成和转移等生理过程[10],是细胞周期的关键调控因子[11]。研究[12]表明肿瘤坏死因子α(tumour necrosis factor α,TNFα)的表达可通过SP家族中Sp1和Sp3相互作用而调控,尤其是Sp1的正向调控起主要作用。其在胃癌、胰腺癌、结肠癌和肺癌等多种肿瘤中特异性高表达,与肿瘤的浸润和转移密切相关,其表达强度与肿瘤患者的愈后呈正相关[13]。目前对于Sp1在银屑病中发挥的作用仍然知之甚少。
本研究免疫组化染色显示Sp1广泛表达于皮肤组织表皮层细胞胞核,其中寻常型银屑病皮损中Sp1表达以棘层和基底层为主,且染色强度与范围高于对照组,此层细胞受参与表皮增殖分化的基因调控,故明确Sp1与寻常型银屑病的发生存在相关性,可能参与调控银屑病表皮异常增殖分化的过程。为进一步探究其在分子水平的表达,通过RT-qPCR和Western blot检测Sp1在mRNA水平和蛋白水平皆有差异性表达,且寻常型银屑病皮损中Sp1表达量高于对照组,再次从两方面正向验证Sp1与寻常型银屑病存在密切的相关性。为了解Sp1的表达对KC功能的影响,反向验证Sp1与银屑病的关系,采用siRNA基因敲降技术抑制Hacat细胞中Sp1的表达,结果表明Sp1的表达降低能够抑制Hacat细胞的增殖。由此证明Sp1与KC增殖功能具有相关性。结合文献,推测Sp1通过正向调控TNFα的表达,从而诱导产生IFN-γ,后者启动3条主要的免疫调控通路,发挥IFN-γ/TNF-Th1轴在银屑病发病中的重要作用。
综上所述,本研究丰富了银屑病发病机制的通路,明确了Sp1与银屑病发病机制的相关性,为日后的研究以Sp1的表达量作为银屑病生物学行为和治疗有效性的生物学指标的研究提供了实验基础和研究方向。近年来随着生物制剂靶向药物的推广,未来拟增加动物实验研究Sp1是否在咪喹莫特小鼠银屑病模型中影响KC的增殖,通过涂抹型的Sp1抑制剂观察其对银屑病小鼠模型的治疗作用,有望为寻常型银屑病的治疗提供新靶点。
