BACH1在胃癌中的表达及其临床意义
2020-10-13常家聪
陈 冲,周 波,常家聪
胃癌作为全球第五大高发癌症,死亡率位居第三,目前患者的5年生存率依然低下[1]。因此,进一步研究胃癌分子机制并为之提供合理的治疗方案迫在眉睫。当前发现转录因子BACH1(BTB and CNC homology1)是一种转录抑制因子,属于帽和衣领碱性区域亮氨酸拉链蛋白家族(cap'n'collar type of basic region leucine zipper protein family,CNC-bZip),它通过抑制血红素环氧化酶1(hemoxygenas-1,HO-1)的表达在调节氧化应激中起重要作用[2],越来越多的证据表明BACH1参与结肠癌、乳腺癌、肺癌等癌症的发生、发展[3-5]。然而国内外尚未发现BACH1在胃癌组织中的表达情况及其与临床病理资料相关性的文献报道,因此该研究通过检测BACH1在胃癌组织中的表达情况,分析其与临床病理特征和预后的相关性,为进一步研究其在胃癌发生、发展中的作用机制奠定基础。
1 材料与方法
1.1 材料
1.1.1胃癌组织芯片及相关信息 胃癌组织芯片(型号:HStmA180Su15)购自上海芯超生物科技有限公司,包含了手术时间为2006年7月~2007年4月共98例胃癌患者癌组织及与其相对应的82例癌旁组织,经后期实验观察排除取材失败位点,最终纳入统计的为89例胃癌组织和78例癌旁组织,其中癌与癌旁配对共70例。组织芯片制作流程: 在组织数据库中选择合适的组织病例编号,按照组织病例编号从组织库中取出组织蜡块和对应的HE染色切片,用组织阵列仪按照阵列设计抽提病理蜡块组织芯并有规律的排列在空白受体蜡块上,用全自动组织切片机曝露组织芯后对组织阵列块进行切片,切片裱附在防脱片处理的载玻片上最终形成胃癌组织芯片。胃癌患者年龄:41~84(64.74±10.015)岁。胃癌患者的随访情况:采取电话随访形式,随访截止时间为2015年7月,随访时间为1个月~107个月,中位随访时间43个月。所有患者术前均未接受放化疗治疗。
1.1.2试剂 兔抗人BACH1单克隆抗体(DF8317;1 ∶ 200)、SP染色试剂盒、DAB显色试剂盒、苏木精染色剂购自合肥摩尔生物科技有限公司。
1.2 方法
1.2.1免疫组化 将组织芯片置于恒温箱中烘烤脱蜡后置于二甲苯中脱蜡2次;酒精梯度脱水;抗原修复;阻断过氧化物酶;山羊血清室温封闭;封一抗、封HRP标记二抗, DAB显色;苏木精复染;自来水分化;中性树脂封片; 显微镜观察。
1.2.2结果判读 由2名经验丰富的病理科医师通过双盲法对免疫组化结果阅片并评分。采取双评分半定量法评估BACH1的表达情况,免疫组化结果评分=着色程度×阳性细胞百分率,按以下评估标准进行结果判读,阳性细胞:≤5%计0分;6%~25%计1分;26%~50%计2分;51%~75%计3分;≥75%计4分,最终评分<4分为阴性表达,≥4分为阳性表达。着色强度:无阳性染色计0分,浅黄色计1分,棕黄色计2分,3褐色计3分。最高分12分,4分及以下为低表达,5分及以上为高表达[6]。
1.3 统计学处理采用SPSS 23.0软件进行统计学分析,使用卡方检验或Fisher确切概率法进行组间比较,使用Kaplan-Meier法进行单因素分析并绘制生存曲线, 生存率的比较采用Log-rank检验, 预后评估运用COX风险比例模型。以P<0.05为差异具有统计学意义。
2 结果
2.1 BACH1在胃癌组织和癌旁正常组织中的表达情况BACH1集中表达在细胞核和细胞质中,镜下观察为浅黄色至棕黄色沉淀。BACH1在胃癌组织中呈中度表达或低表达,在癌旁正常组织中呈低表达或不表达,见图1,胃癌组BACH1表达阳性率显著高于癌旁组,差异有统计学意义(P<0.05),见表1。
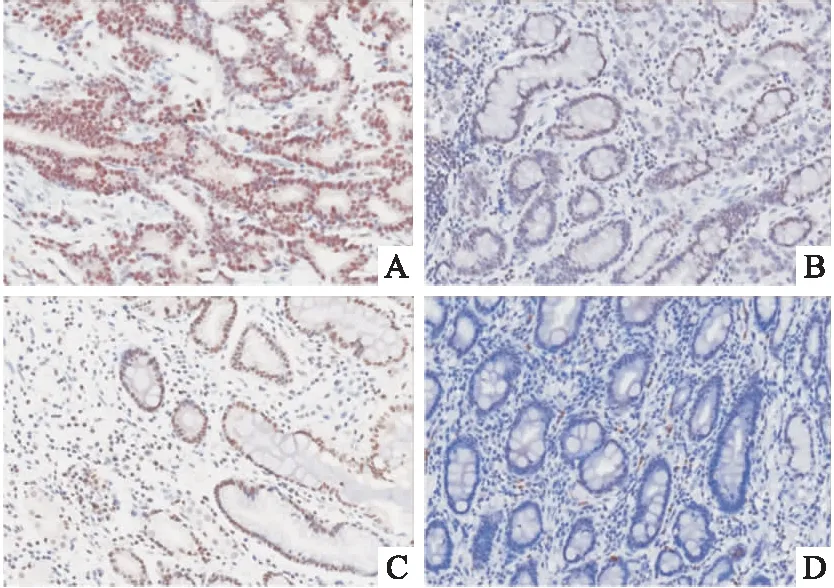
图1 BACH1在胃癌组织和癌旁组织中的表达情况 ×200
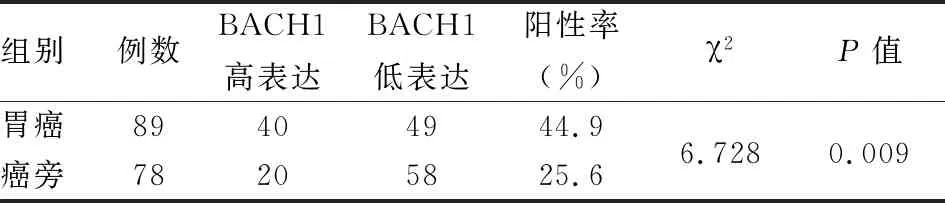
表1 胃癌和癌旁组织中BACH1的表达情况(n)
2.2 BACH1的表达与胃癌临床病理特征的关系BACH1的表达和胃癌的病理分级(P=0.017)、T分期(P=0.038)、淋巴结转移(P=0.035)和TNM分期(P=0.007)相关,而和性别、年龄、肿瘤大小及远处转移无明显相关性,见表2。
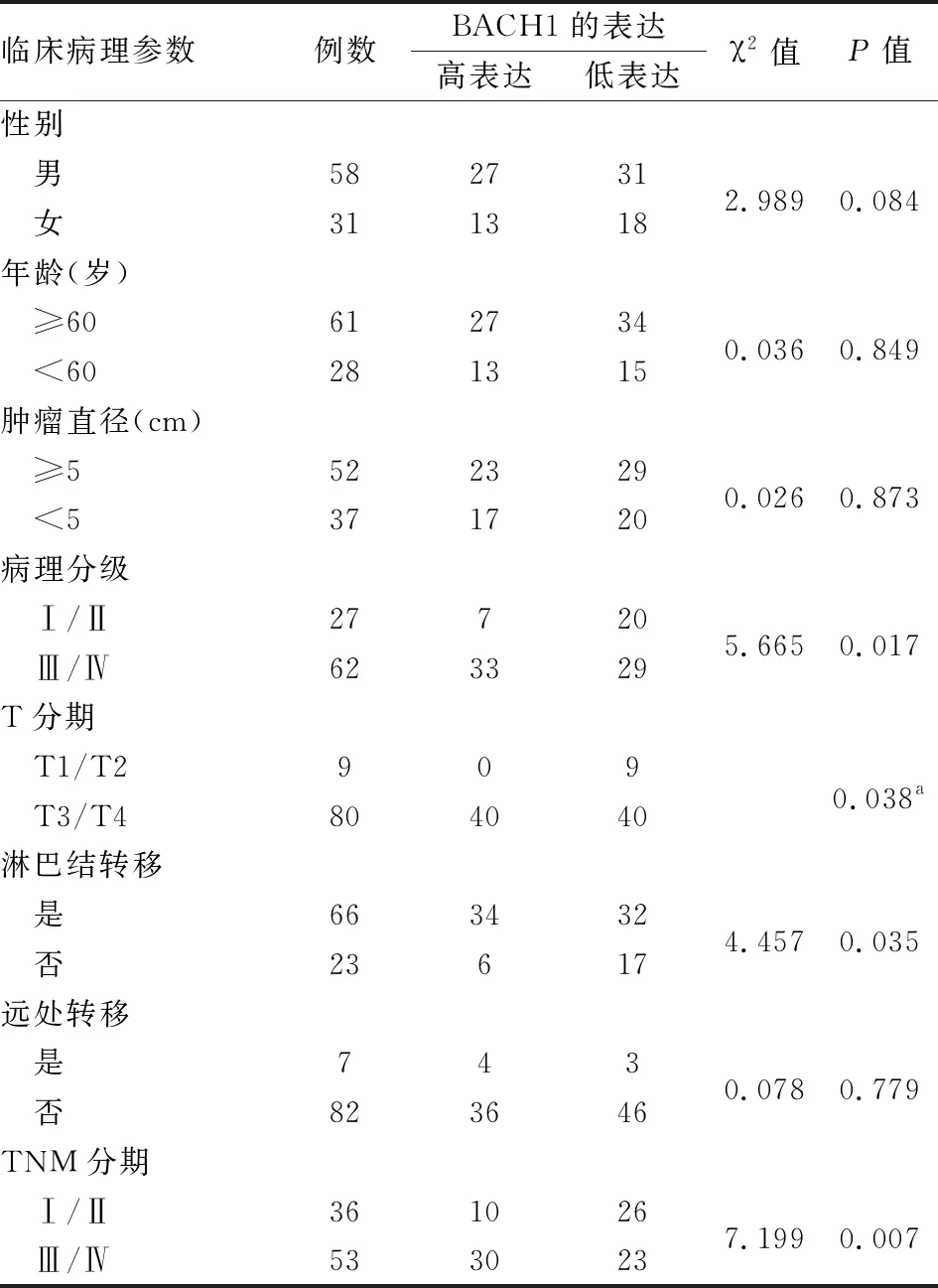
表2 BACH1表达水平与胃癌临床病理特征的相关性(n)
2.3 BACH1表达与胃癌预后的相关性分析使用Kaplan-Meier生存分析法和Log-rank统计检验分析BACH1表达和胃癌患者预后的相关性并绘制生存曲线图,结果显示BACH1高表达患者预后更差(P=0.014),见图2,然后使用单因素COX风险比例模型进行生存分析,结果显示淋巴结转移(P=0.045)、远处转移(P<0.001)、TNM分期(P=0.019)及BACH1表达(P=0.016)可作为胃癌患者预后的预测因子,随即将上述4个指标纳入多因素COX风险比例模型分析进行生存分析,结果显示BACH1表达(P=0.028)和远处转移(P=0.001)是胃癌不良预后的独立危险因素。见表3。
3 讨论
本研究通过组织芯片技术,用免疫组化实验方法检测胃癌组织 中BACH1的 表达情况,结果显示其在胃癌组织中的表达高于癌旁正常组织,并证实其与胃癌病理分级、T分期、淋巴结转移及TNM分期显著相关。为了了解BACH1表达高低与胃癌患者预后的关系,通过Kaplan-Meier单因素生存分析发现BACH1高表达胃癌患者预后较低表达更差;通过单因素COX风险比例模型分析发现BACH1表达、淋巴结转移、远处转移及TNM分期均是患者预后的危险因素,将上述4个指标纳入多因素COX风险比例模型分析发现BACH1表达和远处转移是胃癌患者预后的独立危险因素。综合上述结果考虑BACH1可能参与了胃癌的发生、发展并与不良预后相关。
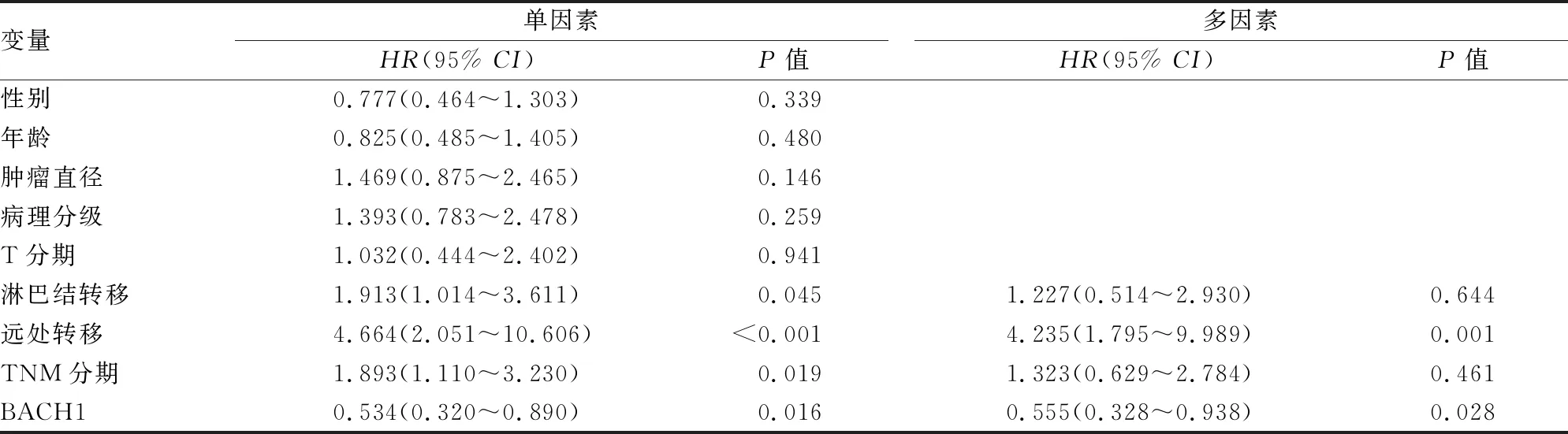
表3 影响胃癌患者预后的单因素和多因素COX风险比例模型分析
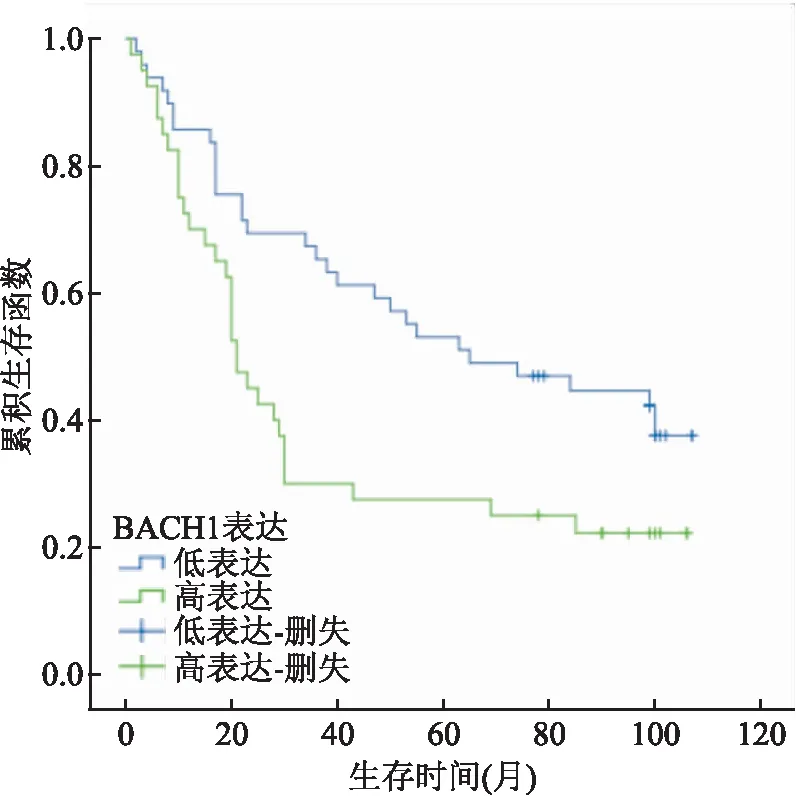
图2 胃癌患者BACH1表达的Kaplan-Meier生存曲线
细胞衰老是抑制突变细胞增殖的关键,可抑制肿瘤的发生, p53作为人类癌症中最常见的抑癌基因之一,其突变引起的编码蛋白构象改变和功能丧失最终会导致肿瘤的发生[7-8]。当前研究发现转录因子BACH1是氧化应激反应的关键负调控因子,其通过抑制血红素氧合酶1(hemoxygenas-1,HO-1)基因的表达来增加氧化应激,BACH1在p53靶基因的一个子集上通过招募组蛋白去乙酰化酶1(histone deacetylase 1,HDAC1)后与p53形成复合物,从而抑制p53的转录活性,进而抑制氧化应激情况下由p53介导的细胞衰老的过程,因此BACH1作为p53的负调控因子,连接了氧代谢和细胞衰老[9-11]。有学者证实BACH1可过表达竞争性结合p53从而阻碍其发挥正常生物学效应使得胶质母细胞瘤获得耐药性[12]。研究[4]表明BACH1转录调节多个参与乳腺癌骨转移的基因,可以显著促进乳腺癌细胞的侵袭转移。最新研究[5]发现BACH1可以通过刺激糖酵解的方式促进肺癌细胞糖酵解依赖性转移。以上研究发现提示BACH1可能通过抑制相关抑癌基因如p53等和相关抗氧化应激反应基因如HO-1等基因的生物学活性破坏胃上皮细胞原有的氧化应激、衰老、凋亡机制的平衡,转录调节促胃癌转移基因,刺激胃癌细胞活性等机制参与胃癌的发生、发展。
综上所述,该研究揭示了BACH1表达水平与胃癌患者临床病理特征及预后的关系,表明其可能促进癌症的发生、发展并具有独立的预后意义,因此其有望成为胃癌患者预后的潜在生物标志物,然而BACH1在胃癌的发生发展中的具体机制还不清楚,需要通过进一步的实验加以研究。该研究存在了一些不足之处,包括样本量太少、无新鲜胃癌标本进行验证、缺乏细胞水平和动物水平实验验证等问题,这正是课题组后期准备开展的工作。
