lncRNAs在小细胞肺癌中的研究进展
2020-10-12李钊万容均顾其华胡成平
李钊 万容均 顾其华 胡成平
中南大学湘雅医院呼吸内科 国家临床重点专科,长沙410000
肺癌是世界第一大恶性肿瘤。无论在发展中国家还是发达国家,其发病率与病死率在恶性肿瘤中均位居前列[1],给患者、家庭、社会带来了沉重的疾病负担。根据细胞类型,肺癌分为非小细胞肺癌 (non-small cell lung cancer,NSCLC)和小细胞肺癌 (small cell lung cancer,SCLC)。其中SCLC约占肺癌患者总数的15%,因为进展迅速和有效治疗方法有限,其5年生存率仅有约6%[1-2]。因此,对SCLC治疗方法的进一步探索亟需进行。
长链非编码核糖核酸 (long non-coding RNAs,lncRNAs)是一类不编码蛋白质或者仅具有非常有限编码蛋白质能力的功能性的非编码核糖核酸,其至少包含200个碱基[3]。随着大通量测序和生物信息学平台的高速发展,学者们对lncRNAs的研究逐渐加深,lncRNAs参与细胞的生长、增殖、凋亡、黏附等在内的多种生物学过程逐渐被揭示[4]。但目前研究还不够深入,仅有少量的lncRNAs被实验和临床样本证实参与了肿瘤相关的生物学行为[5-6]。
SCLC的研究往往由于样本收集困难、确诊时疾病进程晚、肿瘤进展快和容易耐药等原因受到阻碍,其临床治疗方案已有约40年没有实质性进展。在NSCLC 中有效并被广泛推广的靶向治疗和免疫治疗在SCLC 中的临床试验也没有收到满意的临床疗效[7-8],而lncRNAs广泛参与了肿瘤发生、进展相关的各种生物学过程[5-6],在SCLC 中研究lncRNAs有助于对SCLC 发生、发展机制的进一步了解,也有可能为SCLC的诊断和治疗寻找到新的治疗靶点。
1 lncRNAs参与生物学过程
lncRNAs在细胞中普遍存在,且参与了大量的生物学过程。有学者认为其有4 种作用形式[9]: (1)信号。lncRNAs的表达有细胞特异性,且能够被不同的刺激激活转录,这一过程具有细胞空间和时间特征,意味着lncRNAs参与了细胞内信号转导的过程,参与细胞内生物学行为的调控[10-11]。(2)诱饵。lncRNAs能诱导转录因子和DNA 解离,并和自身结合来调节目的基因的转录[12]。(3)向导。lnc RNAs能带领染色质修饰酶到特定的目的基因位点调节染色质的修饰。(4)支架。lncRNAs可以作为分子组件装配平台,精确和动态的控制分子间的相互作用和信号事件[13]。
通过不同的作用形式,lncRNAs能在转录水平、转录后水平以及表观遗传学水平等多个层面发挥调节作用,其能够通过作为诱饵调节RNA 聚合酶Ⅱ、转录因子和DNA的结合调节基因转录;或者作为内源性竞争性RNA 直接和DNA 结合形成三螺旋结构调节基因转录[10,14]。lncRNAs也能通过调节m RNA 剪接来提供不同的转录本和m RNA 结合,形成lncRNA-m RNA 双螺旋复合体来稳定m RNA,以及直接和m RNA 相互作用来进行转录后调控[15-16]。lncRNAs还能通过调节组蛋白的修饰,如乙酰化、甲基化和泛素化,从而与染色质修饰复合物结合,参加染色质重构和构象改变,在表观遗传学水平调节基因转录[17-18]。
lncRNAs通过多种作用形式参与了包括染色质结构改变、基因修饰和转录、m RNA 剪接和翻译等各个水平的生物学调节过程,这意味着lncRNAs数量和功能的异常将导致各种病理状态,如细胞的增殖、分化、凋亡,肿瘤的形成和药物耐药等[19]。尤其是当lncRNAs作用靶点为肿瘤形成相关基因时,其异常将影响到肿瘤的发生、发展和对治疗的反应[20-21]。
2 lncRNAs在SCLC中的作用
lncRNAs在早期被认为是垃圾DNA,因为其不编码或者只能很有限的编码蛋白质。从21世纪初开始,随着人类基因组计划的进行,科研人员通过全转录组测序发现了一大批lncRNAs[22],而后的FANTOM5 项目在其中确定了近2 万个可能有功能的lncRNAs[23],但目前对这些lncRNAs的研究还远不够透彻。现已经有研究证实参与SCLC的lncRNAs数量更加有限[24],以下是与SCLC 相关的lncRNAs的研究进展。
2.1 HOTTIP HOTTIP位于HOXA 位点[25]。既往的研究证实其在SCLC、肝癌、胃癌、胰腺癌、前列腺癌等多种恶性肿瘤中表达增加[25-26]。在临床相关的研究中,肿瘤组织HOTTIP的表达增加程度与SCLC 患者糟糕的预后呈正相关。在SCLC 的肿瘤细胞系中,HOTTIP 表达增加,敲低这些细胞系HOTTIP的表达,能降低其增殖能力;进一步的细胞周期分析发现,敲低HOTTIP能够减少G2期的细胞比例并增加S期的细胞比例;使用HOTTIP敲低的细胞来建立小鼠成瘤模型,研究发现这些小鼠相对未处理的细胞系肿瘤更小,这意味着HOTTIP的高表达能促进细胞的增殖。该研究还发现HOTTIP 有和miR-574-5p以及EZH1的结合位点,其能够作为原癌基因抑制miR-574-5p对EZH1表达的促进作用,促进SCLC 的疾病进展[27]。另外的研究还发现,HOTTIP 和HOXA13 在SCLC 细胞系和活检样本中表达同时增加,进一步的细胞试验表明,HOTTIP通过上调HOXA13 来诱导细胞对依托泊苷、伊立替康和顺铂等化疗药物的耐药效应[24,26,28];还能通过和miR-216结合,降低其对BCL-2的抑制作用,导致肿瘤细胞耐药和肿瘤进展[28]。
2.2 HOTAIR HOTAIR 位于HOXC 结合域,其能够和多梳抑制复合体2 结合并调节其活性,调节HOXA、HOXD 等位点基因的甲基化和去甲基化,调节相关基因的表达[6,29]。其在乳腺癌、结肠癌、肝细胞癌和肺癌中均有高表达[30]。在临床相关的研究中发现,HOTAIR 在SCLC肿瘤组织中的表达与其细胞学进展以及临床分期呈正相关,相应的,HOTAIR 在10 种SCLC 的细胞系中同样有表达上调。而且HOTAIR 的过度表达与疾病复发、淋巴结转移密切相关[31]。在细胞系中敲低HOTAIR 可以降低细胞的侵袭性和增殖能力,并增加细胞黏附能力,促进肿瘤细胞的凋亡,这意味着HOTAIR 的异常高表达能够促进肿瘤的生长和转移[31-32]。另外,HOTAIR 在耐药的SCLC 细胞系中表达增加,其能够通过增加HOXA1的甲基化来促使细胞对抗肿瘤药物不敏感[32]。HOTAIR 可以作为可能的目标用于针对抗药性的新疗法,也可以作为化疗和评估预后的生物学标志物,并作为一个治疗目标,以克服SCLC 的化疗药物的耐药效应[32]。
2.3 TUG1 TUG1和HOTAIR 类似。TUG1能够被p53介导表达,并和PCR2结合,调节其甲基化,而后影响有丝分裂、纺锤体形成和细胞周期相关基因的表达[33]。前期的研究表明,TUG1在肝细胞癌、骨肉瘤、胶质瘤等恶性肿瘤中表达增加[34]。实验已经证实,TUG1在SCLC 的临床样本中表达增加,且与较短的生存期、肿瘤分期、晚期进展和吸烟有关[35]。对SCLC 细胞系的研究也表明,TUG1能够抑制SCLC 细胞的凋亡,并促进细胞分裂和增殖,同时其还能够通过EZH2结合来调节促进肿瘤细胞的耐药[35-36]。
2.4 CCAT2 CCAT2 位于8q24 的荒漠区,其单核苷酸多态性rs6983276和肿瘤有关。其在结肠癌中被认为是肿瘤形成相关lncRNAs,通过调节myc和Wnt通路促进肿瘤细胞的增殖、转移并增加染色体不稳定性[37]。不仅是结肠癌,随着研究的深入,这一发现在胃、乳腺、肺、肝等恶性肿瘤中被证实[38-39]。同样,也有临床相关的研究表明,CCAT2的表达在SCLC 的病理样本中明显增加,且其与SCLC的转移情况和糟糕预后呈正相关。与其相关的基础研究也表明,CCAT2能够增加SCLC 生长和转移能力[40]。其他实验还证实,在肺部肿瘤中,CCAT2的单核苷酸多态性和铂类化疗药物的敏感性有关[41]。因此CCAT2 在SCLC中可用作致癌基因和不良预后的指标。
2.5 CASC11 CASC11 和CCAT2 相 似。CASC11 位 于8q24的荒漠区,其单核苷酸多样性rs16902359 和肿瘤相关,在结直肠癌中被认为通过hn RNP-K 相互作用并激活WNT/β-catenin通路促进肿瘤生长和转移[42]。Fu等[43]的研究发现SCLC 患者血浆转化生长因子β和CASC11的程度上调且呈正相关。生存分析则揭示了转化生长因子β和CASC11能预测SCLC 患者的预后,然而血浆CASC11 的浓度和临床分期无关;进一步的细胞实验则证实,CASC11能够促进转化生长因子β1的表达,并增加SCLC 细胞的干细胞特性。
2.6 BLACAT1 BLACAT1位于1q32.1.位点。其最先在膀胱癌中发现表达增加[44],随后的研究证实在NSCLC、大肠癌、宫颈癌、胃癌、食管鳞状细胞癌等肿瘤中也表达增加[45]。在SCLC 的临床相关研究中发现,BLACAT1在肿瘤组织表达增加,且其水平与分期、肿瘤大小、广泛淋巴结转移、远处转移和预后不良呈正相关,多因素分析表明肿瘤组织BLACAT1表达量是SCLC 患者预后不良的独立预测因素[45];相关的细胞实验则证实BLACT1能够促进SCLC细胞的增殖、迁移和侵袭[45]。
2.7 SBF2-AS1 SBF2-AS1 位于人类染色体的11p15.1位点,其被认为和炎症、免疫和肿瘤形成有关[46]。SBF2-AS1最先在NSCLC 组织和细胞系中发现表达增高,且和淋巴结转移和组织学分级相关[47],随后胶质瘤、肝细胞癌中也发现SBF2-AS1的表达增加。而Zhang等[48]的研究也发现,SBF2-AS1 在SCLC 组织和细胞中表达增加,且SCLC肿瘤组织表达水平高于NSCLC。在SCLC 细胞系中抑制SBF2-AS1的表达则可以降低肿瘤细胞的增殖、迁移和迁移能力[48],因此,SBF2-AS1 可以作为一个SCLC 的促肿瘤形成lncRNAs。
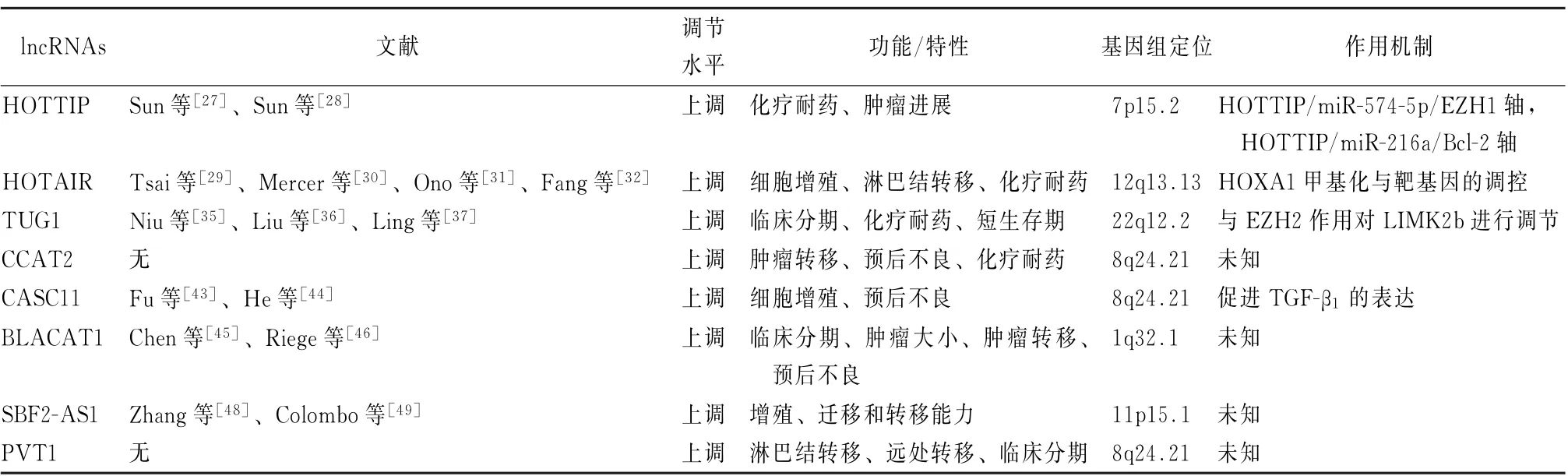
表1 参与小细胞肺癌发生和进展的7种lncRNAs信息
2.8 PVT1 PVT1和原癌基因myc有关,被认为是恶性肿瘤发生、发展的危险位点[49]。它能够促进肿瘤细胞的生长、抑制肿瘤细胞的凋亡[50-51]。PVT1 的作用过程涉及DNA 的重排、微小RNA 的编码和myc交互3个过程[52],但其具体作用过程还不甚明朗。高表达的PVT1能够促进肿瘤的侵袭和转移,临床样本也显示SCLC 组织中PVT1的表达程度和淋巴结以及远处转移相关,且PVT1的表达程度可能是预测SCLC患者生存时间的独立预测因子[51]。
随着生物科学和信息学的高速发展,以往被忽略的lncRNAs以功能体的形式被重新认识,它们参与到肿瘤形成和发展的各个过程中[3]。不断深入的研究发现越来越多的lncRNAs 通过不同的途径参与SCLC 的疾病进程(表1),且相关的临床研究已经发现这些lncRNAs的表达和SCLC的临床特征有联系,但其是否能用于临床诊断和作为治疗靶点还需要进一步探究。
截至目前,大多数SCLC 患者的预期生存期在诊断之后远小于1年,其5 年生存率远低于其他类型的肺癌[2]。SCLC早期诊断困难,针对SCLC 的治疗方案往往开始有效而迅速转向不敏感,且针对SCLC 的新治疗方案开发缓慢,这部分肺癌患者的诊断和治疗问题亟待解决。但是我们相信,随着新兴技术的开发与研究的投入,在SCLC 中继续深入研究,lncRNAs 会变得更加快速和精准,lncRNAs将在诊断、判断化疗敏感性、判断预后和治疗等方面为临床提供更好的诊疗思路与方案。
利益冲突所有作者均声明不存在利益冲突
