基于乙酸控制的L-苏氨酸发酵工艺优化研究
2020-10-12周旭波
周旭波,丁 鼎,刘 帅,王 威,王 健
(江苏澳创生物科技有限公司,江苏 无锡 214100)
L-苏氨酸是人体和动物体内的必需氨基酸之一,是构成蛋白的重要组成部分,人和动物自身不能合成,必须从食物中摄取。L-苏氨酸具有恢复疲劳、促进生长发育等多种生理功能,在饲料、食品和医药等行业都具有广泛的应用[1-2]。近几年,全球苏氨酸市场以每年20%多的增长率高速增长,L-苏氨酸的需求量也在逐年上升,苏氨酸也成为仅次于谷氨酸、赖氨酸和蛋氨酸的第四大产能的大宗氨基酸产品[3]。L-苏氨酸的生产方法目前主要采用微生物发酵法生产,利用发酵法生产L-苏氨酸,比传统的采用化学合成法和水解动物蛋白质提取法,具有生产成本更低、更加绿色环保等显著优越性[4-5]。随着基因工程技术的发展,研究者们利用基因工程技术成功构建了L-苏氨酸高产菌株,使L-苏氨酸生产技术得到不断进步和发展[6-8]。在苏氨酸高产菌株里,大肠杆菌由于遗传学清晰、基因操作简单、易于培养、周期短和培养条件粗放等优点,已成为直接法发酵生产L-苏氨酸的主要菌株[9]。
在大肠杆菌发酵生产L-苏氨酸的过程中容易产生乙酸等有机酸代谢副产物,乙酸作为大肠杆菌主要的有机酸副产物,会抑制菌体生长、减弱菌体活力、减少目的产物的合成、降低菌株生产能力[10],此外,大肠杆菌碳代谢流的10%~30%可转化为乙酸,造成碳源浪费,降低了发酵糖酸转化率,增加了生产成本,进而影响大肠杆菌发酵的生产能力[11]。乙酸的产生与细胞中的氧化磷酸化和三羧酸循环(Tricarboxylic acid cycle,TCA)有关,一般在两种情况下易产生乙酸:一是无氧条件或是供氧不足;二是供氧充足,但糖酵解碳代谢流与TCA碳代谢流不平衡[12]。为了减少大肠杆菌发酵过程中产生的乙酸,降低乙酸对发酵菌体产生的抑制作用,提高生产效率,近年来很多研究人员对此展开了大量研究:一方面利用代谢工程手段对菌体本身进行分子改造以减少乙酸的代谢合成[13];另一方面通过对发酵过程进行有效控制,主要包括发酵条件优化和对培养基的改善,对菌体培养基和代谢过程进行调节,使代谢流朝着有利的方向进行,降低乙酸生成,提高发酵水平[14]。以大肠杆菌ACThr1032为苏氨酸生产菌,利用响应面试验探索了不同的补糖量、补氮量及溶氧控制对大肠杆菌发酵苏氨酸产生副产物乙酸的影响,以减少大肠杆菌发酵副产物乙酸的生成,为大肠杆菌工业化生产L-苏氨酸提供一个可行方案。
1 材料和方法
1.1 材 料
1.1.1 菌 种
大肠杆菌(Escherichiacoli)ACThr1032,江苏澳创生物科技有限公司保藏菌种。
1.1.2 培 养 基
1) 活化斜面培养基:葡萄糖1 g/L,蛋白胨10 g/L,酵母浸出粉5 g/L,NaCl 2.5 g/L,琼脂20 g/L,pH 7.0~7.2,121 ℃灭菌20 min。
2) 种子培养基:葡萄糖40 g/L,(NH4)2SO42 g/L,KH2PO42 g/L,MgSO4·7H2O 1 g/L,酵母粉10 g/L,玉米浆干粉0.5 g/L,FeSO4·7H2O 2.8 mg/L,MnSO4·H2O 2.8 mg/L,pH 7.0~7.2,115 ℃灭菌20 min。
3) 发酵培养基:葡萄糖40 g/L,(NH4)2SO41.8 g/L,KH2PO43 g/L,MgSO4·7H2O 2 g/L,酵母粉1 g/L,玉米浆干粉1 g/L,FeSO4·7H2O 80 mg/L,MnSO4·H2O 80 mg/L,pH 7.0~7.2,115 ℃灭菌20 min。
1.1.3 仪 器
30 L自动发酵罐,上海百仑生物科技有限公司;高效液相色谱仪,安捷伦科技有限公司;SBA-40C生物传感分析仪,山东科学院生物研究所。
1.2 方 法
1.2.1 培养方法
1) 斜面活化培养:取保藏菌种划线接种于活化斜面,37 ℃培养15~18 h。
2) 摇瓶培养:从新鲜活化斜面上挑取2环大肠杆菌于种子培养基中,500 mL三角瓶装液量30 mL,置于旋转式摇床上,200 r/min,37 ℃振荡培养至光密度OD为12~14。
3) 30 L发酵罐发酵培养:将培养结束的摇瓶种子按10%体积分数的接种量接入发酵培养基中。初始通气量10 L/min,搅拌转速为300 r/min,通过自动流加氨水控制pH在7.0左右,培养温度36.5 ℃。培养过程中,流加5%质量分数的有机氮源补充培养基,当溶氧降低至一定值时交替提高转速和通气量,当发酵液中葡萄糖质量浓度降至一定值时,流加质量分数为80%的葡萄糖溶液。
1.2.2 分析检测方法
1) 菌体生长测定:发酵液用蒸馏水稀释20倍后,测定600 nm波长下的OD值。
2) 葡萄糖质量浓度测定:采用SBA-40C生物传感分析仪测定。
3) 苏氨酸质量浓度测定:高效液相色谱法[15]。
4) 乙酸质量浓度测定:高效液相色谱法[15]。
1.2.3 试验方法
通过控制葡萄糖的流加速率可以调节大肠杆菌发酵过程中副产物乙酸的产生量[10];在发酵过程中流加精氨酸、琥珀酸和甲硫氨酸等氨基酸或富含氨基酸的酵母粉等有机氮源,可以降低大肠杆菌发酵过程中乙酸的积累量[16-19];发酵过程控制中溶氧控制对乙酸的生成也具有显著影响,供氧不足或缺氧可迫使糖进入混合酸发酵途径,使副产物乙酸大量积累。此外,溶氧控制与菌体生长和补料控制相互关联反馈,广泛用于控制大肠杆菌发酵过程中乙酸的生成[20-21]。
依据参考文献报道以及对前期大量试验数据和生产经验总结的基础上,选取大肠杆菌发酵培养过程中控制乙酸生成的3个关键因素,即平均补糖流量A、平均补氮流量B和溶氧控制值C,以发酵培养过程中产生的副产物乙酸的质量浓度R(g/L)为指标,进行单因素试验,确定响应面优化范围,然后根据单因素试验结果,进行三因素三水平的响应面试验,采用Box-Behnken Design(BBD)响应面试验设计法[22],所有试验均做3个重复取平均值,采用Design-Expert(Version 8.0.5)软件对响应面试验得到的数据进行线性回归和方差分析,模型及因素的显著性均通过P值进行考察,其中P<0.05时影响显著,以*表示;P<0.001时影响极其显著,以**表示。以响应面实验得到的最优试验方案为基础,探索最佳的补糖、补氮、溶氧控制策略,获得最佳的试验结果。
2 结果与讨论
2.1 平均补糖流量对苏氨酸发酵过程产生乙酸的影响
发酵控制过程中,补糖控制一般是根据发酵液中残糖质量浓度及耗糖速率来计算补糖流量来进行控制,经过试验数据经验积累,可以确定一个平均补糖流量,然后根据发酵液中残糖的质量浓度及耗糖速率围绕平均补糖流量进行调节控制,不同平均补糖流量对大肠杆菌发酵产生乙酸的影响见图1。由图1可知:平均补糖流量为0.3 L/h时大肠杆菌发酵生产的副产物乙酸最低,因此确定平均补糖流量为0.3 L/h。

图1 不同平均补糖流量对大肠杆菌发酵产生乙酸的影响
2.2 平均补氮流量对苏氨酸发酵过程产生乙酸的影响
苏氨酸发酵过程中,发酵起始培养基都会有一定量的有机氮源,有机氮源在菌种生长代谢过程中会逐渐消耗掉,补氮操作就是为了弥补发酵过程中有机氮源不足而进行的操作,通过发酵过程中的补氮操作可以避免发酵起始培养基中含有过高质量浓度的有机氮源,同时还能满足菌种持续生长代谢对有机氮源的需求,补氮控制一般是匀速流加或根据生长不同周期阶梯匀速流加,不同平均补氮流量对大肠杆菌发酵产生乙酸的影响见图2。由图2可知:平均补氮流量为20 mL/h时大肠杆菌发酵生产的副产物乙酸最低,因此确定平均补氮流量为20 mL/h。

图2 不同平均补氮流量对大肠杆菌发酵产生乙酸的影响
2.3 溶氧控制对苏氨酸发酵过程产生乙酸的影响
发酵过程中的溶氧控制一般通过设定溶氧DO电极测定的DO值在某一目标值范围内,通过调整搅拌转数或通风量来进行控制,不同溶氧控制值对大肠杆菌发酵产生乙酸的影响见图3。由图3可知:溶氧控制值设定为30%时大肠杆菌发酵生产的副产物乙酸最低,因此确定溶氧控制值的设定为30%。

图3 不同溶氧控制对大肠杆菌发酵产生乙酸的影响
2.4 响应面试验分析
设定平均补糖流量A为0.2~0.4 L/h,平均补氮流量B为10~30 mL/h,溶氧控制值C为20%~40%,采用Box-Behnken响应面法设计试验,以乙酸质量浓度R为考察指标(g/L)。试验因素编码和水平如表1所示,试验安排及结果如表2所示。

表1 响应面设计试验因素水平和编码

表2 响应面试验设计及结果
2.4.1 二次回归拟合和方差分析
利用Design Expert软件对表2数据进行多元二次回归拟合,响应值乙酸质量浓度R(g/L)与因素编码值(Coded factors)之间的函数关系为
(1)
响应值乙酸质量浓度R(g/L)预测值与各因素实际值(Actual Factors)之间的函数关系为
(2)
利用Design Expert软件对响应面二次模型进行方差分析及可信度分析,结果详见表3,4。由表3可知:该回归模型高度显著(P=0.000 3),失拟项不显著(P=0.167 7),说明模型拟合得较好。由表4可知:复相关系数的平方R2=0.963 72,说明模型拟合程度较好,模型的预测值和真实值高度相关,可以用其代替真实试验点进行预测。从表3中可以看出:各因素对目标值影响的显著性为A>C>B,尤其是因素A,其不同水平对乙酸质量浓度具有较明显的影响。
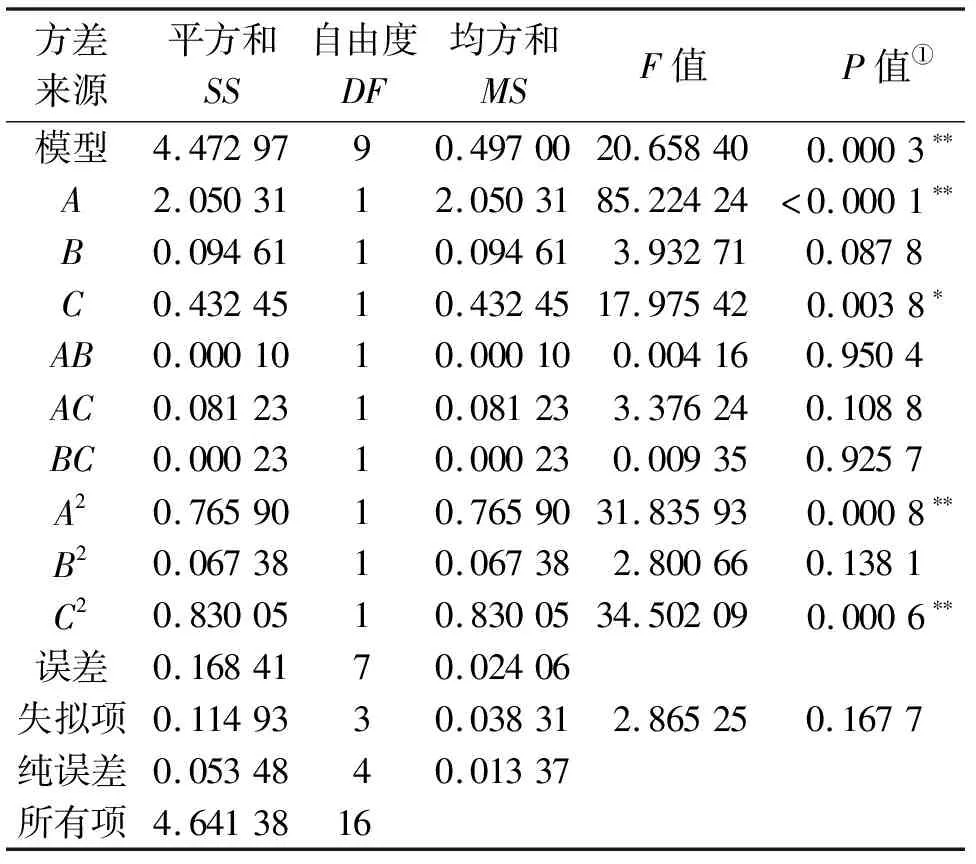
表3 回归模型的方差分析

表4 模型可信度分析
2.4.2 响应因子水平的优化
根据模型做出相应的响应曲面和等高线见图4。通过该组动态图对任何两因素交互影响乙酸产生的效应进行分析与评价,从而确定最佳因素水平。从图4中可以看出:平均补糖流量与平均补氮流量、平均补糖流量与溶氧控制、平均补氮流量与溶氧控制值两两交互作用,其中,平均补糖流量与平均补氮流量交互作用的等高线图形近乎圆形,表明平均补糖流量与平均补氮流量两因素之间的交互效应较弱,而平均补糖流量与溶氧控制值、平均补氮流量与溶氧控制值两两因素交互作用的等高线图形状近乎椭圆形,说明平均补糖流量与溶氧控制值、平均补氮流量与溶氧控制值两两因素之间存在着较为复杂的交互作用。从图4可以看出:实验因素对响应值的影响变化趋势以及回归模型确实具有最优响应值。利用设计软件进行岭脊分析,可以得到最优控制条件为:平均补糖流量为0.23 L/h,平均补氮流量为15.47 mL/h,溶氧控制值为33.78%,此时乙酸质量浓度最小预测值为0.468 g/L。为验证回归模型的可靠性,以响应面实验得到的最优培养方案进行了3次平行验证实验,试验得到的乙酸质量浓度的平均值为0.462 g/L,与预测值0.468 g/L吻合度较高,说明模型能较好地预测实际发酵产生乙酸情况。

图4 等高线图及响应面立体图
2.5 苏氨酸发酵控制方案优化
在响应面试验结果的基础上,进一步考察补糖流量和溶氧控制值之间交互作用对所产生副产物乙酸质量浓度的影响。在响应面试验水平的基础上进一步降低平均补糖流量的水平值,发现在平均补糖流量小于0.2 L/h时,DO值出现上升趋势,同时伴随着最大菌体OD值的下降,发酵液中产生的副产物乙酸的质量浓度进一步下降至0.4 g/L以下,意味着平均补糖流量进一步减少至影响菌体生长的程度,可以进一步降低产生的副产物乙酸的质量浓度,同时还提高了发酵液中的DO值,说明在溶氧充足的情况下,减少补糖的量可以有效降低发酵副产物乙酸的质量浓度。同时,在试验中发现补糖的量与发酵液中的DO值及菌体OD值存在一定的关联,在发酵一定时期后,补糖的量与菌体OD值正相关,与发酵液中的DO值负相关。为了降低发酵过程中副产物乙酸的质量浓度,一方面需要保持充足的溶氧,另一方面还需要保持一定的菌体OD值。因此,采用补糖与溶氧连锁控制:一方面根据发酵液中的残糖质量浓度,利用溶氧反馈进行补糖;另一方面还要保证菌体的生长OD值达到一定范围,使补糖的量稍低于菌体生长需求的补糖量。采用优化后的补糖控制策略,在30 L发酵罐中进行苏氨酸发酵培养30 h,经过3次平行发酵试验验证,试验结果见表5,苏氨酸发酵产酸3次试验结果的均值比优化前提高了23.15%。

表5 优化前后的发酵试验结果比较
3 结 论
在使用大肠杆菌发酵生产苏氨酸的过程中,副产物乙酸的产生,对菌体的生长和目标产物的合成都会造成较大影响,甚至会严重抑制发酵过程和产物合成。乙酸的产生与发酵培养基组分和菌体代谢密切相关。笔者选取大肠杆菌发酵培养过程中葡萄糖流加、有机氮流加、溶氧控制值3个关键因素进行响应面试验设计和分析,通过试验考察补糖、补氮及溶氧控制条件对大肠杆菌发酵产生副产物乙酸的影响,研究补糖、补氮和溶氧控制条件对苏氨酸发酵菌体生长和产物合成的影响。在响应面试验结果的基础上,进一步研究了平均补糖流量与溶氧控制值的交互作用,采用溶氧反馈的亚适量补糖控制策略,在此控制条件下,30 L发酵罐培养30 h,苏氨酸产量比优化前提高了23.15%。研究对苏氨酸的工业化生产具有一定的指导意义。在试验过程中,发现补糖控制与溶氧控制、补糖控制与补氮控制、菌体生长的控制同副产物乙酸的富集、苏氨酸产酸和转化率之间具有较为复杂的交互作用,需要通过试验进一步研究。
