多巴胺受体4对肝癌细胞增殖转移的影响及预后
2020-10-12张红英潘家浩王冬音周晓爽元云飞曾维安陈东泰
严 俨 ,张红英,潘家浩,王冬音,周晓爽,元云飞,曾维安,陈东泰
(中山大学肿瘤防治中心//华南肿瘤学国家重点实验室//肿瘤医学协同创新中心,1.麻醉科,2.肝胆外科,广东广州 510060;3.惠州市中心人民医院麻醉科,广东惠州 516001;4.惠州市中医医院,广东惠州 516001)
肝细胞癌(hepatocellular carcinoma,HCC)在全球每年约出现70 万例新增病例,其中大部分发生在亚洲,而在某些地区,死亡率与发病率的比值接近1,如今肝癌已经成为全球威胁性疾病[1-3]。现阶段,早期肝癌的主要治疗仍然是根治性手术,然而,肝癌早期诊断困难,一旦错过手术时机,只能依靠非手术治疗,其中一种确切有效的治疗途径就是分子靶向治疗[4-5]。多巴胺受体分为D1 类(DRD1、DRD5)和D2 类(DRD2、DRD3、DRD4)受体并具有不同的理化特性[6],这些年来,有关多巴胺受体对不同类型肿瘤发生发展影响的报道日益增多,如:DRD1 表达阳性的乳腺癌病人预后较差[7],已有报道证明多巴胺受体抑制剂不仅能够通过诱导肿瘤干细胞分化而终止肿瘤细胞的自我更新[8],而且还可以通过抑制AKT 信号通路从而导致乳腺肿瘤的生长受限[9],而DRD2 不仅在胰腺癌病人中的表达增加,而且其相关的阻滞剂可以抑制ERK 信号通路的激活,从而限制肿瘤进展[10];ERK 作为MAPK 家族成员之一,已有大量研究证明其功能的激活可影响多种肿瘤细胞的生物学特性[11-12]。多巴胺受体与肝癌的关系已有报道,DRD2 激动剂可以有效抑制肝癌细胞的增殖和转移[13],DRD4 与DRD2 同为D2 类受体,但肿瘤相关研究相对比较少见,而DRD4 对肝癌包括预后以及治疗相关的报道仍然没有。本次研究旨在尝试探讨DRD4 是否可以用于预测肝癌患者预后,以及DRD4 对肝癌细胞的作用,从而初步揭示DRD4 在肝癌发生发展中扮演的角色,并为以后更深层次的研究打下基础。
1 材料与方法
1.1 肝癌组织样本
本研究经中山大学肿瘤防治中心临床研究伦理委员会(中国广州)批准,并获得受试者的知情同意。本研究使用了196 例HCC 患者的组织样本做免疫组化检测,以及收取74 例患者的肝癌组织和相邻非肝癌组织做real time qPCR 检测。所有患者都是在2003 年至2008 年间在中山大学肿瘤防治中心(中国广州)肝胆外科接受了同一位外科医生执行的原发性肝癌切除术。其中男168 人,女28 人,平均年龄49.7 岁(20~79 岁)。中位随访期为54 个月(1~127 个月)。
1.2 肝癌细胞系
人肝癌细胞株包括MHCC-97H、MHCC-97L、Hep-3B、SK-Hep-1、PLC-8024、Huh7、Hep-G2 以及非肝癌细胞(Miha)均来自中科院上海细胞库。细胞培养基采用混匀100 mL/L 胎牛血清(GIBCO,USA)的DMEM(GIBCO,USA)并内含0.1 g/L 青霉素以及0.1 g/L streptomycin,细胞培养箱保持37 ℃恒温,CO2浓度体积比为5%,湿度为85%。细胞培养至3~6 代作为实验材料。
1.3 试 剂
DRD4 抗体(LS-C22901),购自LifeSpan(USA);EnVision 免疫组化超敏试剂盒(Cat.NO:GK500710),购自Gene Tech;Dimethyl Sulfoxide(DMSO,20-139),DRD4激动剂PD-168077(P233)以及DRD4 阻滞剂L-745870(L131),购自Sigma(USA);Cell Counting Kit-8(CCK-8)试剂盒从同济化工研究所购置;ERK 抑制剂PD98059(S1177)购自Selleck(USA);ERK(4695S),p-ERK(4370S)以及抗兔二抗购买自Cell signaling technology(USA)。
1.4 免疫组化
用100 mL/L 福尔马林固定HCC 患者的组织标本,用石蜡包埋后进行连续切片备用。组织玻片经过2 h 60 ℃烘烤并脱蜡后,使用酒精梯度水化并用30 mL/L H2O2封闭45 min。在柠檬酸缓冲液(pH 6.0)中使用中高火微波5 min 以及中火15 min 修复抗原,4 ℃DRD4 抗体孵育过夜,一抗稀释液为阴性对照;多次PBS 清洗抗体后,37℃温箱孵育二抗30 min,DAB 试剂套装(DAKO,Car⁃pinteria,CA)显色并用苏木素染细胞核。显微镜下进行检测。两位经正规培训的病理科医生采用双盲法并根据德国免疫反应评分(IRS)对结果进行评估。根据染色强度,将DRD4 蛋白染色分为:0=无染色,1=染色弱,2=染色中等,3=染色强。另外,肿瘤阳性组织的百分比分别为0(<10%)、1(10%~25%)、2(26%~50%)、3(51%~75%)、4(>75%)。将两个评分相乘,并对每个病例进行加权评分,确定结果分为两组:≥2 分定为DRD4 高表达,<2 分为DRD4 低表达[14-15]。
1.5 实时定量PCR
实时定量PCR(real-time quantitative PCR,Real time qPCR)实验按照说明书操作步骤使用TRIzol(Invitrogen,Carlsbad,CA)从HCC组织以及细胞系中提取RNA。采用PrimeScriptRT 试剂盒(Takara,Dalian)进行逆转录得到cDNA。以GAPDH 为内源性对照,GADPH 和DRD4 的特异性引物序列(Invitrogen)见表1。使用SYBR Green qPCR Super Mix 和ABI7900HT 序列检测系统运行程序进行反应并以每个反应曲线只有一个峰视为有效结果。
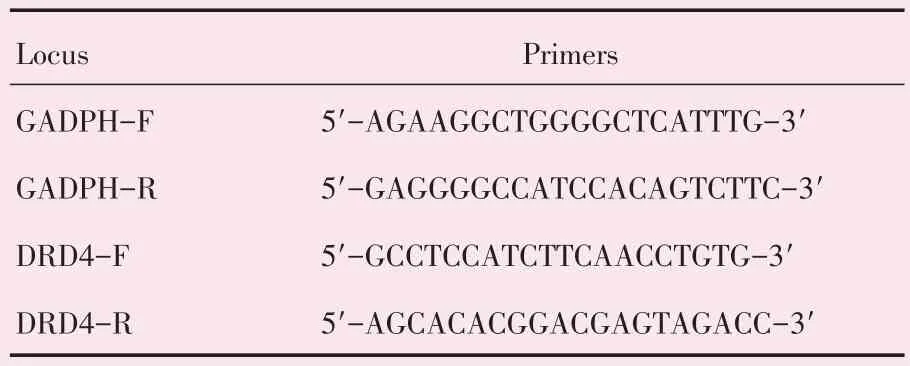
表1 用于Real time qPCR 的引物序列Table 1 Primer sequences used in the Real time qPCR
1.6 细胞增殖实验
参照肝癌细胞系Real time qPCR 的结果,选择合适的细胞株进行细胞增殖实验。根据实验需要共分8组,其中PD-168077(100、10、1 nmol/L)3 组,对照组1 组;L-745870(10、1、0.1 nmol/L)3组,对照组1 组。在96 孔培养板上接种细胞,每组5 个孔,每个孔6×103个细胞,总体积为100 μL;过夜后加入对应浓度的药物,对照组加入1 mL/L DMSO,经过24 h作用后每个孔加入10 μL CCK-8,细胞培养箱孵育2 h,使用酶标仪在450 nm(OD450)处检测各孔的OD 值。
1.7 蛋白免疫印迹实验
HCC 细胞分为3 组:Control 组,PD-168077(100 nmol/L)处理组以及L-745870(1 nmol/L)处理组,药物处理24 h 后,使用含蛋白酶抑制剂Cocktail Set I(Calbiochem)的细胞裂解缓冲液(Cell Signaling)提取蛋白,并根据BCA 蛋白检测试剂盒(Pierce)的说明书测定蛋白浓度。待测蛋白用100 mL/L 的SDS-PAGE 电泳完毕后便电转至polyvinylidene fluoride 膜(PVDF,Millipore)。一抗[(ERK(1∶1 000 稀释)、p-ERK(1∶1 000 稀释)]4 ℃孵育过夜后再用兔二抗(1∶5 000 稀释)室温孵育1 h。使用BeyoECL plus 发光液(Beyotime Bio⁃technology)发光并拍摄。
1.8 细胞迁移和侵袭实验
该实验通过Transwell 小室法测定,其中迁移实验使用具有8-μm 孔聚碳酸酯膜的小室(BD Bioscience,Becton,NJ),而侵袭实验则使用具有基质胶的小室(Corning,NY,USA)。将SK-Hep-1 的1×104个细胞分别加入含有PD-168077,L-745870和1 mL/L DMSO的无血清DMEM 的小室中,接着将小室放入含血清DMEM 的24 孔板中。培养箱孵育24 h 后,用棉签擦拭未转移的细胞,无水酒精固定穿过膜的细胞后使用结晶紫染色。显微镜下拍片并计数。
1.9 统计学方法
所有数据分析使用GraphPad 和SPSS 22.0 版本进行。卡方检验用于校验DRD4 与临床相关病理因素的关系。DRD4 预后生存分析通过使用Kaplan-Meier 法。Log-rank 和逐步Cox 回归分析法分别对所有预后因素进行单因素以及多因素分析。独立样本Student′st检验用来分析比较两组数据的差异;多组数据比较,采用One way-ANOVA 进行方差齐性分析,差异有统计学意义时采用Bonferroni 法进行两两比较,P<0.05 为差异有统计学意义。
2 结果
2.1 DRD4 蛋白在肝癌组织切片中的表达情况
组织切片免疫组化染色结果显示,在196 例肝癌组织中有85 例(43.4%)有DRD4 蛋白表达,表达定位主要在细胞浆中,而其余111 例(56.6%)则没有表达DRD4 蛋白,证明DRD4 蛋白在肝癌组织中表达比例较低;本研究根据染色强度以及面积,把免疫组化结果分为DRD4 高表达以及DRD4 低表达(图1)。
2.2 DRD4 mRNA 在肝癌以及非肝癌细胞株、肝癌组织以及相邻非肝癌组织中的表达情况
Real time qPCR 结果显示:在74 对肝癌以及非癌组织中,非癌组织中的DRD4mRNA(1.151±0.382)表达要高于癌组织(0.220±0.055;t=2.414,P=0.017;图2A);在蛋白和mRNA 表达水平上,DRD4在不同细胞株的表达中并不一致(图2B,C)。
2.3 DRD4 与HCC 术后患者预后相关临床病理因素的分析
由表2 的结果可见DRD4 的表达与患者年龄相关并差异具有统计学意义(P<0.05);而DRD4的表达与其他预后相关临床病理因素无显著相关性(P>0.05;表2)。
2.4 所有预后相关临床病理因素与肝癌术后患者无复发生存期以及总生存期的单因素分析
本课题引入已有的临床病理资料可能会影响患者完成肝癌切除术后的预后相关各种生理病理因素,而根据研究者的结果提示了乙肝表面抗原阳性、肿瘤大小、卫星结节、肿瘤分期、TNM 分期以及DRD4 的表达都与无复发生存期(recurrencefree survival,RFS)相关,除此之外,肿瘤大小、卫星结节、血管侵犯、肿瘤分期以及DRD4 的表达还与总生存期(overall survival,OS)相关(表3)。
2.5 196 例肝癌切除术后患者DRD4 表达与预后的生存分析
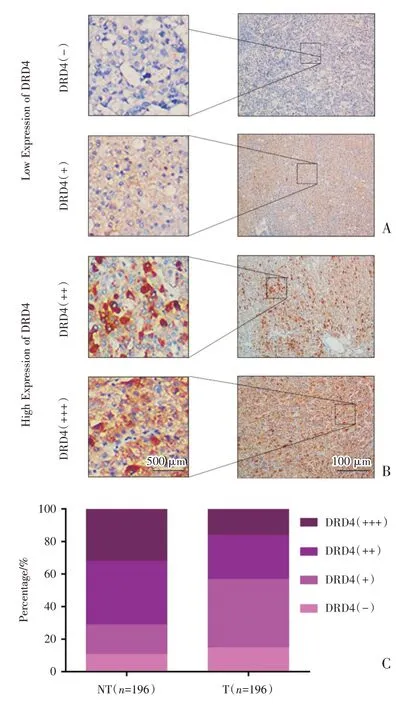
图1 DRD4 在肝癌组织中的表达Fig.1 Immunohistochemical staining of DRD4 protein expression in HCC
通过Kaplan-Meier 法进行的DRD4 与术后患者预后生存分析,DRD4 表达阳性患者的RFS 中位生存期为60(26.5~88.5)个月;OS 中位生存期为74(51~91.5)个月;DRD4 表达阴性患者的RFS 中位生存期为30(12~77)个月;OS 中位生存期为62(40~88)个月。研究者发现DRD4 在肝癌组织中表达高的患者包括RFS 和OS 都要比DRD4 表达低的患者生存期长,而且差异具有统计学意义(RFS 的χ2=5.235,P=0.022,图3A;OS 的χ2=7.866,P=0.005,图3B)。
2.6 影响预后的临床病理因素与肝癌术后患者RFS 以及OS 的多因素分析

图2 DRD4 mRNA 在肝癌与非癌组织以及肝癌细胞系中的表达Fig.2 DRD4 expression in tumor(T)tissues,non-tumor(NT)tissues and HCC cell lines
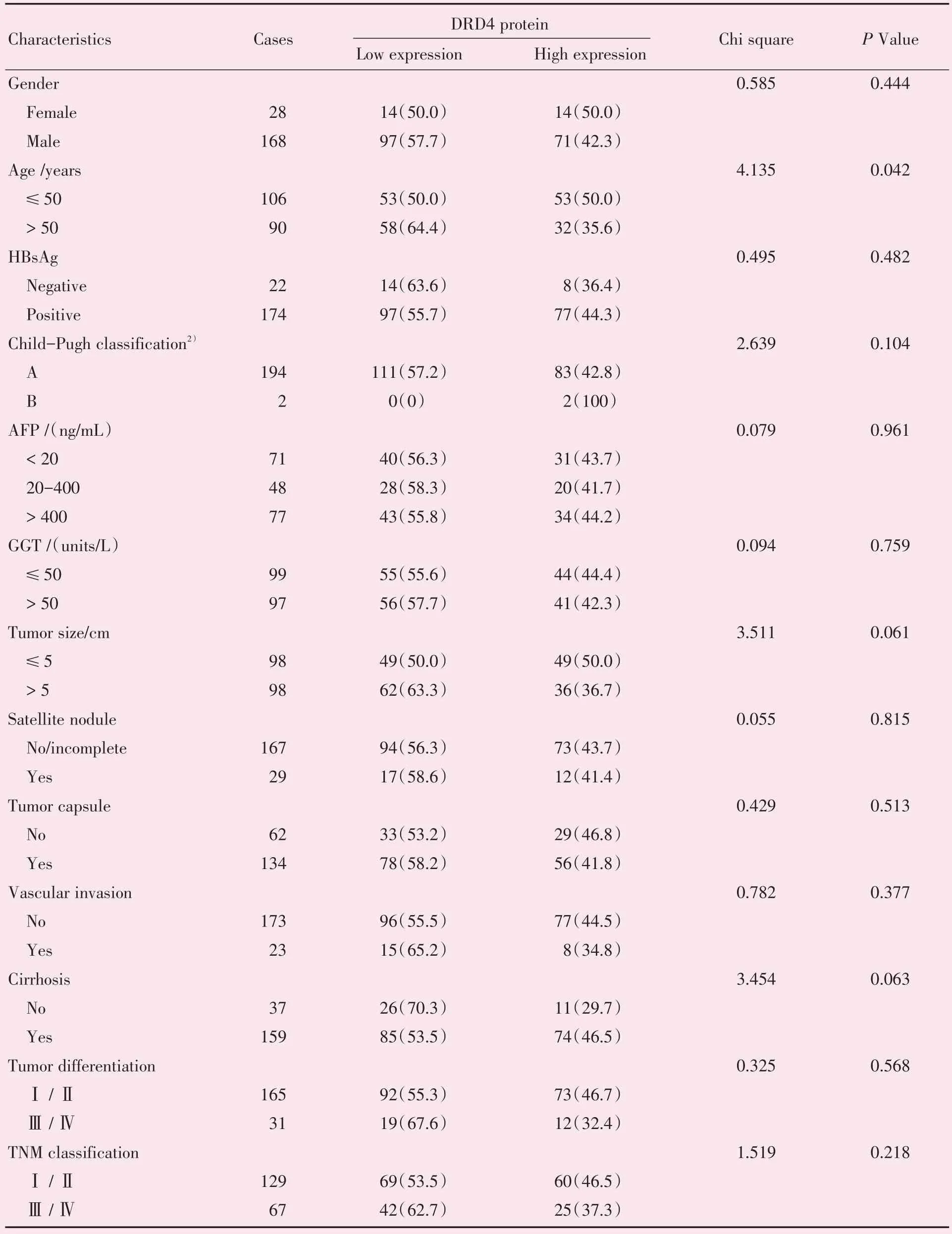
表2 196 例肝癌组织DRD4 表达与临床病理因素的关系Table 2 DRD4 expression and clinic pathological characteristics of 196 HCC1)[n(%)]

表3 196 例肝癌切除术后患者无复发生存期以及总生存期的单因素分析Table 3 Univariate analyses of RFS and OS rates for 196 HCC patients after curative

图3 DRD4 表达水平与肝癌切除术后患者预后的生存分析Fig.3 DRD4 expression in correlation with RFS and OS of HCC patients after curative resection by Kaplan-Meier survival analysis
通过逐步Cox 多因素回归分析所知的与RFS以及OS 预后相关的临床病理因素包括乙肝表面抗原阳性、肿瘤大小、卫星结节、血管侵犯、肿瘤分期、TNM 分期以及DRD4 表达水平等。研究者发现DRD4 表达水平是影响肝癌切除术后患者RFS以及OS 的独立预后因素(P<0.05),另外乙肝表面抗原、肿瘤大小以及卫星结节是影响患者RFS 的独立因素,而肿瘤分级是影响患者OS 的独立预后因素(P<0.05;表4)。
2.7 细胞增殖实验
根据肝癌细胞系DRD4 的表达情况,选择SKHep-1作为实验细胞株,结果表明经过24 h的DRD4激动剂PD-168077 处理后,细胞增殖受到抑制,并随药物浓度梯度递增,其中100 nmol/L 浓度抑制明显(t=4.834,P<0.001);而经过DRD4 阻滞剂L-745870 的处理后,研究者发现细胞增殖在药物浓度0.1nmol/L 以及1 nmol/L 的时候有不同程度的升高,而且1 nmol/L 浓度L-745870 的效果更加显著(t=5.212,P<0.001),而当使用10 nmol/L 浓度处理细胞后,细胞增殖不明显(图4)。
2.8 细胞迁移和侵袭实验
根据不同浓度PD-168077 和L-745870 对SK-Hep-1 增殖的影响,选择100 nmol/L 浓度的PD-168077 和1 nmol/L 浓度的L-745870 进行细胞迁移(Migration)和侵袭(Invasion)实验。结果显示PD-168077 能显着抑制SK-Hep-1 的Migration(t=6.313,P=0.002)以及Invasion(t=3.051,P=0.045);而L-745870 则出现相反的结果并明显促进SKHep-1 的Migration(t=9.443,P<0.001)以及Inva⁃sion(t=4.049,P=0.014;图5)。
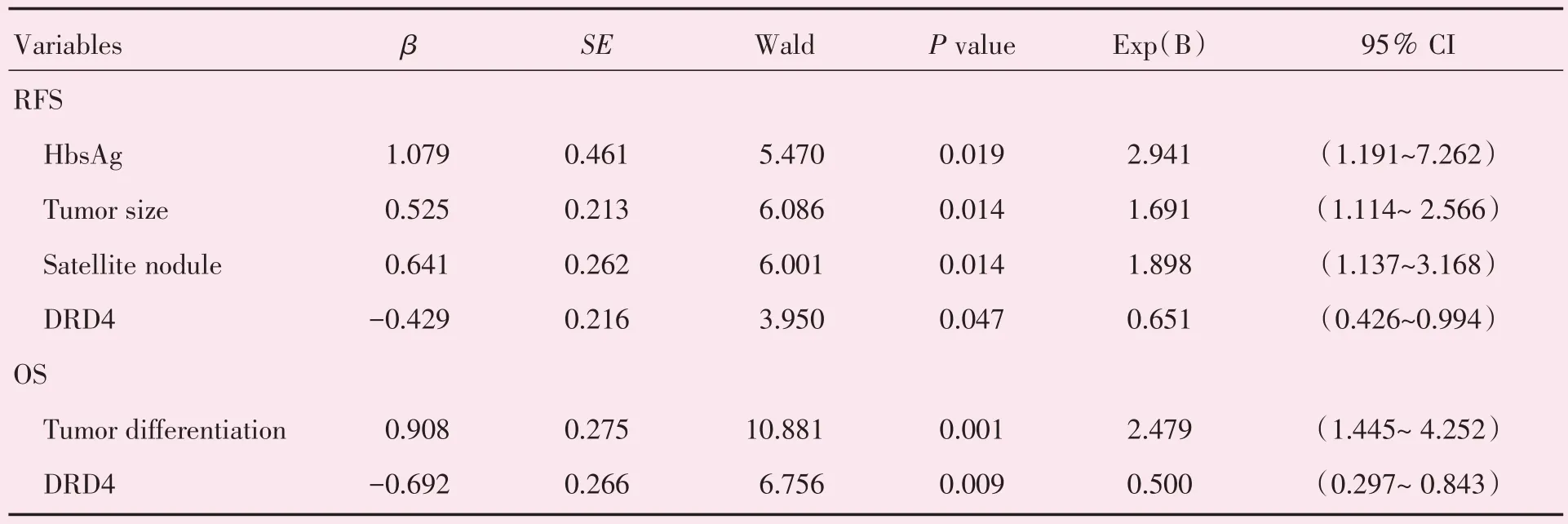
表4 196 例肝癌切除术后患者无复发生存期和总生存期的逐步Cox 多因素回归分析Table 4 Cox multivariate analysis of prognostic factors to RFS and OS in 196 HCC patients after curative resection
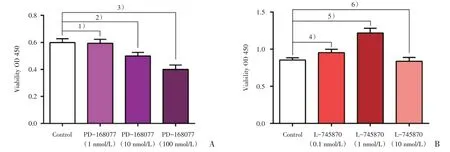
图4 PD-168077 与L-745870 对SK-Hep-1 增殖的影响Fig.4 The influence on proliferation of SK-Hep-1 after treatments with PD-168077 or L-745870
2.9 DRD4 可能通过ERK 信号通路影响肝癌细胞功能
通过查询KEGG 信号通路数据库得知DRD4可调节MAPK 信号家族,而ERK 是MAPK 家族中重要的一员。Western blot 结果显示PD-168077 抑制ERK 蛋白的磷酸化(t=3.318,P=0.032),而L-745870 则可促进ERK 蛋白的磷酸化(t=3.734,P=0.019);而使用ERK 抑制剂PD98059(10 μmol/L)可以逆转L-745870(1 nmol/L)的效应,提示DRD4可以通过调节ERK 信号通路的活动从而影响肝癌细胞的功能(图6)。
3 讨论
学习已有的研究,我们发现多巴胺受体与肺癌、乳腺癌、胃癌等涵盖在内的多种肿瘤的增殖转移等生物学特性有关,然而现有的研究对象多为DRD1、DRD2[7,10,13,16-21]两种受体,而DRD4 与肿瘤相关的研究较少,据我们所知,DRD4 涉及肝癌的研究尚未见有报道,本研究首次尝试探讨DRD4与肝癌术后患者的预后关系以及对肝癌细胞增殖转移等生物学行为的影响。
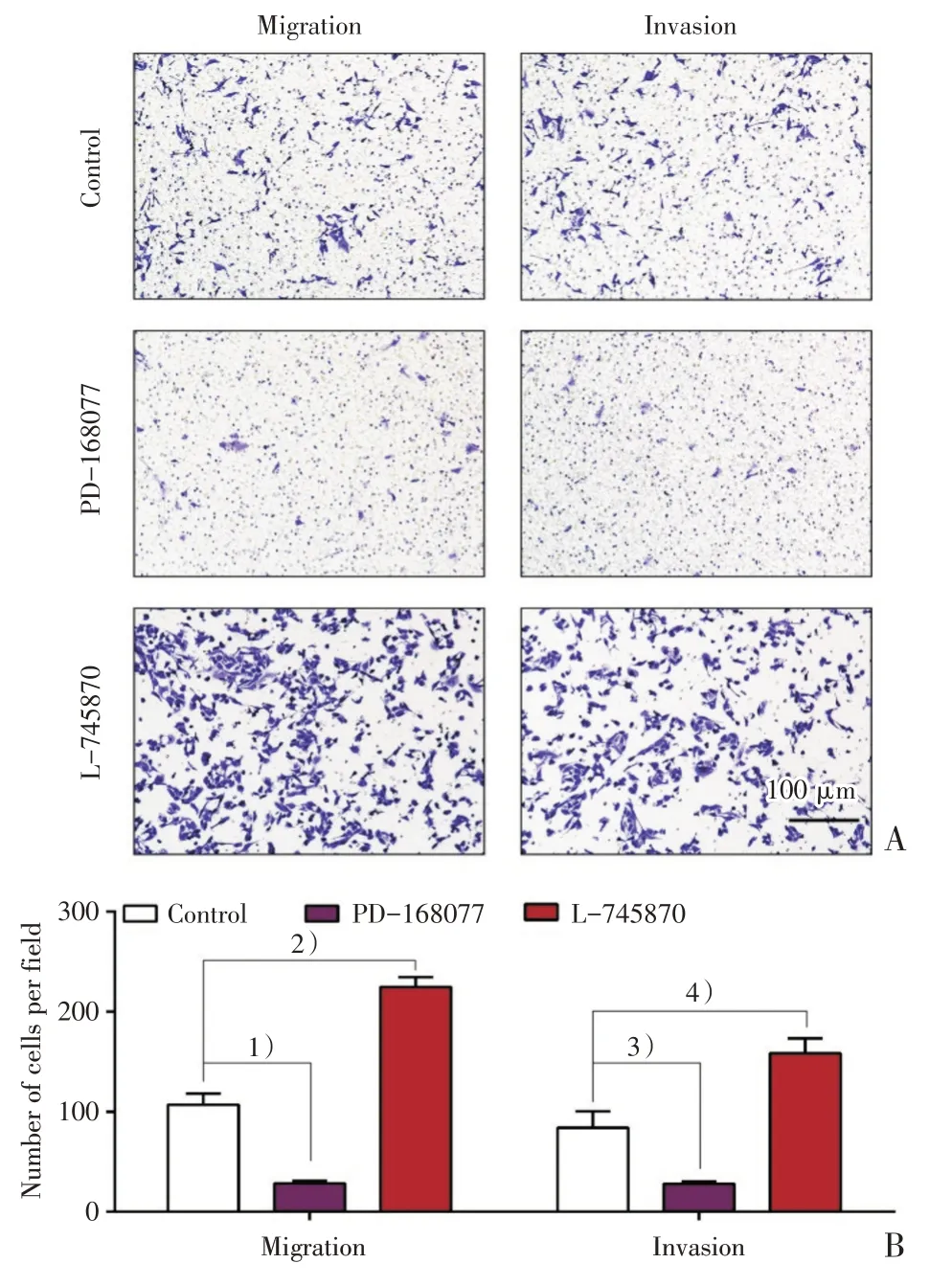
图5 PD-168077 与L-745870 对SK-Hep-1 迁移和侵袭的影响Fig.5 The influence on migration and invasion of SKHep-1 after treatments with PD-168077 or L-745870

图6 PD-168077 与L-745870 调节ERK 信号通路Fig.6 DRD4 might regulate the activities of HCC cells via ERK signaling pathway
通过免疫组化检测肝癌组织切片,我们发现DRD4 蛋白在肝癌中的表达比例较低(43.4%),除此之外单因素分析结果显示DRD4 高表达患者的RFS 和OS 均比低表达的患者显著延长(P<0.05),而且多因素分析结果提示DRD4 更是与肝癌切除术后患者OS 预后相关的独立因素(P<0.05)。另外Real time qPCR 结果显示DRD4 mRNA 在肝癌组织中的表达要低于相邻非肝癌旁组织,由此可知DRD4 从蛋白水平以及mRNA 水平在肝癌组织中都是处于低表达,而且非肝癌细胞株Miha 与肝癌细胞系相比较DRD4 mRNA 表达较高,这些结果都提示了DRD4 在肝癌中可能是一个潜在的抑癌分子。而细胞增殖、迁徙和侵袭实验结果更是验证我们的猜想。
通过查询KEGG 信号通路数据库得知在神经系统中DRD4 可通过抑制腺苷酸环化酶的催化活性,减少cAMP 合成,cAMP 作为信号传递中的第二信使可以调控MAPK 家族信号通路,最终影响细胞的各种行为特性等,其中ERK 分子是MAPK 家族信号通路分子中的重要成员,该信号通路分子参与调控细胞的多种生物学特性其中包括肿瘤细胞的增殖、凋亡、迁徙、侵袭和血管生存等行为[14,22-24]。Dolma 等人发现DRD4 阻滞剂可以抑制ERK 信号通路,从而阻碍胶质瘤干细胞的增殖自噬等[25];而本次研究的结果发现DRD4 的激动剂和阻滞剂可以抑制或者激动ERK分子磷酸化,调控ERK 信号通路,可能从而影响肝癌细胞的恶性生物学行为,该结果与已有的报道不一致,可能的原因是多巴胺受体在不同的肿瘤类型和细胞类型扮演的角色是不一样,例如:DRD2 在脑胶质瘤以及在肺癌中起到的作用是相反的[16,26];多巴胺可以促进胆管癌细胞增殖[27],也可以抑制胶质瘤的生长[28]。然而,肿瘤的发生发展机制及其复杂,仍需进一步的研究明确具体的原因。
综上所述,DRD4 在肝癌组织中高表达预示着患者有更好的预后,有可能成为独立预测患者无复发生存期以及总生成期的分子标志物。DRD4的激动剂和阻滞剂可以通过调节ERK 信号通路相应增强或者减弱肝癌细胞增殖、迁移和侵袭的能力,预示着DRD4 可能可以成为肝癌靶向分子治疗的作用靶点。本次研究的结果可以为肝癌患者提供新的治疗思路。
