甲状腺乳头状癌雌激素受体β表达及其5′非翻译区甲基化
2020-10-12许琳婉刘智敏
苟 茜,许琳婉,刘智敏
(重庆医科大学分子医学与肿瘤研究中心,重庆 400016)
甲状腺乳头状癌(papillary thyroid carcinoma,PTC)是一种常见的内分泌恶性肿瘤,占甲状腺癌的85%~90%[1-4]。流行病学研究发现,PTC 的发病率逐年增加,女性发病率约为男性的3 倍,这表明雌激素与PTC 的发生发展密切相关[5-6]。雌激素受体β(estrogen receptor β,ERβ)属于类固醇受体,可介导雌激素的生理功能[7]。我们前期研究发现,ERβ对PTC 细胞增殖、侵袭和迁移有抑制作用,但与正常甲状腺相比,ERβ在PTC 中表达水平较低[8],因此我们将进一步探讨ERβ在PTC 中低表达的原因及其机制。ERβ基因存在两种不同的启动子(启动子0K 和启动子0N),可转录生成两种含有不同5′非翻译区的异构体,即ERβ mRNA(0K-1)和ERβ mRNA(0N-1),由外显子0K和外显子0N 可变剪接至外显子1 产生[9]。在启动子0K 中,大小为295(-137~+158)bp 的区域,包含15 个CpG 位点。在启动子0N 和外显子0N 中,大小为509(-211~+298)bp 的区域,包含45 个CpG 位点[10]。在癌症发生发展过程中,CpG 岛甲基化可引起基因沉默,抑癌基因启动子超甲基化则会促进肿瘤发展[11]。已有研究证实,ERβ作为抑癌基因,可在PTC 中抑制肿瘤细胞增殖、诱导肿瘤细胞凋亡,进而抑制肿瘤发生发展[12]。但ERβ在PTC 中的甲基化状态研究仍未见报道,因此,我们将进一步分析ERβ5′非翻译区CpG 岛在PTC中的甲基化状态。本实验拟通过检测正常甲状腺、结节性增生以及PTC 组织与细胞中ERβ蛋白表达、ERβ及其异构体mRNA 表达与ERβ基因5′非翻译区甲基化状态,并使用DNA 甲基化转移酶抑制剂5-aza-2′-deoxycytidine(5-aza-dC)处理细胞,进一步观察ERβ及其异构体mRNA 表达的变化。探讨ERβ在PTC 中低表达的原因及机制,有助于对PTC 的病理机制、临床诊断及治疗预后提供新思路。
1 材料与方法
1.1 细胞株与组织标本
研究使用人PTC 细胞株BCPAP 和正常甲状腺细胞株Nthy-ori3-1 由本实验室保存。培养于含10 g/L 胎牛血清、100 μg/mL 青霉素-链霉素的RPMI-1640培养基中,置于含有体积分数5%CO2、温度为37 ℃的细胞培养箱。常规培养,选取对数生长期细胞进行后续实验。收集2018 年6 月至2018 年12 月在重庆医科大学附属第二医院普外科进行手术后经病理诊断为PTC 的10 例PTC 肿瘤组织、取自甲状腺良性疾病患者的10 例结节性增生组织和10 例癌旁正常甲状腺组织。将所有组织标本包裹在铝箔中,并立即在液氮中冷冻直至后续实验分析。本研究标本收集经重庆医科大学伦理委员会批准,并征得患者知情同意。
1.2 主要试剂与仪器
1.2.1 主要试剂 胎牛血清、RPMI-1640 培养基、胰蛋白酶购自美国Gibco 公司;兔抗人ERβ和βactin 多克隆抗体和羊抗兔二抗购自美国Bioworld公司;RIPA 裂解缓冲液、SDS-PAGE 配胶试剂盒和BCA 试剂盒购自上海碧云天公司;免疫组化(S-P)法试剂盒、DAB 显色试剂盒购自北京中杉金桥公司;冷冻切片包埋剂购自美国Sakura 公司;HE 染色试剂盒购自上海碧云天公司;乙烯乙酸乙烯酯膜帽、RNA 提取试剂盒及逆转录试剂盒购自美国Invitrogen 公司;qRT-PCR 试剂盒购自美国ABI 公司;DNA 提取试剂盒、亚硫酸氢盐修饰试剂盒、多重PCR 试剂盒与凝胶回收试剂盒购自德国Qiagen 公司;DNA 甲基转移酶抑制剂购自美国Sigma 公司;DMSO 购自北京Solarbio 公司;PCR 引物由上海生工公司合成。
1.2.2 仪器设备 冷冻切片机购自德国Leica 公司;LCM 仪器和实时荧光定量PCR 仪购自美国ABI 公司。
1.3 Western Blot
收集细胞,使用RIPA 提取细胞总蛋白。聚丙烯酰胺凝胶电泳(SDS-PAGE)分离总细胞蛋白,并将其转移至PVDF 膜。5%脱脂奶粉封闭2 h,PBST 洗膜3 次,每次10 min。按比例稀释ERβ和β-actin 一抗,4 ℃孵育过夜。PBST 洗膜3次后,放入稀释后的二抗,孵育2 h。PBST 洗膜3 次,每次10 min。ECL化学发光显影,采集图像。采用quantity one 分析软件分析目的蛋白条带相对表达水平。
1.4 免疫组织化学染色与评分标准
使用链霉亲和素-过氧化物酶法(sreptavidinperosidase,SP)测定ERβ的表达。标本经10 %甲醛固定,石蜡包埋,4 μm 连续切片。放入二甲苯于烘箱脱蜡1 h,水化,抗原热修复,体积分数3 %H2O2覆盖整个组织切片,轻轻摇晃,孵育30 min。山羊血清室温封闭30 min。加入ERβ一抗,4 ℃孵育过夜。室温复温30 min 后,PBS 洗3 次,每次5 min。滴加生物素标记的兔抗人IgG,37 ℃孵育30 min。PBS 洗3 次,每次5 min。加入辣根酶标记链霉卵白素工作液37 ℃孵育30 min。DAB 显色,苏木精复染,脱水,二甲苯透明30 min,中性树脂封片。用PBS 替代一抗,作阴性对照。由两位病理科医师进行判定。每张切片在200 倍光镜下选取5 个视野。阳性细胞<5%为0、6%~25%为1、26 %~50 %为2、51 %~75 % 为3、>75 %为4。不显色为0、浅棕色为1、棕色为2、深棕色为3。采用Remmele 半定量评分(阳性细胞百分率×显色强度等级)。评分<6 为阴性,≥6 为阳性。
1.5 激光捕获显微切割
将冷冻的组织标本使用组织包埋剂包埋,在-16°C 冷冻切片机中切片,切片厚度10 μm,轻轻转移至PEN 膜载玻片上。将含有组织切片的载玻片在低温恒温器中干燥2 min 后,在冰盒中进行苏木精-伊红(HE)染色,以最大限度地降低RNase活性。将HE 染色后的载玻片放在激光捕获显微切割(laser capture microdissection,LCM)仪器的模块化平台上,调整照明对比度和放大倍数以获得最佳可视化效果。使用绘图工具选择正常、增生性和PTC 组织标本中的滤泡上皮细胞进行显微切割。在显微镜下检查捕获的所需细胞并转移到乙烯乙酸乙烯酯膜帽上,以进行再次确认。
1.6 RNA 提取、逆转录和qPT-PCR
使用RNA 提取试剂盒提取Nthy-ori3-1 细胞、BCPAP 细胞和从组织获得的滤泡上皮细胞中的RNA,逆转录成cDNA 后利用qRT-PCR 检测ERβ mRNA(0K-1)、ERβ mRNA(0N-1)和总ERβ mRNA表达水平。引物序列如下:ERβ mRNA(0K-1)上游引物:5′-AGTTACTGAGTCCGATGAATGT⁃GCTTG-3′,下游引物:5′-CTCAAAGATTCGTGGG⁃CAAGTATAATG-3′;ERβ mRNA(0N-1)上游引物:5′-CGGGAGACCCCCCCTAATGC-3′,下游引物:5′-CTCAAAGATTCGTGGGCAAGTATAATG-3′;总ERβ mRNA 上游引物:5′-TGGTCCATCGCCAGT⁃TATCA-3′,下游引物:5′-AGGTGTGTTCTAGCGA⁃TCTTGCTT-3′;GAPDH 上游引物:5′-GAAGGTG⁃AAGGTCGGAG⁃T-3′,下游引物:5′-GAAGATGGT⁃GATGGGATTTC-3′。以GAPDH 作为内参进行qRTPCR,反应条件为50 ℃2 min,95℃10 min;95 ℃15 s,60 ℃1 min(40 个循环)。使用公式2-ΔΔCT计算相对表达量。
1.7 DNA 提取和亚硫酸氢盐基因组测序
使用DNA 提取试剂盒提取Nthy-ori3-1 细胞、BCPAP 细胞以及从组织获得的滤泡上皮细胞中的DNA。使用DNA 修饰试剂盒对DNA(1μg)进行亚硫酸氢盐修饰后,行PCR 扩增,使用引物如下:启动子0K 上游引物:5′-GTTGGGGTTATTT⁃CGGGGTTGTT-3′,下游引物:5′-CCTCCAACAAA⁃ACAAACACATTCA-3′;启动子0N和外显子0N上游引物:5′-GTTATTATTTTTGTGGGTGGATTGG-3′,下游引物:5′-ACCTTACCTTCTCTAAAATAC-3′。PCR 产物行1.5%琼脂糖凝胶电泳,紫外灯下观察后,从凝胶上切下条带,纯化。对纯化的DNA进行测序。甲基化状态判断标准:CpG 岛中0%CpG 位点发生甲基化为未甲基化(-);1%~20%为低甲基化(+);20%~60%为中度甲基化(++);60%~100%为广泛甲基化(+++)。
1.8 DNA 甲基转移酶抑制剂处理
将Nthy-ori3-1 细胞和BCPAP 细胞以每孔5.0×105细胞(2.0 mL/孔)的密度接种在6 孔培养板上。培养过夜后,以1 μmol/L 的终浓度加入DNA甲基转移酶(DNA methyltransferases,DNMT)抑制剂5-aza-dC。每2 d 添加1 次含有5-aza-dC 的新鲜培养基。培养至第8 天,提取RNA。使用qRT-PCR 检测5-aza-dC 处理后Nthy-ori3-1 细胞和BCPAP 细胞中ERβ mRNA(0K-1)、ERβ mRNA(0N-1)和总ERβ mRNA 表达水平。使用DMSO载体处理对照组细胞。
1.9 统计分析
使用SPSS 18.0 统计软件和GraphPad prism 8软件进行分析,呈正态分布的计量资料以均数±标准差()表示。各项实验均重复3 次。两组均数间比较,数据呈正态分布且方差齐性采用t检验;多组间比较,数据呈正态分布且方差齐性采用单因素方差分析,两两比较采用Bonferroni 法,非正态分布或方差不齐采用Kruskal WallisH检验;计数资料采用例数的形式描述,采用Fisher 确切概率法进行数据分析。检验水准α=0.05,以P<0.05 为差异有统计学意义。
2 结果
2.1 ERβ在正常甲状腺细胞和PTC细胞中的表达
Western blot 检测正常甲状腺细胞Nthy-ori3-1和PTC 细胞BCPAP 中ERβ的蛋白表达。与Nthyori3-1 细胞相比,ERβ在BCPAP 细胞中的表达水平显著降低,差异有统计学意义(t=10.020,P=0.001;图1)。
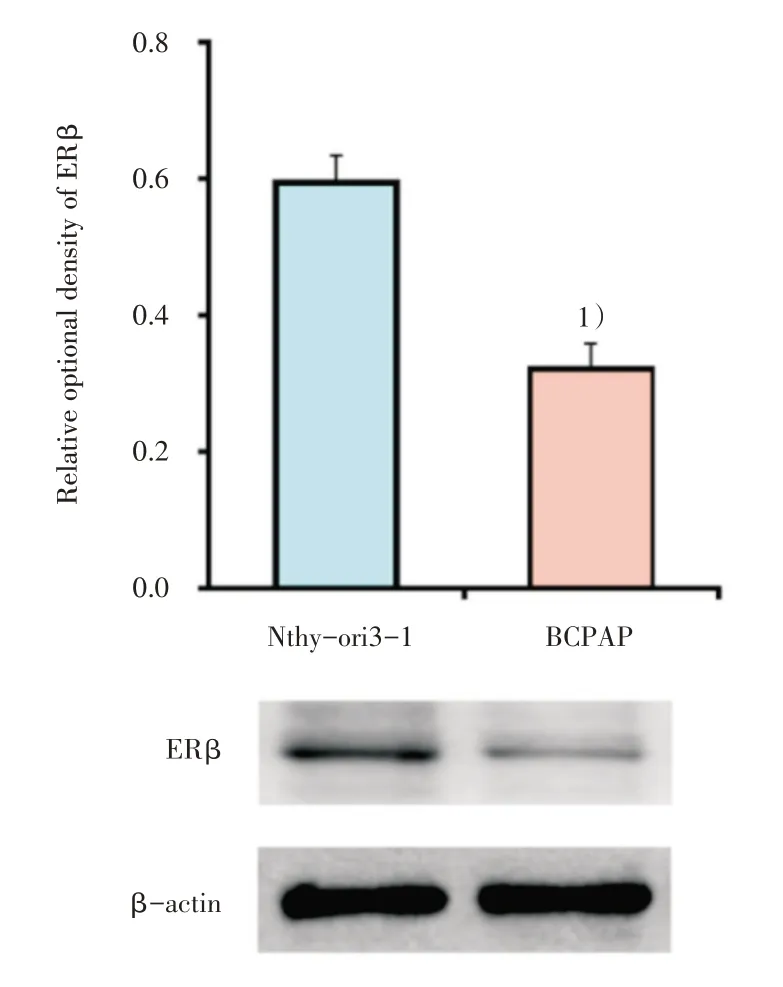
图1 ERβ在正常甲状腺细胞和PTC 细胞中的表达Fig.1 The protein expression of ERβ in human normal thyroid cells and PTC cells
2.2 ERβ在正常甲状腺组织、结节性增生组织和PTC 组织中的表达
免疫组化染色观察ERβ在正常甲状腺组织、结节性增生组织和PTC 组织的表达,结果显示,ERβ阳性表达数分别为5/10 例、3/10 例、0 例(图2A~C)。与正常甲状腺组织相比,ERβ在PTC 组织中的蛋白表达水平显著降低(Fisher′s exact,P=0.033)。ERβ蛋白表达水平从正常甲状腺组织、结节性增生组织到PTC 组织逐渐降低。
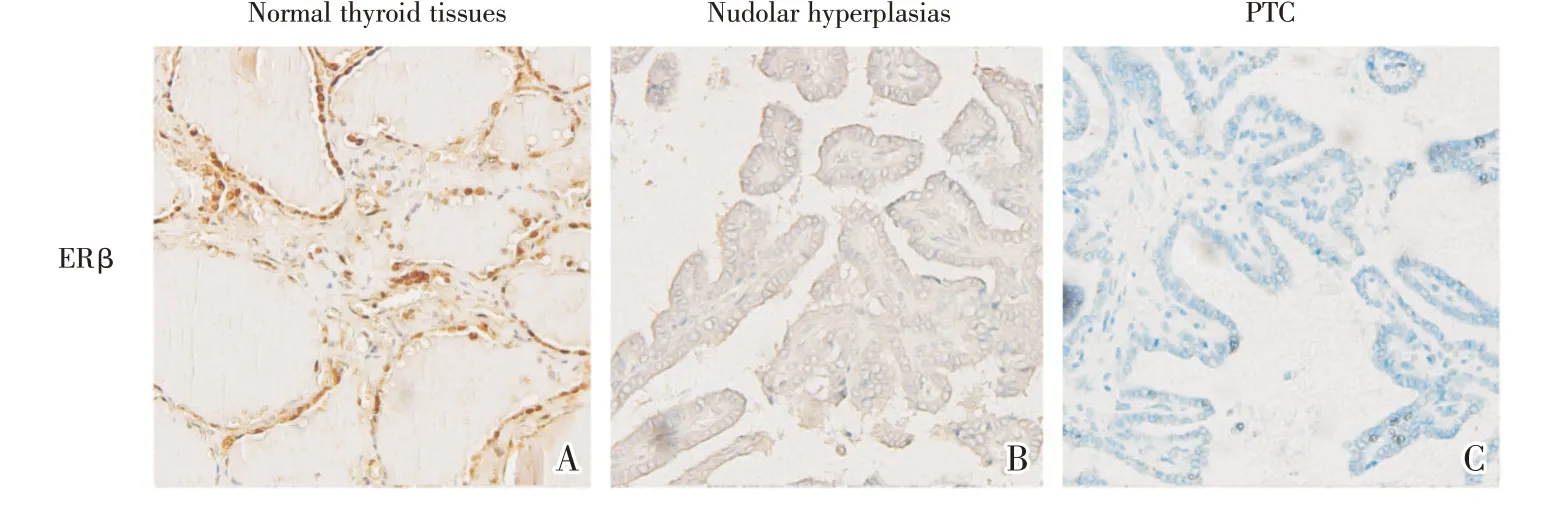
图2 ERβ在正常甲状腺组织、结节性增生组织和PTC 组织中的表达Fig.2 The expression of ERβ in tissue specimens of normal thyroid,nodular hyperplasia and PTC
2.3 ERβ mRNA 及其异构体在正常甲状腺细胞和PTC 细胞中的表达
如图3A 所示,ERβ5′非翻译区外显子0K 和外显子0N 可变剪接至外显子1 形成ERβ的两个异构体,即ERβ mRNA(0K-1)和ERβ mRNA(0N-1)[7]。qRT-PCR 检测正常甲状腺细胞Nthy-ori3-1和PTC细胞BCPAP 中ERβ mRNA(0K-1)、ERβ mRNA(0N-1)和总ERβ mRNA 的表达水平。结果显示,在Nthy-ori3-1 细胞和BCPAP 细胞中,ERβ mRNA(0N-1)与总ERβ mRNA 的表达水平都显著高于ERβ mRNA(0K-1)(F=132.510,P=0.000;F=75.056,P=0.000;图3B);ERβ mRNA(0K-1)在Nthy-ori3-1细胞和BCPAP细胞中的表达水平差异无统计学意义(t=0.568,P=0.600;图3B)。BCPAP 细胞中ERβ mRNA(0N-1)和总ERβ mRNA 的表达水平显著低于Nthy-ori3-1细胞(t=9.056,9.815,P=0.001,0.001;图3B)。结果说明,总ERβ mRNA主要由ERβ mRNA(0N-1)构成,与正常甲状腺细胞相比,ERβ mRNA(0N-1)与总ERβ mRNA 在PTC 细胞中的表达水平下调。
2.4 ERβ mRNA 及其异构体在正常甲状腺组织、结节性增生组织和PTC 组织中的表达
qRT-PCR 检测在从正常甲状腺组织、结节性增生组织和PTC 组织中提取的滤泡上皮细胞中ERβ mRNA(0K-1)、ERβ mRNA(0N-1)和总ERβ mRNA 的表达水平。如表1 所示,ERβ mRNA(0K-1)的表达水平在正常甲状腺组织与结节性增生组织间以及结节性增生组织与PTC 组织间比较,差异均无统计学意义(F=0.045,P=0.956;表1)。与正常甲状腺组织相比,ERβ mRNA(0N-1)和总ERβ mRNA 在结节性增生组织中表达水平显著降低(H=25.806,P=0.000;表1);与结节性增生组织相比,ERβ mRNA(0N-1)和总ERβ mRNA在PTC 组织中的表达水平显著降低(F=25.812,P=0.000;表1)。以上结果表明ERβ mRNA(0N-1)在总ERβ mRNA 中发挥主要作用,且ERβ mRNA(0N-1)和总ERβ mRNA 的表达水平从正常甲状腺组织、结节性增生组织到PTC 组织逐渐降低。
2.5 ERβ5′非翻译区在正常甲状腺细胞和PTC细胞中的甲基化状态

图3 ERβ mRNA 及其异构体在正常甲状腺细胞和甲状腺乳头状癌细胞中的表达水平Fig.3 The expression levels of ERβ mRNA and ERβ mRNA isforms in human normal thyroid cells and PTC cells
亚硫酸氢盐测序检测Nthy-ori3-1 细胞和BC⁃PAP 细胞中ERβ基因启动子0K、启动子0N 和外显子0N 的甲基化状态。如图4 和表2 所示,启动子0K CpG 岛在Nthy-ori3-1 细胞和BCPAP 细胞中未甲基化或低甲基化。启动子0N 和外显子0N CpG岛在Nthy-ori3-1 细胞中未甲基化或低甲基化,而在BCPAP 细胞中呈现中度甲基化状态。
2.6 ERβ 5′非翻译区在正常甲状腺组织、结节性增生组织和PTC 组织中的甲基化状态
亚硫酸氢盐测序检测从正常甲状腺组织、结节性增生组织和PTC 组织中提取的滤泡上皮细胞中ERβ基因启动子0K、启动子0N 和外显子0N的甲基化状态。如图5 所示,在所有组织中,启动子0K CpG 岛甲基化程度都较低,而启动子0N 和外显子0N 的CpG 岛甲基化程度较高。如表3 所示,在正常甲状腺组织中,启动子0K、启动子0N和外显子0N CpG 岛未甲基化(6/10,6/10)或低甲基化(4/10,4/10),无中度甲基化和高甲基化;在结节性增生组织中,启动子0K CpG 岛无中度甲基化和高甲基化,而启动子0N 和外显子0N CpG 岛有6/10 例中度甲基化和1/10 例高甲基化;在PTC组织中,启动子0K CpG 岛无中度甲基化和高甲基化,而启动子0N和外显子0N CpG 岛有4/10 例显示中度甲基化,以及5/10 例显示高甲基化。以上结果显示,启动子0N 和外显子0N 在ERβ基因CpG岛甲基化中占主导地位,且启动子0N 和外显子0N CpG 岛甲基化状态从正常甲状腺组织、结节性增生组织到PTC 组织逐渐增加。

表1 ERβ mRNA 及其异构体在各组中的表达Table 1 The expression levels of ERβ mRNA and ERβ mRNA isforms in tissue specimens of each groups [n=10,M(P25~P75)]
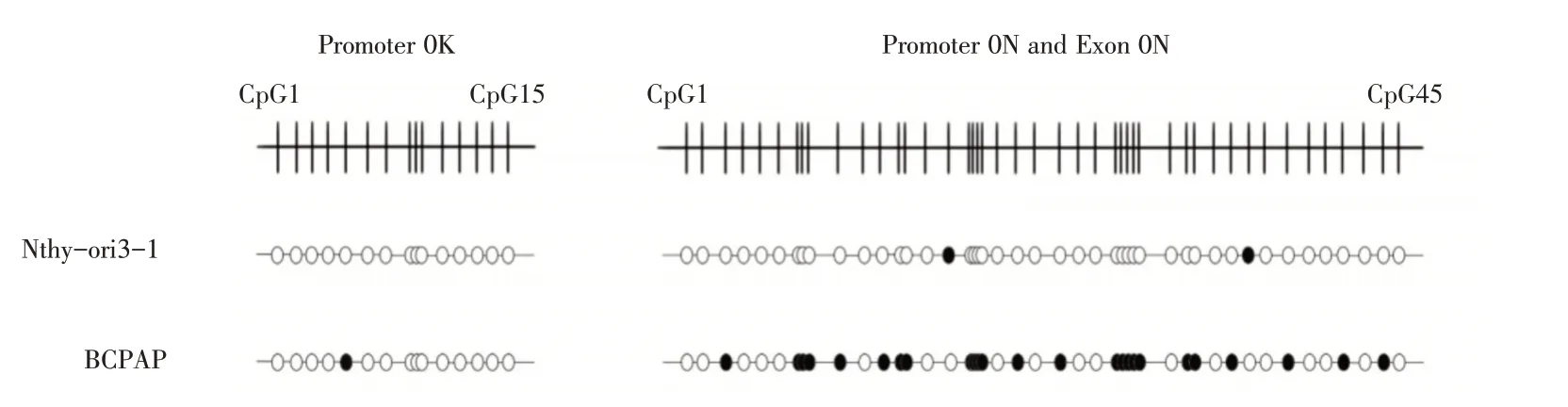
图4 ERβ5′非翻译区在正常甲状腺细胞和甲状腺乳头状癌细胞中的DNA 甲基化状态Fig.4 DNA Methylation status of ERβ 5′-untranslated region in human normal thyroid cells and PTC cells

表2 ERβ5′非翻译区在正常甲状腺细胞和甲状腺乳头状癌细胞中的DNA 甲基化状态Table 2 DNA Methylation status of ERβ 5′-untranslated region in human normal thyroid cells and PTC cells

图5 ERβ5′非翻译区在正常甲状腺组织、结节性增生组织和PTC 组织中的DNA 甲基化状态Fig.5 DNA Methylation status of ERβ 5′-untranslated region in tissue specimens of normal thyroid,nodular hyperplasia and PTC

表3 ERβ5′非翻译区在各组中的甲基化状态Table 3 DNA Methylation status of ERβ 5′-untranslated region in tissue specimens of each groups
2.7 DNA 去甲基化对ERβ mRNA 及其异构体表达水平的影响
应用DNA 甲基化转移酶抑制剂5-aza-2′-de⁃oxycitidine(5-aza-dC)处理Nthy-ori3-1 细胞和BCPAP细胞后,qRT-PCR结果显示,在Nthy-ori3-1细胞中,ERβ mRNA(0K-1)、ERβ mRNA(0N-1)和总ERβ mRNA 在两组间的表达水平差异均无统计学意义(t=0.998,0.160,0.159,P=0.374,0.880,0.881;图6A)。在BCPAP细胞中,ERβ mRNA(0K-1)处理前后的表达水平差异无统计学意义(t=1.054,P=0.351;图6B),而5-aza-dC 处理后的ERβ mRNA(0N-1)和总ERβ mRNA 表达水平显著高于未处理组(t=7.722,6.573,P=0.002,0.003;图6B)。结果说明,5-aza-dC 处理重新激活了BCPAP 细胞中ERβ mRNA(0N-1)与ERβ mRNA的表达,而对ERβ mRNA(0K-1)无影响。
3 讨论
已有研究表明雌激素对PTC 的发生发展具有刺激作用,其生物学作用主要由ERα和ERβ介导[13]。ERα可促进肿瘤细胞增殖和生长,与之相反的是,ERβ可抑制肿瘤细胞生长,并在PTC 中具有保护作用[14]。多项研究表明ERβ可作为肿瘤治疗的潜在靶标,因其对肿瘤细胞增殖有负调控作用,ERβ还可调节控制细胞进程与凋亡的基因来介导肿瘤发生发展,其丢失可能与癌变、预后不良以及对内分泌治疗抵抗相关[15-16]。我们课题组前期研究[8]发现,ERβ可抑制PTC 细胞增殖、侵袭和迁移,而肿瘤较大、存在甲状腺外扩散、淋巴结转移以及TNM 分期高(Ⅲ-Ⅳ)的甲状腺乳头状癌患者的ERβ蛋白表达水平较低。本研究实验结果表明,与正常甲状腺细胞及组织相比,ERβ蛋白表达水平以及ERβ mRNA(0N-1)和总ERβ mRNA 的表达水平在PTC 中明显下调,且从正常甲状腺组织到结节性增生组织再到PTC 组织逐渐降低,我们将进一步探讨这是否与其5′非翻译区CpG 岛甲基化相关。
DNA甲基化通常发生在胞嘧啶-鸟嘌呤(CpG)二核苷酸的胞嘧啶上,CpG 二核苷酸簇即CpG 岛,一般位于基因转录起始位点附近的启动子区域[17]。在肿瘤研究中常认为DNA 甲基化是一种阻止基因表达的表观遗传机制,DNA 高甲基化可抑制基因表达[18-19]。在正常细胞组织中未甲基化的CpG岛常在癌变过程中发生高甲基化,因此许多对DNA 甲基化的研究都聚焦于CpG 岛的甲基化状态[20]。例如,研究发现,腺瘤性结肠息肉病(ade⁃nomatouspolyposis coli,APC)基因启动子CpG 岛在结肠癌[21]、乳腺癌[22]等肿瘤中发生高甲基化。E-cadherin基因在乳腺癌[23]、卵巢癌[24]等肿瘤中转录沉默与其CpG 岛甲基化相关。本研究通过亚硫酸氢盐测序发现,ERβ启动子0N 和外显子0N CpG 岛在PTC 细胞和组织中的甲基化程度明显高于正常甲状腺,且其甲基化状态从正常甲状腺组织、结节性增生组织到PTC 组织逐渐增强,在PTC组织中最为广泛。由此可见,ERβ基因CpG 岛甲基化可能是引起ERβ表达在PTC 形成过程中逐渐降低的原因。
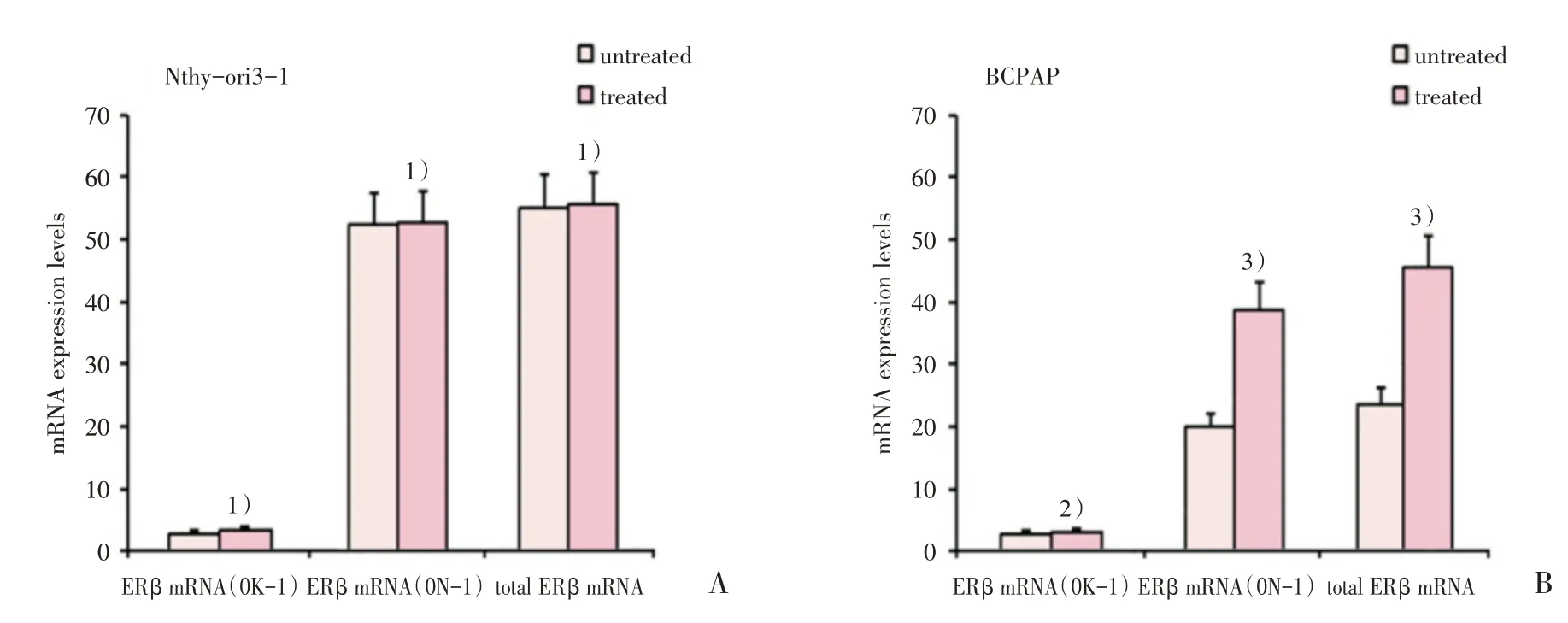
图6 DNA 去甲基化对正常甲状腺细胞和甲状腺乳头状癌细胞中ERβ mRNA 及其异构体的影响Fig.6 Effects of DNA demethylation on the expression levels of ERβ mRNA and ERβ mRNA isoforms in human normal thyroid cells and PTC cells
Suzuki 等[10]研究发现,在卵巢癌中,ERβ启动子0N 和外显子0N 高甲基化与ERβ1,ERβ2 和ERβ4 mRNA 表达缺失之间存在着显著的相关性。Al-Nakhle H 等[9]研究认为位于ERβ基因5′非翻译区的启动子0N 和外显子0N 异常DNA 甲基化可能参与乳腺癌的发生发展。与以上研究结果相似的是,本研究结果发现,启动子0N 和外显子0N CpG 岛在PTC 中广泛甲基化,而启动子0K CpG岛未甲基化或呈现低甲基化状态。应用DNA 甲基化转移酶抑制剂5-aza-dC 处理细胞后发现,5-Aza-dC 可恢复ERβ mRNA(0N-1)在PTC 细胞中的表达,但不能恢复ERβ mRNA(0K-1)的表达。这表明启动子0N 和外显子0N CpG 岛甲基化在ERβ基因低表达中占主导地位。DNA 甲基化过程主要由三种DNA 甲基转移酶(DNA Methyltrans⁃ferase,DNMT)(DNMT1、DNMT3a 和DNMT3b)介导,DNMTs 可催化甲基从S-腺苷甲硫氨酸转移至CpG 岛中的胞嘧啶[25-27],而PTC 中ERβ是否存在特异的DNMTs 和去甲基化酶目前尚无文献报道,需进一步研究探讨。
综上所述,ERβ常在甲状腺乳头状癌中低表达可能是其5′非翻译区CpG 岛甲基化引起的,尤其是启动子0N 和外显子0N CpG 岛广泛甲基化。DNA 甲基化转移酶抑制剂5-Aza-dC 可逆转ERβCpG 岛甲基化,这可为PTC 的基础研究与治疗预后提供新的研究方向。但ERβ发生DNA 甲基化的原因及机制仍不清楚,需要进一步深入研究。
