MiR-204-3p靶向EphB2调控非小细胞肺癌的作用机制
2020-10-12谢传华陈海龙郭守俊邱伊连潘宜云胡志苹
谢传华 ,陈海龙,黄 萍,郭守俊,邱伊连,王 硕,潘宜云,胡志苹
(1.赣州市肿瘤医院内一科,赣州江西 341000;2.赣南医学院生理教研室,赣州江西 341000)
肺癌是全球发病率与死亡率最高的恶性肿瘤,发病率呈逐年升高趋势,严重公众卫生健康[1-2]。肺癌病理类型主要分为非小细胞肺癌(non small cell lung cancer,NSCLC)与小细胞肺癌(small cell lung cancer,SCLC)[3]。其中NSCLC 占比约80%以上,是肺癌主要的存在形式,且NSCLC 易出现早期远处转移与侵袭的特点[4-5]。microRNA 是一类经典的非编码的单链小RNA,长度在22 个核苷酸左右[6-7]。microRNA 的存在非常广泛,可调控多项生命活动,且microRNA 在物种间高度保守,是目前肿瘤学领域研究的热点[8-9]。目前有多项研究表明,microRNA 与肺癌发生进展关系密切,深入研究microRNA 对探究肺癌分子机制具有重要意义[10-11]。有研究表明,miR-204-3p 可抑制大肠癌、胃癌、宫颈癌、和胰腺癌等[12-15]。miR-204-3p对肺癌的调控机制的研究罕见报道。EphB2 是一种络氨酸蛋白激酶受体,在癌症的进程中起重要的作用,研究指出该蛋白受miRNA 调控[16-18]。但目前尚无研究证实miR-204-3p 与EphB2 在NSCLC 中的调控关系。因此,本研究将明确miR-204-3p/EphB2 在NSCLC 中的作用及其机制,有助于丰富NSCLC 的发生发展机制,及为靶点治疗提供指导方向。
1 材料与方法
1.1 细胞株与主要试剂
非小细胞癌A549 细胞系购自美国ATCC 细胞库(Rockville,MD,USA),DMEM(Gibco,Life Technologies,美国),PGL3 载体(Genefarma,上海,中国),LipofectamineTM2000(Invitrogen,San Diego,美国),MTT 溶液(Sigma,美国),自动酶标读数仪检测(BIO-RAD,Cal,美国),Annexin V-FITC 凋亡检测试剂盒(4030ES20,Sigma,美国),GaliOS 型号流式细胞仪(Beckman Coulter,美国),Trizol(Invit⁃rogen,Calsbad,美国),兔多抗EphB2(ab252935,Abcam,美国),GAPDH(ab128915,Abcam,美国)。
1.2 实验分组
A549 细胞在DMEM 培养,加入10% 胎牛血清、50 U/mL 青霉素和50 mg/mL 链霉素,在37°C、体积分数95%空气和5% CO2的环境下生长。构建miR-204-3p 及EphB2 重组载体,转染A549 细胞后,分组进行后续实验。将细胞分为5 组:NC mimic 组(miR-204-3p 过表达阴性对照组)、miR-204-3p mimic组(miR-204-3p过表达组)、oe-NC组(EphB2 过表达阴性对照组)、oe-EphB2 组(EphB2过表达组)、miR-204-3p mimic+oe-EphB2 组(miR-204-3p 与EphB2 均过表达组)。
1.3 实验方法
1.3.1 MTT实验 细胞转染24 h后,取对数生长期的细胞,用含100 mL/L 胎牛血清的RPMI 1640 培养基制备成2.5×105个/mL 的细胞悬液,接种到96孔培养板,根据实验分组,每组各设8 孔,每孔100 μL,置于37℃、体积分数5%CO2细胞培养箱中培养,分别于培养12、24、36、48、72 h 时取出培养板,每孔加入5 mg/mL MTT 溶液10 μL 继续培养4 h,终止培养后,弃上清液,每孔加150 μL DMSO,振荡10 min,使其充分溶解,自动酶标读数仪检测570 nm 处测定各孔吸光度(OD)值。
1.3.2 流式细胞术 转染细胞24 h 后,收集细胞,PBS洗涤3次,离心并丢弃上清液,重悬浮后将细胞浓度调整到约1×105/mL。在-20 ℃预冷75%乙醇,吸取1 mL 乙醇固定细胞,反应1 h 后,吸去乙醇,PBS 洗涤2 次,离心并丢弃上清液,加入100 μL RNase A,在37 ℃,避光的条件下孵育30 min,然后加入400 μL PI 染色,混合,4 ℃下暗反应30 min,GaliOS 型号流式细胞仪(Beckman Coulter,美国)记录488 nm 处荧光强度,检测各组细胞周期分布情况。
转染24 h后,用不含EDTA的胰蛋白酶消化细胞,收集在流动管中,离心,并丢弃上清液。PBS 洗涤细胞3 次,离心除去上清液。根据Annexin VFITC 凋亡检测试剂盒的操作说明,将Annexin VFITC、PI、HEPES 缓冲液按1∶250 的比例制备染液。每100 μL染料溶液再悬浮大约1×106个细胞,摇匀。室温下孵育15 min 后,加入1 mL HEPES 缓冲液,摇匀。在488 nm 处,分别激发525 和620 nm带通滤波器,检测FITC 和PI 荧光,从而得到各组细胞凋亡情况。
1.3.3 Transwell 试验 细胞转染24 h 后,将Tran⁃swell 小室放置在24 孔板中,小室底部膜的上室面通过Matrigel 1∶8 稀释液包被,以室温进行风干;将各组细胞进行常规消化后,用过滤后的PBS 轻洗2 次,RPMI 1640 培养基将细胞重悬,将细胞密度大至调整到1×105个/mL,取200 μL 的悬液,移入到已处理的小室底部膜的上室面,另外取含有20%胎牛血清的培养基600 μL,加入下室。正常培养24 h 后,取出小室,去除上室内面多余的细胞,40 g/L 的多聚甲醛进行固定,15 min 后,使用0.5%的结晶紫染液进行染色。用过滤好的PBS 进行清洗,洗去多余染液。使用倒置显微镜观察,随机选取其中5个视野,拍照并计数穿膜的细胞数目。
1.3.4 细胞划痕实验 将转染24 h 的A549 细胞接种于6 孔板上,贴壁后用无血清DMEM 培养基代替。当细胞融合度达到90%~100%时,10 μL 枪口垂直于6孔板底部进行缓慢划痕,每孔约4~5处划痕,以保证每一处划伤的宽度相同。然后用已过滤与预冷的PBS 冲洗细胞3 次,放置在细胞培养箱中24 h 后,观察划痕区的移动距离,随机选取多个视野,对视野进行拍摄。使用ipp7.0 软件进行细胞融合率分析。
1.3.5 PGL3 重组载体构建和鉴定 1%琼脂糖凝胶电泳后切出目的条带,用试剂盒纯化PCR 产物后再次电泳确认。确认以后使用XhoⅠ酶、HindⅢ酶对胶回收纯化产物和空白载体pGL3.0-Basic进行37℃双酶切过夜,用同样的方法纯化回收过夜的酶切物。将纯化后的pGL3.0-Basic 载体和CTGF 片段进行连接反应。连接体系为酶切纯化后pGL3.0-Basic 载体2 μL、酶切纯化后CTGF 片段4 μL、T4 DNA 连接酶0.8 μL、T4 DNA 连接酶缓冲液(5×)2 μL、双蒸水1.2 μL,共10 μL 体系,置于PCR 中16 ℃连接过夜。连接后的产物使用超级感受态细胞TreliefTM5α进行转化,之后将细胞沉淀接种到含氨苄霉素的LB 固体培养平板中培养筛选过夜。在每个培养平板中选取5 个单克隆菌落,各用5 μL 的无菌水溶解得到菌液,取2 μL 作为模板进行菌落PCR,扩增后采用1% 琼脂糖凝胶电泳鉴定;剩余3 μL 菌液加入到3 mL 含氨苄霉素的LB液体培养基中,37 ℃、220 r/min振荡培养过夜,然后小提质粒。提取得到的质粒用XhoⅠ酶、HindⅢ酶双酶切2 h,琼脂糖凝胶电泳鉴定目的片段是否插入。对经过初步鉴定的质粒进行测序。
1.3.6 双荧光素酶报告分析 构建靶基因NC mim⁃ic、miR-204-3pmimic、PGL3-EphB2wt 和PGL3-EphB2mut 载体,将NC mimic、miR-204-3p mimic载体分别与PGL3-EphB2 wt和PGL3-EphB2 mut 载体共转至HEK 293T 细胞中。在细胞转染24 h 后,进行双荧光素酶检测。首先将各组细胞裂解,裂解后以13 000×g离心1 min,去沉淀,收集上清液。双荧光素酶报告试剂盒(E1910,Promeg,美国威斯康辛州麦迪逊市),按照试剂盒操作,测量荧光素酶活性。操作步骤如下:将裂解后的细胞样品吸入EP管中,每10 μL样品中加入萤火虫荧光素酶工作溶液100 μL,测得萤火虫荧光素酶活性之后加入海肾荧光素酶工作溶液100 μL,测得海肾荧光素酶活性结果。最后荧光素酶活性比值由萤火虫荧光素酶活性/海肾荧光素酶活性获得。
1.3.7 实时荧光定量 PCR 细胞转染24 h 后,收集细胞,冷PBS 清洗细胞1 次,由Trizol 提取各组组织中总RNA。根据TaqMan MicroRNA Assays Reverse Transcription primer(4427975,Applied Bio⁃systems,USA)的说明进行转录以产生cDNA,取2 μL cDNA 稀释至50 ng/μL,PCR 扩增体系是20 μL。逆转录反应条件:37 ℃反应30 min,85 ℃反应5 s。miR-204-3p、U6、EphB2、GAPDH的引物由北京擎科生物科技有限公司进行合成(表1)。使用定量PCR 仪进行实时定量PCR。反应条件是在预变性95 ℃反应10 min,变性95 ℃反应10 s,退火60 ℃反应20 s,35 个循环。PCR 体系为20 μL:qPCR 正向引物(10 μmol/L)0.8 μL,qPCR 反向引物(10 μmol/L)0.8 μL,ROX 参考染料Ⅱ0.4 μL,SYBRPremix Ex TaqTMⅡ10 μL,cDNA模板2.0 μL,灭菌蒸馏水6.0 μL。其中miR-204-3p的相对表达以U6作为内参,EphB2mRNA 相对表达以GAPDH的表达作为内参。2-ΔΔCt表示目的基因相对表达水平,公式如下:ΔΔCT=ΔCt实验组-ΔCtGAPDH,其中ΔCt=Ct目的基因-Ct内参。其中Ct 表示qPCR 的扩增循环数。
1.3.8 Western Blot 细胞转染24 h 后,收集细胞,冷PBS 清洗细胞1 次,Western blot 检测各组细胞中EphB2 蛋白的表达。RIPA(BB-3209,Bebe Bio,中国上海)提取细胞中总蛋白。将蛋白样品置于沸水浴中10 min,完成蛋白质变性处理。通过SDS-PAGE 凝胶电泳分离蛋白,在80 V 的恒定电压下转移至NC 印迹膜。5%脱脂牛奶封闭溶液1 h后,加入一抗兔多抗EphB2,GAPDH,在摇床中,4 ℃下封闭过夜。TBST在室温下洗涤3次,每次洗涤5 min。将HRP 标记的山羊抗兔IgG(ab150077,Abcam,USA)在37 ℃下振荡孵育2 h。用TBST 在室温下洗涤3 次,每次洗涤5 min,将PVDF 膜进行显色。蛋白相对表达=蛋白带灰度值/相同样品GAPDH 带灰度值。

表1 引物序列Table 1 Primer sequence
1.3.9 EphB2 数据获取 非小细胞肺癌中EphB2基因的生存分析数据,来自表达谱动态分析(Gene Expression Prolifing Interactive Analysis,GEPIA)数据库(http://gepia.cancer-pku.cn/),GEPIA 数据库是基于9 736 个来自癌症和肿瘤基因图谱(The Cancer Genome Atlas,TGCA)、基因型组织表达(Genotype Tissue Expression,GTEx)数据库的8 537个正常样本的基因表达分析的相互式Web 应用程序。对肺鳞癌和肺腺癌中EphB2表达分析,以正常组织表达为基线,设置分组阈值:EphB2表达>50%为高表达组,<50%为低表达组,共计960 例肺癌组织(肺腺癌+肺鳞癌)纳入生存统计分析,以Log-rank test 进行假设检验分析。
1.3.10 统计学分析 IBM SPSS 21.0进行统计学分析,呈正态分布的计量数据用均数±标准差表示。多组均数比较时,各组定量资料都呈正态分布并且方差齐性采用One way-ANOVA 进行分析,差异有统计学意义时采用Bonferroni法进行两两比较。检验水准α=0.05,P≤0.05为差异有统计学意义。
2 结果
2.1 miR-204-3p 及EphB2 对A549 细胞增殖的影响
我们通过MTT检测各组细胞增殖情况(图1),结果显示,和NC mimic 组相比,miR-204-3p mimic组细胞增殖能力显著降低(P<0.05)。和oe-NC组相比,oe-EphB 组细胞增殖能力显著升高(P<0.05)。和miR-204-3p mimic 组相比,miR-204-3p mimic+oe-EphB 组细胞增殖能力显著升高(P<0.05)。以上结果表明miR-204-3p 过表达会抑制A549 细胞增殖,而EphB 过表达则会促进A549 细胞增殖,且EphB 过表达会阻断miR-204-3p 对A549 细胞增殖的抑制作用。
2.2 miR-204-3p 及EphB 对A549 细胞周期及凋亡的影响
为探究miR-204-3p、EphB 对A549 细胞周期和凋亡的影响,我们通过流式细胞术分别检测各组细胞周期(图2A、B)和凋亡情况(图2C、D),结果显示,和NC mimic 组相比,miR-204-3p mimic组细胞G0/G1 期细胞比例显著升高,S 期细胞比例显著降低,细胞凋亡比例明显升高(P<0.05)。和oe-NC 组相比,oe-EphB 组细胞G0/G1 期细胞比例显著降低,S 期细胞比例显著升高,细胞凋亡比例明显降低(P<0.05)。和miR-204-3p mimic组相比,miR-204-3p mimic+oe-EphB 组细胞G0/G1 期细胞比例显著降低,S 期细胞比例显著升高,细胞凋亡比例明显降低(P<0.05)。以上各组细胞G2/M 期细胞比例均无显著性差异(P>0.05)。以上结果综合表明miR-204-3p 会抑制周期进程,促进细胞凋亡,EphB 会促进周期进程,而抑制细胞凋亡,且EphB 过表达会阻断miR-204-3p对A549细胞周期进程的阻滞作用以及对细胞凋亡的促进作用。
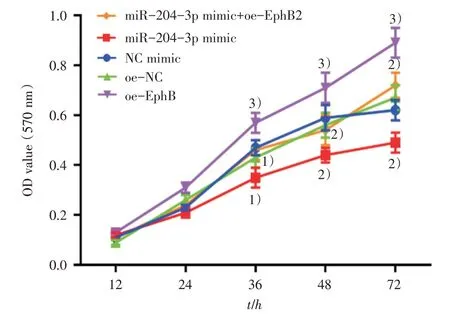
图1 miR-204-3p 及EphB 过表达对A549 细胞增殖能力的影响Fig.1 Over-expression of miR-204-3p and EphB effects on proliferation of A549 cells
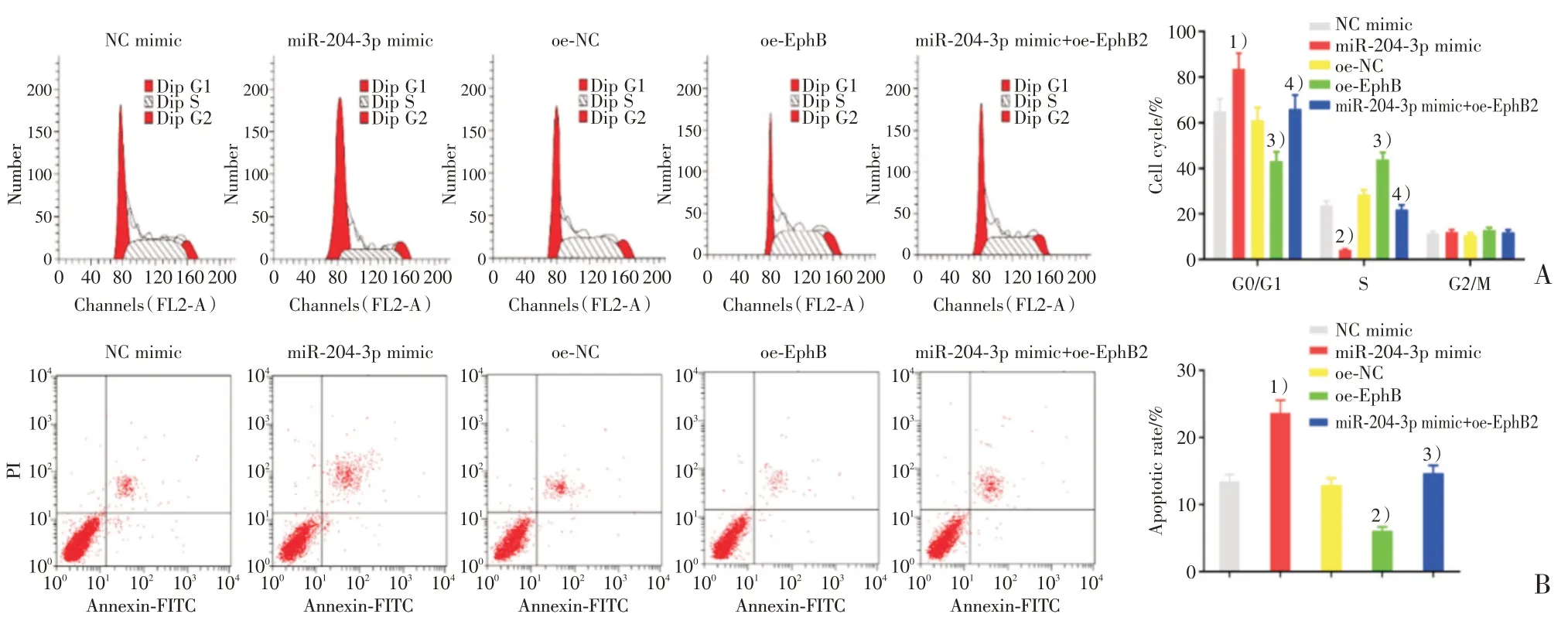
图2 miR-204-3p 及EphB 过表达对A549 细胞周期及凋亡的影响Fig.2 Over-expression of miR-204-3p and EphB effects on cell cycle and apotosis of A549 cells
2.3 miR-204-3p 及EphB 对A549 细胞侵袭能力的影响
Transwell 检测各组细胞侵袭情况(图3A、B),结果显示,和NC mimic 组相比,miR-204-3p mimic组细胞侵袭能力显著降低(P<0.05)。和oe-NC组相比,oe-EphB 组细胞侵袭能力显著升高(P<0.05)。和miR-204-3p mimic组相比,miR-204-3p mimic+oe-EphB 组细胞侵袭能力显著升高(P<0.05)。以上结果表明miR-204-3p 过表达会抑制A549 细胞侵袭,而EphB 对A549 细胞侵袭能力的影响则刚好相反,且EphB 过表达会阻断miR-204-3p 对A549 细胞侵袭的抑制作用。
2.4 miR-204-3p 及EphB2 对A549 细胞迁移能力的影响
划痕实验用于检测各组细胞侵袭情况(图4A、B),结果显示,和NC mimic 组相比,miR-204-3p mimic 组细胞迁移能力显著降低(P<0.05)。和oe-NC 组相比,oe-EphB 组细胞迁移能力显著升高(P<0.01)。和miR-204-3p mimic 组相比,miR-204-3p mimic+oe-EphB 组细胞迁移能力显著升高(P<0.05)。以上结果表明miR-204-3p 过表达会抑制A549 细胞迁移,EphB 明显促进A549 细胞的迁移能力,且EphB 过表达会阻断miR-204-3p 对A549 细胞迁移的抑制作用。

图3 miR-204-3p 及EphB 过表达对A549 细胞侵袭能力的影响Fig.3 Overexpression of miR-204-3p and EphB effects on invasion of A549 cells

图4 miR-204-3p 及EphB 过表达对A549 细胞迁移能力的影响Fig.4 Over-expression of miR-204-3p and EphB effects on migration of A549 cells
2.5 miR-204-3p 与EphB2 之间的调控关系
我们通过生信网站(http://www.targetscan.org/vert_72/)查询发现miR-204-3p与EphB2之间存在结合位点(图5A),为进一步探究miR-204-3p 与EphB2 之间是否存在调控关系,我们首先通过双荧光素酶报告分析进行检测(图5B),结果显示,和NCmimic 相比,miR-204-3pmimic 与EphB2wt共转染后,EphB2wt 报告载体荧光素酶活性显著降低,这表明miR-204-3p会显著抑制miR-204-3p的活性。为探究在A549 细胞中,miR-204-3p 是否会影响EphB2 的表达,我们分别通过qRT-PCR(图5C)和WB(图5D)检测各组细胞中miR-204-3p 和EphB2 的表达情况,结果显示,和NC mimic组相比,miR-204-3p mimic 组细胞中miR-204-3p表达升高,EphB2 mRNA 和蛋白表达降低(P<0.01)。和oe-NC 组相比,oe-EphB 组miR-204-3p表达无显著性差异(P>0.05),EphB2 mRNA 和蛋白表达升高(P<0.01)。和miR-204-3p mimic 组相比,miR-204-3p mimic+oe-EphB 组miR-204-3p表达无统计学差异(P>0.05),EphB2 mRNA 和蛋白表达升高(P<0.01)。以上结果综合表明,在NSCLC中,miR-204-3p 可靶向抑制EphB2 的表达。
2.6 miR-204-3p 与EphB2 在NSCLC 的表达及预后关系
查询TGCA数据库,进行统计分析发现NSCLC中mir-204-3p与EphB2表达呈负相关(r=-0.636,P=0.000,n=66),差异有统计学意义(图6A)。利用GEPIA 数据库分析TGCA 来源的NSCLC(肺腺癌+肺鳞癌),结果显示EphB2高表达的NSCLC 较EphB2低表达总生存时间短(logrank χ2=3.899,P=0.049,n=480;图6B),提示EphB2高表达是NSCLC不良预后的标志分子。
3 讨论
NSCLC 是肺癌最常见的病理类型,占所有类型的80%以上[19-20]。目前NSCLC 的治疗主要采取放疗、化疗及手术等综合治疗,但中晚期患者总体生存预后较低[21-23]。近年来,靶向治疗及免疫治疗逐渐进入公众视野,是癌症治疗的趋势。尽管有大量的基础研究,但NSCLC 的发病机理仍不明确,探寻更多的确切有效的靶点是目前研究的热点难点。
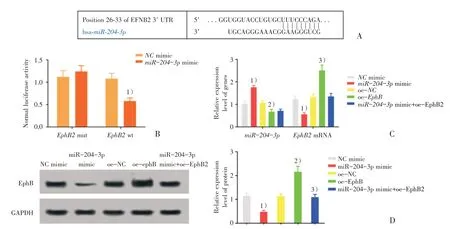
图5 miR-204-3p 靶向下调EphBFig.5 MiR-204-3p targeted down-regulation of EphB
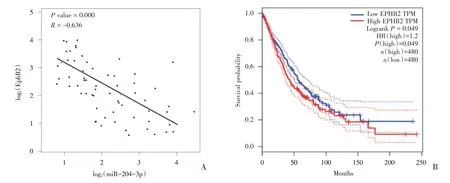
图6 非小细胞肺癌中miR-204-3p 与EphB2 表达相关性Fig.6 Correlation between miR-204-3p and EphB2 expression in non-small cell lung cancer
MicroRNA(miRNA)是非编码RNA 之一,广泛存在于动物、植物和微生物中,在功能上广泛参与细胞分化、增殖、凋亡、个体生长发育以及器官形成等[24]。miR-204-3p 属于microRNA 家族成员之一,是miR-204 的成熟体之一。Zhang 等[25]研究发现miRNA-204作为抑癌基因,其过表达可显著抑制NSCLC 进展。研究报道在胃癌、胰腺癌、食管癌等中miR-204-3p 高表达,发挥抑制细胞增殖、凋亡和侵袭作用,进而抑制肿瘤的发展[24-26]。而miR-204-3p 在NSCLC 中的作用尚不清楚,在本研究中,我们通过在A549 细胞中过表达miR-204-3p,明显抑制NSCLC 的增殖、迁移及侵袭能,并阻滞在G0/G1 期促进细胞凋亡。因此,miR-204-3p在NSCLC 中发挥抑癌作用,其下游调控机制有待进一步研究。
MicroRNA 可以通过与靶基因3′-非翻译区(UTR)特异结合,使靶基因降解或翻译受阻,从而在转录水平后调控基因的表达。研究发现miRNA-204靶向抑制ATF2的表达,进而抑制NSCLC增殖、迁移、侵袭[25-28]。miRNA-204-3p 还可靶向乳酸脱氢酶(lactate dehydrogenase,LDHA)介导的糖酵解负向调控膀胱癌细胞的增殖[29]。经Targetscan 数据库进行生物信息学分析,EphB2基因作为miR-204-3p的候选靶基因,EphB 作为受体络氨酸蛋白激酶之一,在肿瘤发生发展中发挥重要作用[29]。Hagen等[30]研究发现EphB2是胃癌患者是独立预后标志物,具有促进肿瘤细胞侵袭性作用。Megiorni等[31]研究也表明,EphB2 在横纹肌肉瘤中表达异常升高[31]。Wang 等[32]研究发现,EphB2 参与细胞平滑肌细胞向毛细淋巴管的异常迁移。Salgia[33]的研究也表明EphB 的表达失调与肿瘤的生长、转移相关。在本研究中,EphB2 作为致癌因子,过表达促进NSCLC 增殖、侵袭及转移,抑制细胞凋亡。miR-204-3p 在NSCLC 中下游的调控机制尚不清楚,为探究miR-204-3p 与EphB2 之间是否存在靶向关系,我们通过双荧光素酶报告以及qPCR 和WB 检测均表明在NSCLC 中,miR-204-3p 能够靶向结合并抑制EphB2 的表达。其中miR-204-3p表达与EphB2 表达呈负相关,通过过表达EphB2后能挽救miR-204-3p 高表达所抑制NSCLC 增殖、侵袭、迁移能力及细胞凋亡。因此,mir-204-3p/EphB2是NSCLC 进展的重要调控机制之一,EphB2高表达是NSCLC 不良预后的标志分子,
本研究存在的不足,仅在体外细胞内验证这一机制,需在动物模型体内进一步验证该机制,并且深入探究mir-204-3p 上游调控机制,可进一步的完善NSCLC 发生进展的机制,有望为临床上靶向治疗提供了新的依据。
