扩头蔡白蚁肠道蛋白的鉴定
2020-10-12苏丽娟伍志伟高新浩赵鹏飞肖元玺楚君鹏宋安东
苏丽娟,伍志伟,高新浩,赵鹏飞,肖元玺,楚君鹏,宋安东
(河南农业大学生命科学学院,郑州 450002)
木质纤维素是地球上非常富有的可再生生物质资源,主要由纤维素、木质素和半纤维素等成分组成(相辉和周志华,2009),但是,生物质资源的利用和转化受到原料自身抗降解屏障特性的影响,成为制约其产业化发展的主要障碍,因此,探索自然生物系统中能够高效转化木质纤维素的技术体系成为解决这一瓶颈的重要途径。据统计,有100多种昆虫被证实具有明显的消化木质纤维素的能力,比如蜚蠊目的食木蟑螂Panesthiacribrata和白蚁、缨尾亚目的蠹虫、鞘翅目的天牛等(Martin,1983;Slaytor,1992;Lawtonetal.,1996;Mohr and Tebbe,2006),在这些昆虫中,白蚁消化木质纤维素的效率最高,可以在24 h内消化摄入植物中高达99%的纤维素,而其他食木昆虫对纤维素的消化率只有12%~68%(Sun and Scharf,2010)。如此高效的木质纤维素消化能力使白蚁成为研究高效利用木质纤维素资源的热点,研究者希望通过对白蚁的研究,发掘新型、天然、高效的木质纤维素酶,了解白蚁肠道内酶对木质纤维素的转化特征,解开昆虫肠道转化木质纤维素之谜,为高效转化木质纤维素为生物能源及生物基产品奠定基础。白蚁(工蚁)消化道呈螺旋形,主要由前肠、中肠和后肠3部分组成(Brune and Stingl,2006)。白蚁后肠相当发达,约占全部肠道总容积的4/5之多,主要负责吸收水份、无机盐及排除代谢废物等(Schmitt-Wagneretal.,2003;陈虹等,2005;苏丽娟等,2011)。因此,白蚁作为小型动物生物反应器,由进行物理消化的研磨器(具有强大咀嚼能力的口器)和生化消化的反应池(即消化道)组成,生化消化主要是指由复杂的微生物区系和木质纤维素酶系参与的木质纤维素的降解和转化(Zhouetal.,2007)。
迄今为止人们对白蚁纤维素酶系统的研究主要分两类,一是用基因组、转录组和蛋白组学的方法对木质纤维素降解酶进行鉴定和甄别,二是对酶进行基因克隆、表达或者分离纯化后测定其酶学特性,希望对这些酶的生产应用提供资料。比如,研究者对低等白蚁如北美散白蚁Reticulitermesflavipes、达尔文澳白蚁Mastotermesdarwiniensis、山林原白蚁Hodotermopsissjostedti、恒春新白蚁Neotermeskoshunenses和黄胸散白蚁Rhticulitermessperatus等的肠道微生物的酶系和酶蛋白进行了研究(Zhouetal.,2007;Tartaretal.,2009;Hongoh,2010;Franco Cairoetal.,2011;Xieetal.,2012),也对高等白蚁锯白蚁属的Microcerotermessp.、Trinervitermestrinervoides及象白蚁Nasutitermes的囊形胃内容物等进行宏基因组学分析(Zhangetal.,2009;Watanabe and Weissman,2010;Nimchuaetal.,2012;Rashamuseetal.,2017),白蚁肠道内容物中发现的纤维素酶最多,也有木聚糖水解酶、果胶酶和淀粉酶,包括纤维素酶(GH1,GH3,GH5,GH7,GH9和CBM6等),半纤维素酶(GH2,GH8,GH10,GH11,GH16,GH43和CBM 27等)和果胶酶(GH28和GH29等),这些酶多为内源性纤维素酶。另外,研究者用不同方法克隆和表达了一些白蚁的木质纤维素酶基因,例如:对北美散白蚁R.flavipes的研究最多,包括3个来自于白蚁后肠原生动物的纤维素酶GHF7-3,GHF7-5和GHF7-6(Sethietal.,2013),肠道中分离到的漆酶亚型RfLacA和RfLacB(Coyetal.,2010),唾液腺分泌的内源性内切β-1,4-葡聚糖酶RsEG(Hirayamaetal.,2010);黄胸散白蚁的GH45家族的内切β-1,4-糖苷酶(Otagirietal.,2013)和木糖异构酶(Katahiraetal.,2017);乳白蚁属台湾乳白蚁Coptotermesformosanus的两种内源性BG同源物CfGlu1B和CfGlu1C(Fengetal.,2015);高山象白蚁Nasutitermestakasagoensis后肠的NtEG可水解纤维素糊精的β-1,4-纤维素链成纤维二糖和葡萄糖(Hirayamaetal.,2010);象白蚁属Nasutitermescorniger的工蚁和兵蚁肠道提取物中检测到了多种纤维素酶(内切葡聚糖酶、外切葡聚糖酶、β-葡萄糖苷酶)、半纤维素酶(β-木聚糖酶,α-l-阿拉伯呋喃糖酶,β-d-木聚糖酶)、α-淀粉酶、蛋白酶(trypsin-like,chymotrypsin-like,keratinase-type)(Limaetal.,2014);黑翅土白蚁Odontotermesformosanus的肠道真菌产生的纤维素酶具有Eg酶和β-1,4-糖苷酶活性(Duanetal.,2017)。
经过近几十年的研究,人们对白蚁肠道内容物中降解木质纤维素的机理有了较为深刻的理解,但还远远不够,需要进一步的研究。本研究用双向电泳(2-DE)和MALDI-TOF/MS测序联用的方法直观显示了扩头蔡白蚁Tsaitermesampliceps肠道及其内容物的蛋白构成及这些蛋白在前中肠和后肠的表达差异,并对测到的木质纤维素酶的结构进行了预测,为理解白蚁降解木质纤维素的机理,挖掘白蚁生物系统中的高效降解酶提供理论依据。
1 材料与方法
1.1 白蚁采集及肠道内容物提取
扩头蔡白蚁采自河南省信阳商城县金刚台乡(31°79′N,115°50′E),采集到的扩头蔡白蚁首先进行物种鉴定,然后在黑暗、22~30℃、潮湿(湿度>50%)的条件下饲养,取数千头(前中肠4 000头、后肠1 000头)扩头蔡白蚁工蚁,用解剖针从扩头蔡白蚁腹尖轻轻拉出肠道(图1),分离前中肠和后肠,放入0.2 mol/L PBS溶液中,匀浆肠道及其内容物样品(冰上操作),2 000 r/min 4℃离心30 min,吸取上清。

图1 扩头蔡白蚁工蚁肠道解剖示意图Fig.1 Anatomy sketch of Tsaitermes ampliceps worker gutO:食道Oesophagus;C1:嗉囊Crop;CV:贲门瓣Cardiac valve;P1:前胃Proventriculus;Mg:中肠Midgut;T:马氏管Malpighian tubules;U:肠道瓣前节Segment preceding the enteric valve;P2:囊形胃Paunch;C2:结肠Colon;R:直肠Rectum.
1.2 肠道内容物蛋白提取和纯化
将1.1节获得的粗蛋白溶液用0.22 μm Micro PES树脂(用MillQ水湿润过)过滤,加入1/4体积的50% TCA-丙酮(5 g三氯乙酸,加去离子水溶解,定容至10 mL),冰浴。离心弃上清,加入冰丙酮(内含0.01 mol/L DTT,保存在-20℃冰箱中),冰浴。4℃ 12 000 r/min离心30 min,弃上清。加入蛋白提取液[SDS 0.15 g,1 mol/L Tris-HCl (pH 7.6) 1.5 mL,DTT 0.015 g,0.5 mol/L EDTA-Na20.1 mL,蔗糖3 g,加MillQ水定容至10 mL],40~50℃加热30 min,溶解沉淀,20℃ 12 000 r/min离心30 min,弃上清。加入0.1 mol/L乙酸铵甲醇溶液(乙酸铵0.77 g,加入甲醇溶解并定容至100 mL)涡旋混匀,冰浴离心,弃上清。再用冰甲醇溶液(内含0.01 mol/L DTT,保存在-20℃冰箱中)清洗固体沉淀。加入含有尿素、硫脲和CHAPS等试剂的裂解液(尿素4.2 g,硫脲1.52 g,CHAPS 0.4 g) 15℃ 220 r/min震荡溶解30~60 min,样品蛋白质浓度采用Bradford(1976)法测定,确保蛋白样品浓度1 μL≥12 μg蛋白量,之后放在-20℃冰箱保存。
1.3 双向电泳
1.2节蛋白样品置室温溶解,加入0.01 g DTT充分混匀即为水化上样缓冲液。取出冷冻保存的线性IPG预制胶条(11 cm,pH 4-7),室温放置10 min,沿着聚焦盘的边缘从左到右线性加入等量(体积和质量)的蛋白样品 (在槽两端各1 cm左右不要加样,中间的样品液一定要连贯且不要有气泡,否则会影响到胶条中蛋白质的分布),当蛋白质样品都加入到聚焦盘中后,用镊子轻轻地去除预制IPG胶条上的保护层。分清正负极,轻轻地将IPG胶条胶面朝下置于聚焦盘或水化盘中样品溶液上,使得胶条的正极(标有+)对应于聚焦盘的正极。在每根胶条上覆盖矿物油,防止胶条水化过程中液体的蒸发。需缓慢地加入矿物油,沿着胶条使矿物油一滴一滴慢慢加在塑料支撑膜上,对好正负极,设置等电聚焦程序。
等电聚焦程序为:电流保证不超过50 μA,S1 50 V主动水化12 h→S2 200 V线性1 h→S3 1 000 V快速1 h→S4 9 000 V线性2 h升压→S5 9 000 V聚焦8 h→S6 500 V快速,可以保持12 h,聚焦结束的胶条立即用平衡缓冲I和平衡缓冲液Ⅱ进行平衡。配制12%分离胶和5%浓缩胶进行第二向SDS-PAGE电泳。恒温15℃,先用低电压100 V/gel/11 cm、后用200 V/gel/11 cm电泳,考马斯亮蓝R250溶液染色胶,冰乙酸脱色后凝胶成像。
1.4 生物信息学分析和MALDI-TOF/MS测序
染色后的凝胶用ImageScanner扫描,用PDQuest软件分析图谱,分析白蚁前中肠和后肠中的高表达和差异表达蛋白,确认其显著差异的蛋白(灰度比值大于2)。用双向电泳的至少2个标准蛋白质计算样品胶中蛋白质点分子量和等电点的实验值。选取高表达和显著差异表达蛋白质点,用灭过菌和去头的黄色枪头沿着染色边缘切下差异蛋白点放入Eppendorf管中,进行蛋白质溶解,由上海博苑科技生物技术有限公司测序。
用MALDI-TOF/MS的数据采集软件Flexcontro.1 3.0对样品孔的数据进行采集,每孔取10个进行激光点击其不同位置。运用数据库World-2D PAGE,UniProt,ExPASy,NCBI和GenBank等通过数学和计算机技术手段对生物信息进行收集、加工、存储、分析与解析方法来诠释实验的结果。通过Cn3D 4.3软件预测了酶蛋白的高级结构,并用SignalP 4.1 Server软件分析了5个蛋白的信号肽序列信息。
2 结果
2.1 扩头蔡白蚁肠道及其内容物蛋白的电泳结果
扩头蔡白蚁前中肠和后肠及其内容物蛋白的双向电泳图谱如图所示(图2:A,B),从图中可以看出,蛋白点清晰透亮种类多,且白蚁前中肠内容物蛋白与后肠的差异明显,适合对白蚁前中肠和后肠内容物蛋白进行差异比对研究。用PDQuest软件分析发现,白蚁前中肠有182个可分辨蛋白点,后肠有108个可分辨蛋白点,其中有28个蛋白在前中肠和后肠均高效表达、78个蛋白仅在前中肠表达、37个蛋白仅在后肠表达,排除独有的蛋白点,有23个蛋白在前中肠的表达量大于后肠的2倍、31个蛋白在后肠的表达量大于前中肠的2倍。图2(C)为加1%CMC-Na筛选底物的SDS-PAGE电泳图谱,从图中可以看出白蚁肠道内容物纤维素降解酶的分子量大小范围,前中肠的蛋白分子量分别为在25~28 kD和43~85 kD范围内,后肠的在35~85 kD范围内,所以该筛选图谱可以为扣点测序的蛋白分子量范围提供有力的依据。

图2 扩头蔡白蚁肠道及其内容物蛋白的双向电泳图谱Fig.2 2-DE analysis of proteins in the gut including gut contents of Tsaitermes amplicepsA:前中肠蛋白Proteins in the fore- and midgut;B:后肠蛋白Proteins in the hindgut.图中的数字为进行扣点测序的蛋白,数字的颜色表示蛋白的功能(黑色示结构蛋白;蓝色示调节蛋白;粉红色示白蚁代谢蛋白;红色示微生物代谢蛋白;黄色示未测出蛋白)。The number shows the proteins selected to sequence.The color of number shows the function of proteins (black showing the structural proteins,blue showing the regulatory proteins,pink showing the metabolism-related proteins in termites,red showing the metabolism-related proteins in microorganism,and yellow showing the undetected proteins).C:加1%CMC-Na筛选底物的SDS-PAGE电泳图谱The SDS-PAGE figure when adding 1% CMC-Na as the substrate.
2.2 扩头蔡白蚁肠道及其内容物蛋白的鉴定
对高表达或高差异表达的47个蛋白点进行扣点和MALDI-TOF/MS测序,成功匹配出39个蛋白,表1是通过MS/MS分析前中肠和后肠的差异蛋白功能信息,从表中可以看出测序蛋白可以分为4类:(1)结构蛋白:1个副肌球蛋白(图2中16)、1个角蛋白1(图2中37)、2个原肌球蛋白(图2中6和7)、5个肌动蛋白(图2中24,25,34,36和44)、4个昆虫储存蛋白(图2中1,2,13和14);(2)调节蛋白:1个转铁蛋白(图2中15)、1个致死蛋白2(图2中35)、1个钙调素蛋白(图2中32号假定蛋白与Ca2+转运有关)、2个储铁蛋白(图2中28和42)、4个热激蛋白(图2中17,19,22和40);(3)白蚁代谢蛋白:1个E4酯酶(图2中26)、1个脯氨酸二肽酶(图2中27)、2个内源性纤维素酶(图2中3和4)、3个精氨酸激酶(图2中9,29和30,其中29号假定蛋白预测为精氨酸激酶)和3个二硫化物异构酶(图2中11,18和33);(4)肠道内容物微生物代谢蛋白:1个内切β-1,4-葡聚糖酶(图2中5)、1个谷胱甘肽S-转移酶(图2中39)、1个β-内酰胺酶(图2中41号蛋白有β-内酰胺酶结构域)、1个超氧化物歧化酶(图2中46)、1个糖基水解酶11家族(图2中45)和2个醛酮还原酶(图2中8和31)。其中结构蛋白、调节蛋白和白蚁代谢蛋白等内源性蛋白32个,占匹配成功蛋白82.1%;外源性蛋白即微生物代谢蛋白7个,占17.9%,从功能蛋白的种类和数量上可以判断内源性蛋白多于外源性蛋白。
2.3 扩头蔡白蚁前中肠与后肠差异表达蛋白的比较
匹配出的39个蛋白中,在前中肠和后肠均高效表达有11个,其中4个结构蛋白,3个微生物代谢蛋白,主要有储存蛋白、肌球蛋白、醛酮还原酶等,表明白蚁前中肠和后肠在日常生活中均需要储存自身所需要的蛋白以及防止共价大分子结合的损害。仅在前中肠表达的蛋白有12个,其中6个白蚁代谢蛋白,主要有内源性纤维素酶、二硫化物异构酶、E4酯酶等,推测白蚁在前中肠主要进行能量代谢活动,尤其是内源性纤维素的降解。仅在后肠表达的蛋白有8个,主要是微生物代谢蛋白,有糖基水解酶第十一家族、超氧化物歧化酶等,表明白蚁在后肠主要参与半纤维素和木质素的降解。蛋白在前中肠的表达量大于后肠2倍的有5个,其中有4个结构蛋白,主要是肌球蛋白、肌动蛋白等,表明白蚁需要在前中肠储存所需蛋白。蛋白在后肠的表达量大于前中肠的2倍有3个,主要有热休克蛋白、脯氨酸二肽酶等。以上信息在消化代谢方面可以得出白蚁前中肠主要进行白蚁代谢活动,后肠进行微生物代谢活动,可以推测白蚁吞食木头后,在前中肠进行初步消化降解,经过后肠微生物代谢进一步降解,形成微生物蛋白,再通过肛哺饲喂其他白蚁。
2.4 扩头蔡白蚁肠道木质纤维素降解酶的3D结构预测
从表1中可以看出参与木质纤维素降解和代谢相关的酶或非酶蛋白主要有5个(表1中3,4,5,45和46),通过Cn3D 4.3软件预测4个酶的高级结构(表1中4,5,45和46)(图3),图3(A)是白蚁内源性纤维素酶[GH9家族内切葡聚糖酶,(α/α)6结构];图3(B)是白蚁内切β-1,4-葡聚糖酶[GH9家族内切葡聚糖酶,(α/α)6结构];图3(C)是GH11家族木聚糖酶[内切β-1,4-木聚糖酶,β-jelly roll结构;三级结构比对可能为GH11/GH12)],由白蚁共生不可培养原生动物产生的;图3(D)是Cu-Zn SOD(β-sandwich结构),来源于双翅目果蝇科的Scaptodrosophilalebanonensis。为了更深入地了解这几个蛋白,用SignalP 4.1 Server软件分析了5个蛋白的信号肽序列信息,结果发现:1个内源性纤维素酶的蛋白信号肽概率0.885,最大分隔位点概率是0.450,酶切位点位于第18与19位氨基酸之间;1个内源性纤维素酶的信号肽概率0.845,最大分隔位点概率是0.450,酶切位点位于第16与17位氨基酸之间;1个糖基水解酶11家族的蛋白信号肽概率0.546,最大分隔位点概率是0.450,酶切位点位于第22与23位氨基酸之间;1个内切β-1,4-葡聚糖酶和1个超氧化物歧化酶的信号肽概率分别为0.115和0.099,最大分隔位点概率是0.450,预测不到其酶切位点。
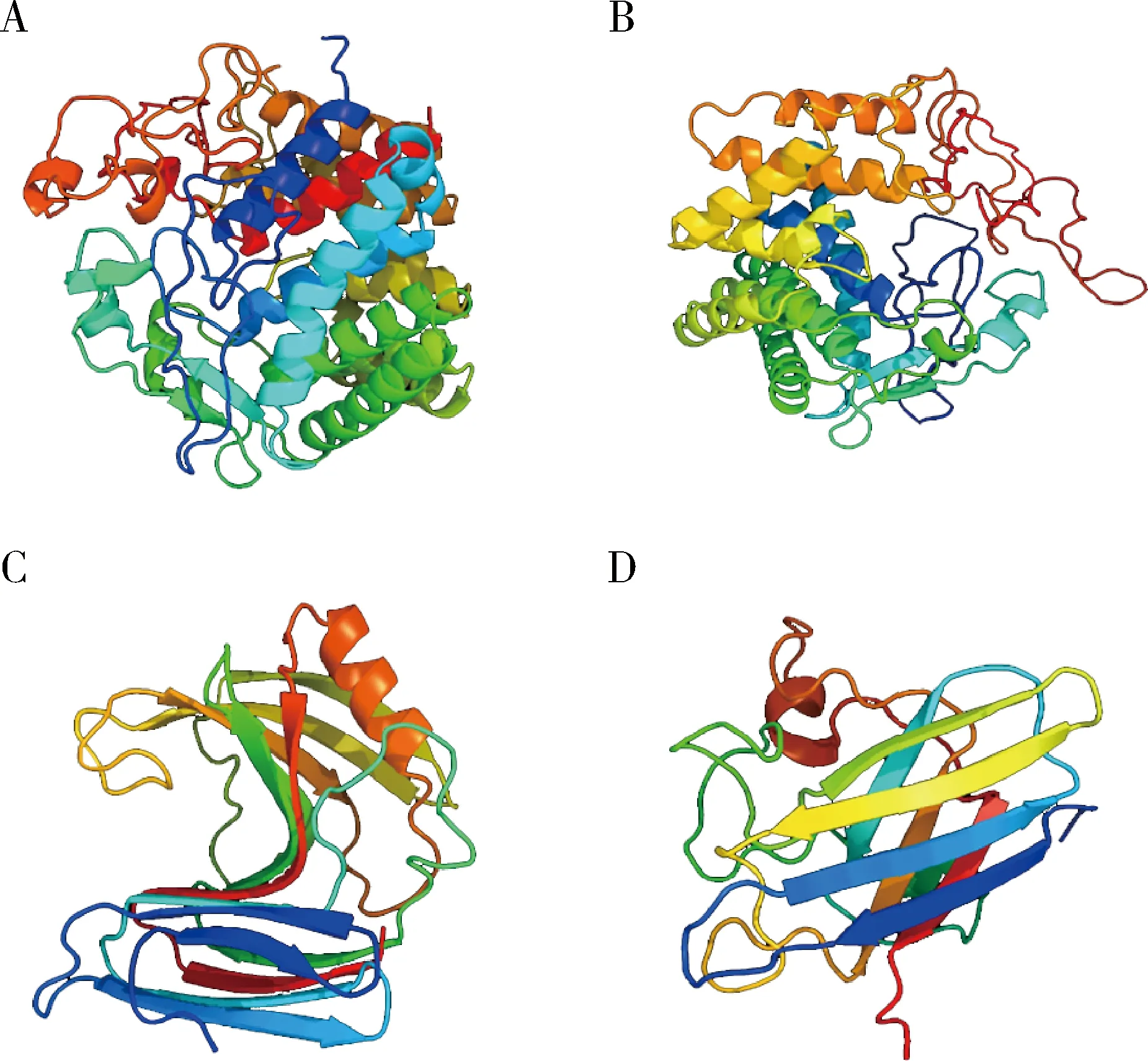
图3 扩头蔡白蚁肠道木质纤维素降解酶的蛋白结构预测Fig.3 Protein structure prediction of lignocellulolytic enzymes in the gut of Tsaitermes amplicepsA:白蚁内源性纤维素酶[GH9家族内切葡聚糖酶,(α/α)6结构]Endogenous cellulose from termites [GH9s,(α/α)6];B:白蚁内切β-1,4-葡聚糖酶[GH9家族内切葡聚糖酶(α/α)6结构] Endo-beta-1,4-glucanase HsEG4 from termites [GH9s,(α/α)6];C:来源于不可培养微生物的内切β-1,4-木聚糖酶(GH11家族木聚糖酶,β-jelly roll结构)Endo-β-1,4-xylanase (GH11,β-jelly roll) from uncultured microorganism;D:来源于互利共生微生物的Cu-Zn SOD(β-sandwich结构)Cu-Zn SOD (β-sandwich) from mutualistic microorganisms.
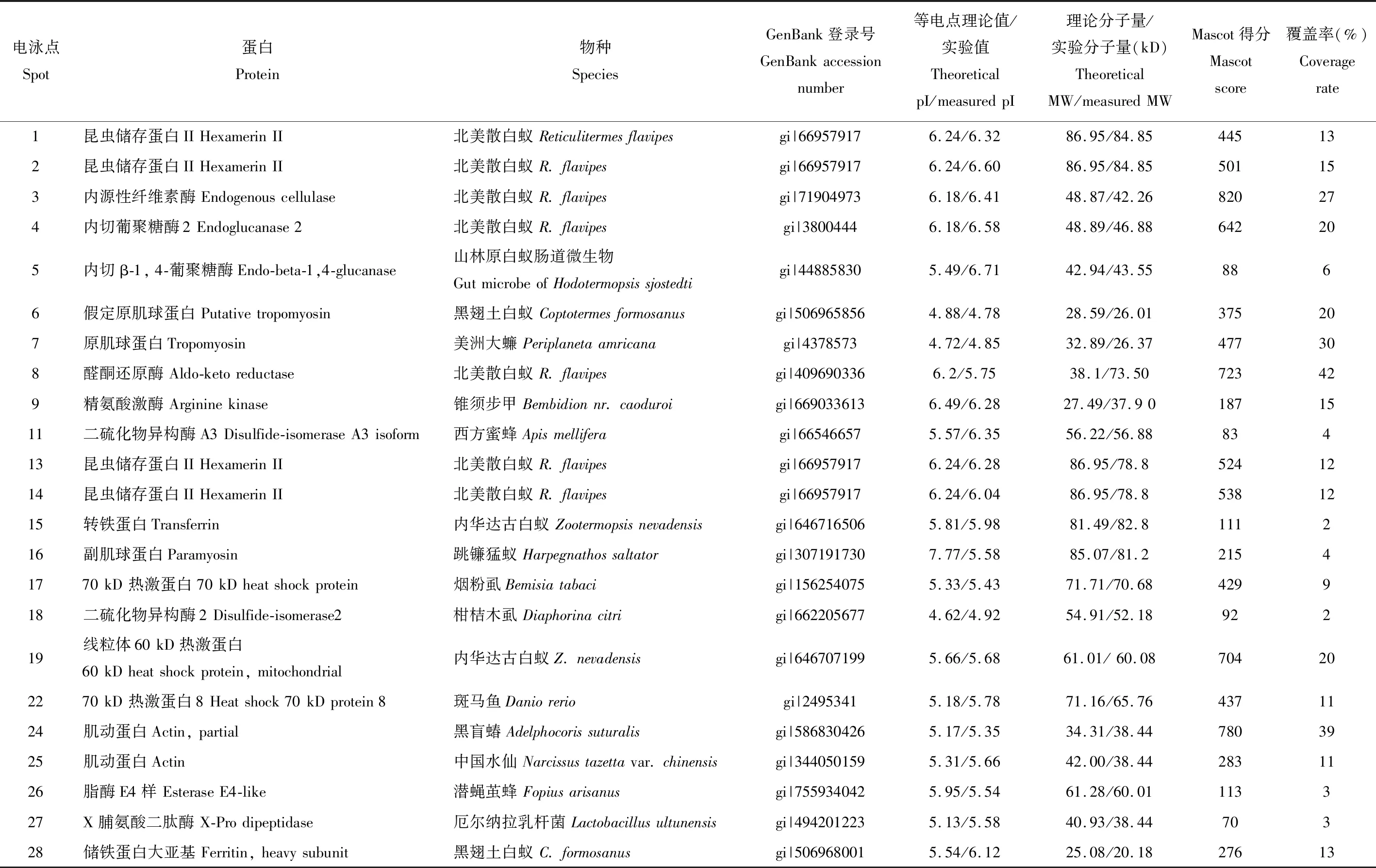
表1 MALDI-TOF/MS分析扩头蔡白蚁前中肠和后肠(含肠道内含物)的差异表达蛋白质信息Table 1 Basic information of differentially expressed proteins identified by MALDI-TOF/MS between the fore- and midgut and the hindgut (including gut contents) of Tsaitermes ampliceps
3 讨论
由于白蚁材料的特殊性,使得白蚁肠道内容物(前中肠和后肠)蛋白提取比较困难,本实验对白蚁肠道内容物双向电泳蛋白的提取和纯化方法进行了摸索。首先用肠道微生物蛋白提取方法提取白蚁肠道内容物蛋白,双向电泳图谱上的蛋白点大部分聚集在SDS-PAGE凝胶的靠上部分,存在这种现象的原因是可能等电聚焦不充分、SDS-PAGE电泳时间稍少、裂解液内含有NaCl和SDS等离子试剂、白蚁肠道内容物提取的特殊性等。并对白蚁和蝗虫肠道微生物蛋白提取进行了比较,发现相同实验方法和总蛋白量的白蚁的双向电泳图谱比蝗虫的蛋白点少得多,可能是由于白蚁肠道过于纤细,无法剥离,匀浆后残留肠壁组织、脂肪、核酸及糖类等杂质。然后采用植物组织蛋白提取方法(耿旭等,2010)并进行改进,比如增加pH 8.0 Tris-平衡酚,可以有效地使蛋白和其他杂质分开,从而达到纯化的目的,但是双向电泳图谱显示并不理想。最后增加Micro PES树脂过滤蛋白的提取方法,使蛋白与杂质分开,使蛋白样品损失较少,蛋白点清晰透亮,白蚁前中肠和后肠蛋白差异明显,便于后续差异蛋白的扣点和测序分析。
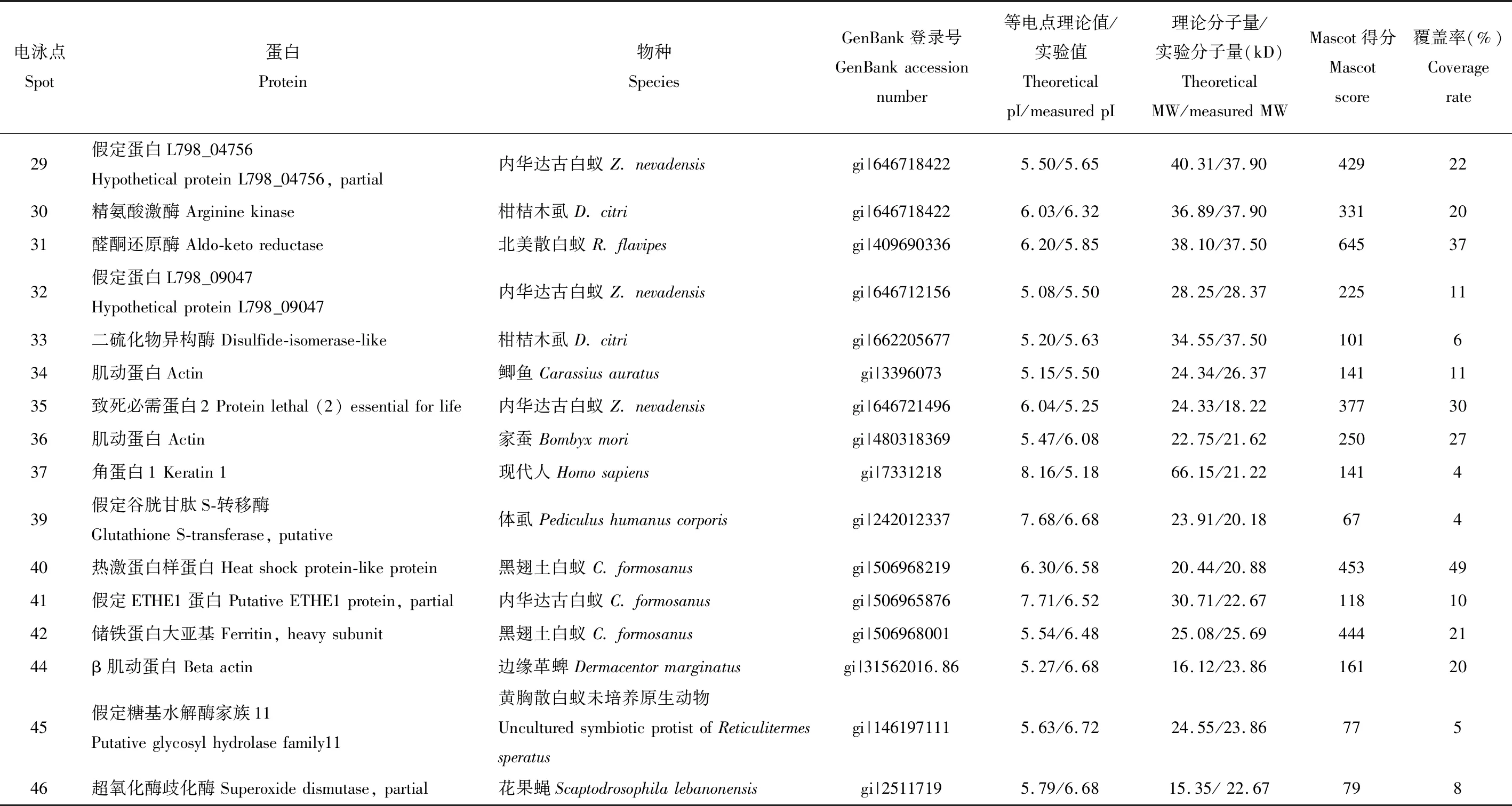
续表1 Table 1 continued
通过UniProt,ExPASy,NCBI和GenBank等数据库分析匹配成功的39个蛋白点,预测扩头蔡白蚁前中肠与后肠差异蛋白功能,这些蛋白包括结构蛋白、调节蛋白、白蚁代谢蛋白和白蚁肠道微生物代谢蛋白四大类;从测序的蛋白可以看出结构蛋白占总测得蛋白的1/3,主要有储存蛋白、肌球蛋白、肌动蛋白等(表1)。储存蛋白是昆虫普遍存在的一种特异性血淋巴蛋白,通常在幼虫的脂肪体内合成,释放到血淋巴中,之后被脂肪体选择性吸收,作为氨基酸的贮存库,并对成虫发育和雌性卵发育起重要的作用(马彩霞等,2002)。肌动蛋白与整合蛋白结合在一起,组成细胞的骨架,展示特有的物理和空间结构特征(Geigeretal.,2009)。扩头蔡白蚁中高表达或高差异表达的调节蛋白有9个,主要有热激蛋白、钙调素蛋白、储铁蛋白等(表1)。其中热激蛋白是生物体在不利环境因素刺激下应激合成的一组进化上高度保守的蛋白质(曲凌云等,2004)。钙调素(CaM)作为最重要的一类Ca2+传感蛋白可通过与其下游的CaM结合蛋白(CaMBP)作用调节细胞的生理功能。因此CaMBP的研究是揭示CaM作用机制的重要内容,是探明Ca2+-CaM信号转导系统的关键。因此白蚁自身分泌调节蛋白主要是白蚁受到外界干扰或自身信号传导的影响。
白蚁代谢蛋白主要包括木质纤维素降解酶、精氨酸激酶、醛酮还原酶、二硫化物异构酶、谷胱甘肽S-转移酶等,其中精氨酸激酶是昆虫能量代谢的关键酶,与白蚁的食物消化和生长发育密切相关;另外内质网是一种高度特化的细胞器,涉及到细胞外膜蛋白和分泌蛋白的成熟,其中二硫键形成是关键的一步(Sevier and Kaiser,2002),而白蚁肠道内容物中的二硫化物异构酶和谷胱甘肽S-转移酶都有氧化还原酶的作用,推测也参与内质网折叠过程中半胱氨酸残基的巯氢基的氧化连接(Sevier and Kaiser,2006;Schröder,2008),它们通过底物蛋白的巯基-二硫化物的交换机制转移二硫键(Sevier and Kaiser,2006),形成二硫键,而这个二硫键被直接转移到分泌蛋白,参与分泌蛋白的结构形成(Tu and Weissman,2004;Seoetal.,2015)。
迄今为止,人们在白蚁肠道共生微生物中获得的外源纤维素酶基因已近千个,主要分属糖基水解酶家族的第5家族、第7家族和第45家族(GH5,GH7和GH45),并已在大肠杆菌Escherichiacoli中成功表达近百个,而白蚁内源纤维素酶基因只有约20种得到克隆,属于GH9,目前只有部分在原核表达成功的报道,所以白蚁的内源性纤维素酶需要更深入地研究。本实验成功鉴定到了参与木质纤维素降解和代谢相关的酶有5个,分别是2个白蚁内源性纤维素酶[GH9家族内切葡聚糖酶,(α/α)6结构,来源于北美散白蚁R.flavipes]、1个白蚁内切β-1,4-葡聚糖酶[GH9家族内切葡聚糖酶,(α/α)6结构,来源于山林原白蚁H.sjostedti]、1个GH11家族木聚糖酶[内切β-1,4-木聚糖酶,β-jelly roll结构),由白蚁共生原生动物产生的]、1个Cu-Zn SOD[(β-sandwich结构),来源于双翅目果蝇科花果蝇属的Scaptodrosophilalebanonensis](图3),由于木质素分解时产生细胞色素的自由基,抗氧化酶可减少自由基,已经应用于工业木质纤维素降解的预处理(Bruneetal.,1994)。而SOD可以保护中毒的白蚁消化道共生有机体的木质素降解产物,因此,它或许可以保护由木质素降解产生的氧化毒害。本实验的研究鉴定的酶都在白蚁的木质纤维素降解中起非常重要的作用,因此,下一步可以对这些酶进行分离纯化或者结构改造,提高酶的活性,应用于木质纤维素生物能源的高效降解。
