疆夜蛾Plus-C气味结合蛋白PsauOBP7的组织表达谱及配体结合特性分析
2020-10-12孙亚兰吕琪卉杨海博胡镇杰李定旭董钧锋
孙亚兰,吕琪卉,杨海博,胡镇杰,李定旭,董钧锋
(河南科技大学林学院,河南洛阳 471023)
昆虫通过嗅觉感受器(olfactory sensilla)感受外界环境中的挥发性化合物。嗅觉感受器壁与嗅觉受体神经元(olfactory receptor neurons,OSNs)树突间有极性淋巴液,其中充斥着大量的气味结合蛋白(odorant binding proteins,OBPs)。气味分子进入嗅觉感受器后需要穿过极性淋巴液屏障到达嗅觉神经元树突并最终激活嗅觉受体(odorant receptors,ORs)。在此过程中,OBPs起到了初步识别并运输气味化合物的作用(王桂荣等,2002;修伟明等,2005;Pelosietal.,2006;Leal,2013)。
昆虫中第一个被鉴定出来的气味结合蛋白来自多音天蚕Antheraeapolyphemus(Vogt and Riddiford,1981)。研究者以氚[H3]标记的多音天蚕性信息素(反,顺)-6,11-乙酸十六烷基酯[(E,Z)-6,11-hexadecadienyl acetate]作为探针,放射性分析发现,此信息素与一种蛋白结合,将其命名为信息素结合蛋白(pheromone binding protein,PBP)。随着分子克隆技术以及高通量测序技术的发展,在随后的近40年中,气味结合蛋白在多种昆虫中被鉴定出来,包括舞毒蛾Lymantriadispar(Vogtetal.,1989)、家蚕Bombyxmori(Kriegeretal.,1996)、黑腹果蝇Drosophilamelanogaster(Galindo and Smith,2001;Graham and Davies,2002)、冈比亚按蚊Anophelesgambiae(Vogt,2002;Xuetal.,2003)、烟草天蛾Manducasexta(Vogtetal.,2002)、棉铃虫Helicoverpaarmigera(Wangetal.,2004;Liuetal.,2012;Sunetal.,2012)和大蜡螟Galleriamellonella(Zhaoetal.,2019)等。
一般来说,昆虫OBPs含有6个半胱氨酸(cysteine,Cys/C)残基,这些半胱氨酸残基的位置在昆虫各目中较保守。随着越来越多的OBPs被报道,研究者发现一些OBPs中的半胱氨酸残基位置及数目并不完全一致,并将昆虫OBPs分为4种类型(Zhouetal.,2004;Pelosietal.,2006):含有6个半胱氨酸残基,分子量约为14 kD的经典气味结合蛋白(classical OBPs);含有4个半胱氨酸残基,分子量约为14 kD的minus-C OBPs;含有多于6个半胱氨酸残基,分子量约为17~25 kD的Plus-C OBPs,以及含有多于6个半胱氨酸残基,且分子量>35 kD的非典型气味结合蛋白(atypical OBPs)。在黑腹果蝇体内,共发现51个OBPs基因(Graham and Davies,2002;Vogtetal.,2002),其中39个经典OBPs具有6个半胱氨酸残基。在冈比亚按蚊基因组中,共有37个经典OBPs和35个Plus-C OBPs(Xuetal.,2003;Zhouetal.,2004)。研究者对棉铃虫触角转录组分析发现,所鉴定到的26个OBPs中共包括3个Plus-C OBPs(Liuetal.,2012)。
近20年来,荧光结合分析法(fluorescence binding assay)被广泛应用在检测OBPs的气味化合物配体结合特性实验中(Campanaccietal.,2003)。通过大肠杆菌Escherichiacoli表达重组气味结合蛋白,多种昆虫OBPs的气味化合物结合特性得到了解析。例如:荧光结合实验结果显示,小菜蛾Plutellaxylostella气味结合蛋白PxylOBP31与醛、酮、萜品油烯以及邻苯二甲酸二异丁酯相结合(覃江梅等,2016)。中红侧沟茧蜂Microplitismediator气味结合蛋白MmedOBP18对多种低挥发性植物气味化合物如2-十三酮等有较强的结合能力(宋玄等,2019)。二化螟Chilosuppressalis的一个minus-C OBP(CsupOBP1)与β-紫罗兰酮的结合能力最强(魏丹等,2013)。但总体来说,现有的气味化合物结合特性研究仍以经典OBPs为主,而其他类型的OBPs,例如Plus-C OBPs,有待更进一步发掘其生物学功能。
疆夜蛾Peridromasaucia又名绛色地老虎,是一种间歇性暴发为害的世界性农业害虫。疆夜蛾的寄主植物超过121种,包括烟草、玉米、马铃薯、高粱等(Ringsetal.,1976)。此害虫长期在北美和欧洲肆虐为害,20世纪70年代起作为入侵害虫在日本和韩国开始蔓延并逐渐成为重要的农业害虫(Strubleetal.,1976;Simonetetal.,1981;Willsonetal.,1981;Inomataetal.,2002;Choietal.,2009)。在我国,疆夜蛾最初暴发于云南省和四川省(旷昌炽,1985)。随后20多年中,此害虫在多个省份中均有分布报道(严乃胜等,2000;李密等,2007;郭敏等,2010;宣善滨等,2012)。2015年疆夜蛾在河南省洛阳市周边县区大豆田暴发为害,仅栾川县受害面积已超过6 000 hm2,其中受害严重的大豆田减产30%~60%(未发表数据)。
本研究以实验室前期工作中疆夜蛾成虫触角转录组发现的一个Plus-C OBP(PsauOBP7)为研究对象,原核表达PsauOBP7重组蛋白;利用qRT-PCR和蛋白印迹法(Western blot)检测PsauOBP7在疆夜蛾成虫不同组织及不同龄期幼虫头部的表达情况;最后通过荧光竞争结合实验分析了PsauOBP7对植物气味化合物以及疆夜蛾性信息素组分的结合能力,以期了解PsauOBP7在疆夜蛾嗅觉感受过程中的作用,同时为鳞翅目非经典气味结合蛋白的研究方法及功能提供参考。
1 材料与方法
1.1 供试昆虫
疆夜蛾幼虫采自河南省洛阳市郊区农田中,采回后在人工气候箱饲养。饲养条件:25±1℃,相对湿度70%±5%,光周期16L∶8D。化蛹后区分性别,羽化后的成虫饲以10%的蜂蜜水。将羽化后的疆夜蛾放入交配笼中交配产卵,幼虫孵化后饲以人工饲料(主要配料为大豆粉和麦胚粉)。
1.2 PsauOBP7的克隆
选取羽化后3-4 d的疆夜蛾雌、雄成虫各40头,分别剪取其触角、口器、足和翅。采用Trizol法(Invitrogen,Carlsbad,美国)提取各组织总RNA。采用反转录法把各组织中提取的总RNA合成cDNA:0.5 μg oligo-dT与1 μg总RNA混合均匀,随后的合成体系:dNTPs (10 mmol/L) 1.25 μL,反转录酶(M-MLV RT,TaKaRa,大连) 1.25 μL,M-MLV 5×反转录缓冲液5 μL,混合均匀后加无RNA酶去离子水至25 μL,37℃保温60 min。合成的cDNA直接用于PCR反应。
根据本研究组前期工作中获得的疆夜蛾触角转录组数据,依据候选PsauOBP7序列(GenBank登录号:MN686214),利用Primer Premier 6设计基因全长克隆引物(正向引物序列:5′-ATGAAAACGTT TCTTGTGTTG-3′;反向引物序列:5′-TCACTGG TGACAAAACCGGTT-3′)和qRT-PCR引物(正向引物序列:5′-CGAAGAAGAGAATAGCAATTTG-3′;反向引物序列:5′-CCGAATGTAGTTCGACGCTCC-3′)。选择PsauActin作为内参基因,正向引物序列:5′-TCATCACCATCGGAAACGAAC-3′;反向引物序列:5′-GCGTACAAGTCCTTACGGAT-3′。
克隆PsauOBP7全长基因的PCR反应体系:LA Taq DNA聚合酶1 μL(TaKaRa,大连),dNTPs (10 mmol/L) 1 μL;LA Taq DNA聚合酶缓冲液2.5 μL,雌蛾触角cDNA 0.5 μL,上下游引物(10 μmol/L)各1 μL,混匀后加去离子水至25 μL。反应程序:95℃预变性5 min;95℃ 30 s,55℃ 1 min,72℃ 40 s,35个循环;72℃ 10 min。将所获得的PCR产物连入pGEM(Promega,Fitchburg,美国)载体中,后转化大肠杆菌E.coliTop10感受态细胞,并将适量菌液涂到含有氨苄霉素的LB平板上。阳性菌斑在含有氨苄霉素的LB液体培养基上培养16 h后测序验证(生工生物工程上海股份有限公司)。
1.3 PsauOBP7的序列分析
通过ExPASy-ProtParam在线预测PsauOBP7的分子量及等电点,利用SWISS-MODEL在线模拟PsauOBP7的三维结构(Waterhouseetal.,2018),蛋白数据库中匹配的最佳三维结构预测模板为多音天蚕PBP(Zubkovetal.,2005)。
1.4 PsauOBP7在疆夜蛾成虫中的组织表达谱qRT-PCR分析
以1.2节获得的各组织cDNA为模版,在实时荧光定量PCR仪上扩增PsauOBP7基因和PsauActin基因,每个组织样品设3次生物学重复(每次生物学重复来自至少40头疆夜蛾)和3次技术重复。qPCR反应体系(25 μL):cDNA 0.5 μL,上下游引物(10 μmol/L)各1 μL,Premix Taq酶12.5 μL(TaKaRa,大连),H2O 10 μL。反应程序:94℃ 5 min;94℃ 30 s,60℃ 1 min,72℃ 30 s,44个循环。
1.5 PsauOBP7的原核表达及纯化
以去掉信号肽的PsauOBP7起始端和末端6个氨基酸对应的核苷酸序列设计引物,同时加上酶切位点(上游酶切位点:NdeI;下游酶切位点:EcoRI),用于蛋白表达实验(正向引物序列:5′-CATATGGAGTTCGTCTCACCCTTC-3′;反向引物序列:5′-GAATTCTCACTGGTGACAAAACCG-3′)(斜体处为酶切位点)。反应体系:LA Taq DNA聚合酶(TaKaRa,大连)1 μL,dNTPs (10 mmol/L) 1 μL,LA Taq DNA聚合酶缓冲液2.5 μL,cDNA 0.5 μL,上下游引物(10 μmol/L)各1 μL,混匀后加去离子水至25 μL。反应程序:95℃预变性5 min;95℃ 30 s,55℃ 1 min,72℃ 40 s,35个循环;72℃ 10 min。所获得的PCR产物连入pGEM(Promega,Fitchburg,美国)载体中,后转化至大肠杆菌Top10感受态细胞,之后将菌液涂到含氨苄霉素的LB平板上。阳性菌斑在液体LB培养基上培养16 h后测序(生工生物工程上海股份有限公司)。将测序正确的阳性菌斑提取质粒,经EcoRⅠ及NdeⅠ双酶切后连入pET-30b载体。将连接产物转化大肠杆菌Top10感受态细胞,培养2 h后将菌液涂到LB卡那霉素平板上,阳性菌斑在液体LB培养基上培养16 h后提取质粒,电泳检测后用于下一步表达实验。
为了表达PsauOBP7重组蛋白,将含有成熟蛋白序列的pET-30b载体转化BL21表达细胞,在含有卡那霉素的LB液体培养基中培养,待OD值0.6~0.8时以体积比为1 000∶1加入0.4 mol/L IPTG,37℃诱导表达2 h后离心菌液,收集细胞。将细胞超声破碎后高速离心,SDS-PAGE检测重组PsauOBP7蛋白表达于包涵体沉淀中。将回收的包涵体沉淀加入10 mL 8 mol/L尿素及100 μL 1 mol/L DTT(50 mmol/L,pH 7.4的Tris-HCl缓冲液为溶解液)彻底混匀,将上述溶液倒入透析袋中,并将透析袋放入50 mmol/L Tris-HCl(2 L,pH 7.4)缓冲液中进行透析复性。所获得的蛋白溶液用DE-52(Whatman,Salt Lake City,美国)和QFF离子交换柱进行纯化,纯化后的PsauOBP7重组蛋白用于制造多克隆抗体或荧光结合实验。
1.6 PsauOBP7在疆夜蛾成虫各组织中表达的Western blot检测
anti-PsauOBP7兔血清多克隆抗体由生工生物工程(上海)有限公司制作。剪取暴食期(4-6龄)幼虫头部以及羽化后3-4 d的疆夜蛾雌、雄成虫触角、口器、足和翅,用400~800 μL(视每种组织样品多少)0.1%的三氟乙酸将各样品充分研磨。4℃ 12 000 r/min,离心20 min后留上清。上清溶液进一步超声破碎,之后4℃ 12 000 r/min,离心30 min,上清液即为蛋白粗提物。各组织蛋白粗提物在15% SDS-PAGE变性胶上分离后进行考马斯亮蓝染色。同时,将与上述等量的各组织蛋白粗提物转入硝酸纤维膜上(Kyhse-Andersen,1984)。转膜后的蛋白经抗体孵育后,利用氯萘酚和双氧水显色。每个样品设2个生物学重复,每次重复来自至少5头幼虫或20头成虫。
1.7 荧光竞争结合实验
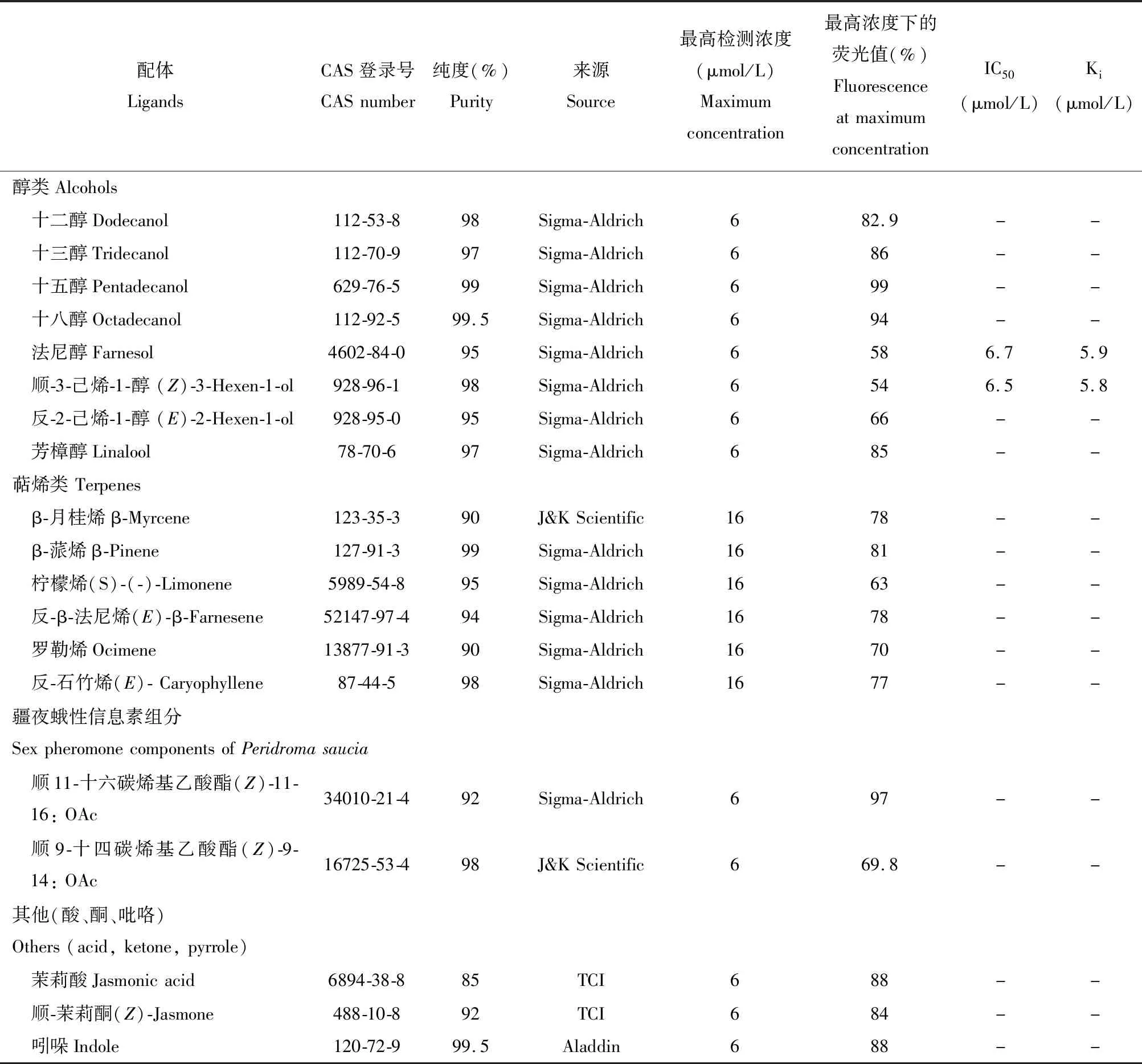
根据疆夜蛾所取食的寄主植物种类以及雌蛾性信息素组分的报道(Ringsetal.,1976;Choietal.,2009),我们选择来自疆夜蛾寄主植物气味、蜜源植物气味及雌蛾性信息素组分等共39种化合物(表1)进行荧光竞争结合实验(Knudsen and Tollsten,1993;Loughrinetal.,1995;Yanetal.,2005;Yan and Wang 2006;Choietal.,2009)。实验所用仪器为Hitachi F-4500,激发波长为337 nm,所检测的发射光谱范围为380~450 nm。实验中所用PsauOBP7重组蛋白溶解于50 mmol/L Tris-HCl缓冲液(pH 7.4)至浓度为2 μmol/L,利用浓度为1 mmol/L的1-NPN滴定蛋白质溶液,至1-NPN终浓度为16 μmol/L,记录与蛋白的结合值,重复3次。竞争性结合实验:逐次加入1 mmol/L竞争性气味化合物配体,至终浓度为6~16 μmol/L。竞争性配体的解离常数Scatchard方程计算公式为:Ki=[IC50]/(1+[1-NPN]/K1-NPN)。
1.8 数据分析
根据2-ΔΔCT法(Schmittgen and Livak,2008)计算PsauOBP7基因在各组织中的相对表达量,通过GraphPad Prism7软件进行单因素方差分析(one-way ANOVA,Tukey氏多重比较)并绘制柱形图。
2 结果
2.1 PsauOBP7基因的克隆及序列分析
通过RT-PCR的方法,在疆夜蛾触角中克隆得到PsauOBP7的cDNA序列。PsauOBP7共有190个氨基酸,预测分子量为21.69 kD,等电点为5.06。PsauOBP7共有8个半胱氨酸残基,其羧基端比经典OBPs多两个半胱氨酸残基。在线构建三维结构发现,PsauOBP7特有的2个半胱氨酸残基位于羧基端的最后一个α螺旋末端,并不参与PsauOBP7结合腔的组成(图1)。
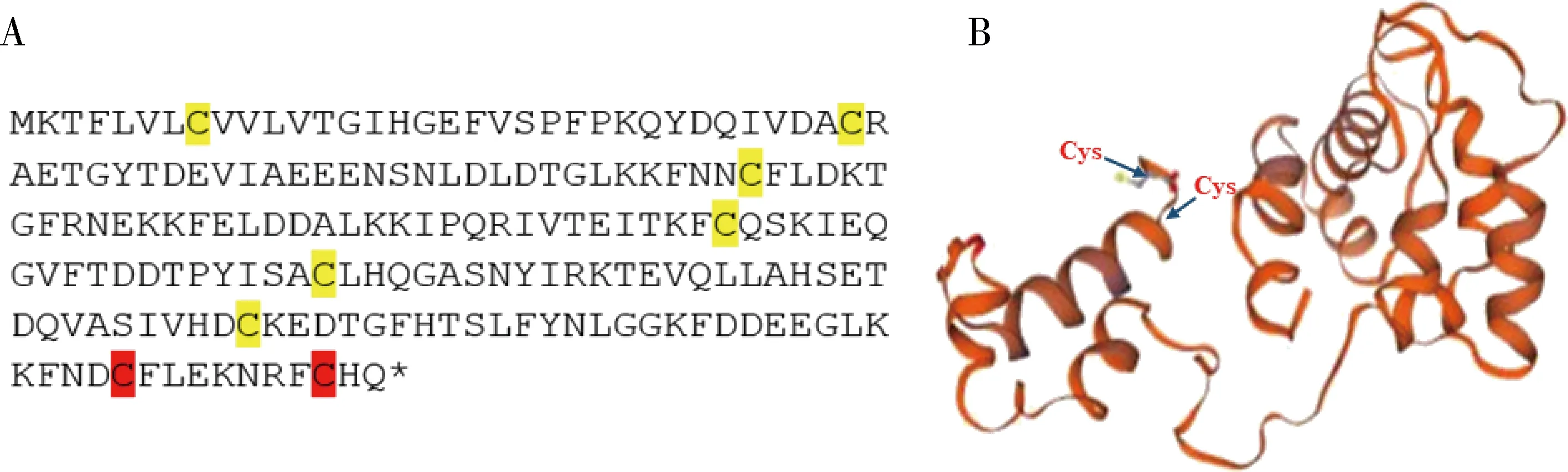
图1 疆夜蛾PsauOBP7氨基酸序列(A)以及模拟的三维结构(B)Fig.1 Amino acid sequence (A) and three-dimensional modeling (B) of PsauOBP7 of Peridroma sauciaA图中黄色标注部分为经典的6个半胱氨酸残基,红色标注部分为PsauOBP7特有的2个半胱氨酸残基。B图中,蓝色箭头指向其羧基端特有的2个半胱氨酸(Cys)残基。Six typical cysteine residues are highlighted in yellow,and cysteine residues specific to PsauOBP7 are highlighted in red in figure A.The blue arrows in figure B indicate two cysteine residues specific to the carboryl terminus of PsauOBP7.
2.2 PsauOBP7在疆夜蛾成虫中的组织表达谱
通过qRT-PCR分析发现,PsauOBP7表达于疆夜蛾雌蛾和雄蛾的触角、口器、足和翅中。除了在雄蛾触角中的表达量显著高于雌蛾翅(P=0.026)和雄蛾翅(P=0.032)中的外,其在所检测的其他组织中的表达量均无显著差异(P>0.05)(图2)。
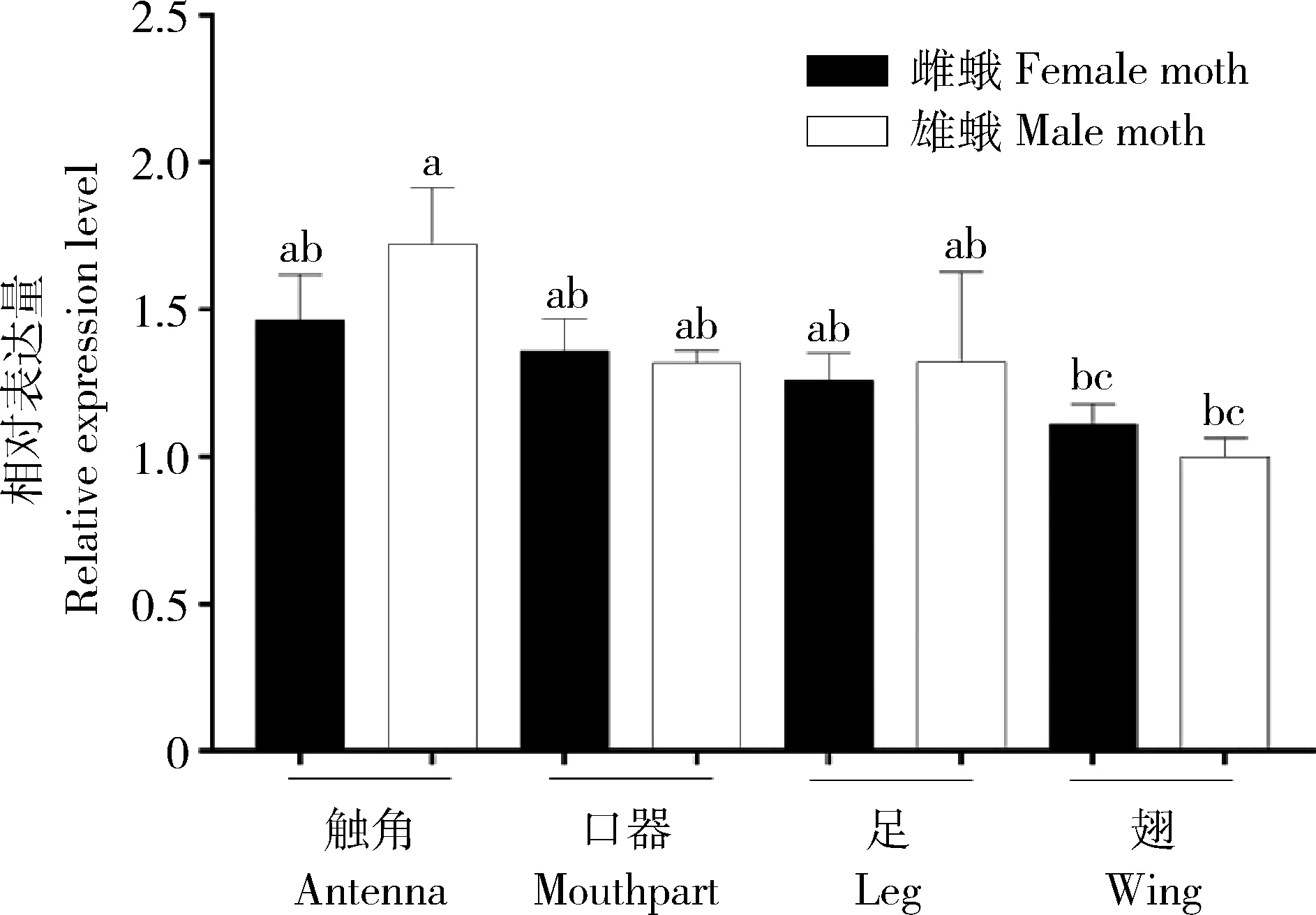
图2 qRT-PCR检测PsauOBP7在疆夜蛾成虫不同组织中的表达量Fig.2 Expression levels of PsauOBP7 in different tissues of Peridroma saucia adults detected by qRT-PCR图中数据为平均值±标准差;柱上不同字母表示基因表达量在不同组织间存在显著差异(P<0.05,one-way ANOVA方差分析,Tukey氏多重比较)。Data in the figure are mean±SD.Different letters above bars indicate significant different in the gene expression level among different tissues (P<0.05,one-way ANOVA analysis,Tukey’s multiple comparison test).
2.3 PsauOBP7的重组表达及纯化
PsauOBP7表达于原核细胞超声破碎后的包涵体沉淀中,分子量大约为21 kD,通过离子交换柱纯化后的PsauOBP7重组蛋白浓度约为0.3 mg/mL(图3)。
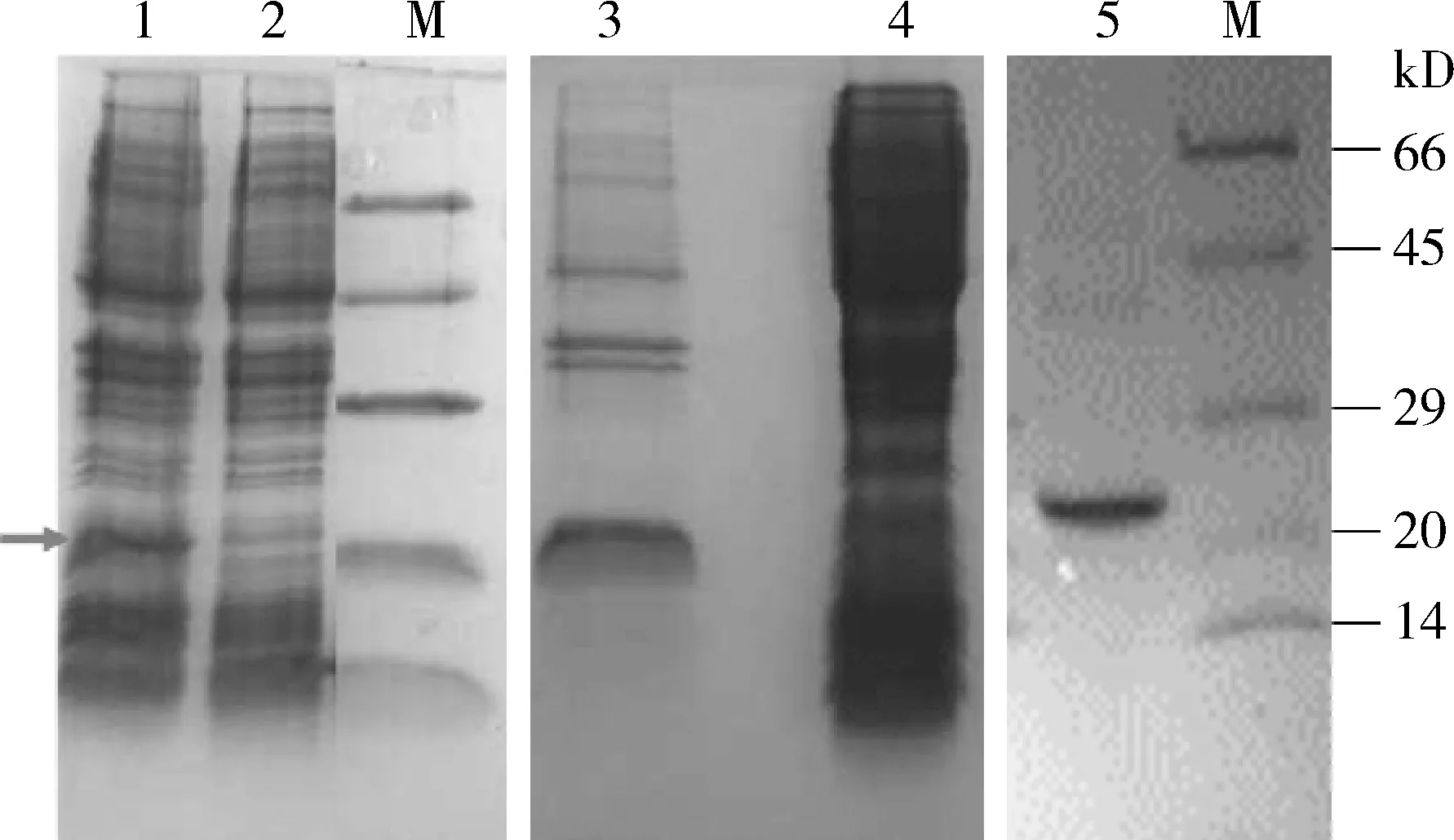
图3 疆夜蛾PsauOBP7重组蛋白的表达与纯化Fig.3 Expression and purification of the recombinant PsauOBP7 of Peridroma sauciaM:蛋白质分子质量标准 Protein molecular weight marker;1:经IPTG诱导的大肠杆菌Escherichia coli after induction with IPTG;2:未经IPTG诱导的大肠杆菌 E.coli before induction with IPTG;3:超声破碎后的沉淀Pellets of E.coli after sonication;4:超声破碎后的上清液Supernatant of E.coli after sonication;5:纯化后的重组蛋白PsauOBP7 Recombinant protein PsauOBP7 after purification.箭头示目的蛋白。The target protein is indicated by an arrow.
2.4 PsauOBP7在疆夜蛾成虫不同化学感受器官中的表达
纯化后的PsauOBP7重组蛋白能与anti-PsauOBP7多克隆抗体特异结合并显色,表明anti-PsauOBP7多克隆抗体能满足后续的Western blot检测(图4)。
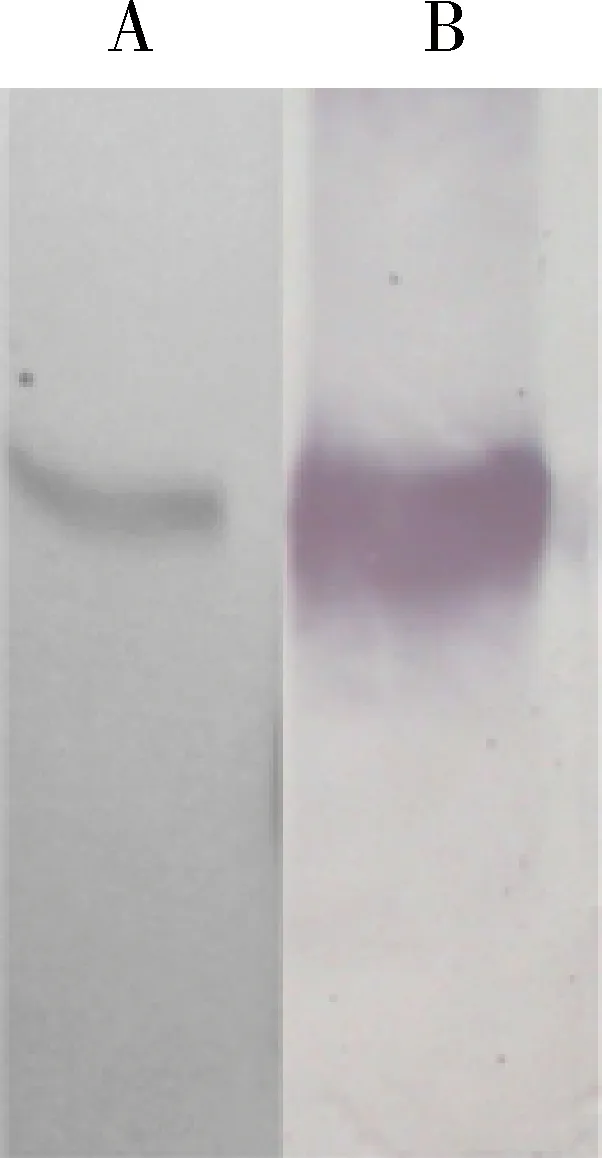
图4 纯化后的疆夜蛾重组蛋白PsauOBP7的SDS-PAGE (A)和Western blot检测(B)Fig.4 SDS-PAGE (A) and Western blot (B) analysis of the purified recombinant protein PsauOBP7 of Peridroma saucia
通过对疆夜蛾雌蛾和雄蛾的触角、口器、足和翅的蛋白粗提物进行Western blot检测,发现PsauOBP7均表达于这些组织中,且在不同组织和不同性别间的表达量相近(图5)。
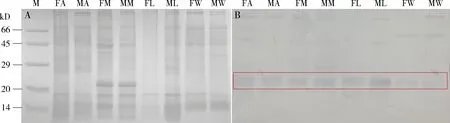
图5 SDS-PAGE (A)和Western blot (B)分析PsauOBP7在疆夜蛾成虫不同组织中的表达Fig.5 SDS-PAGE (A) and Western blot (B) analysis of PsauOBP7 expression in different tissues of Peridroma saucia adultM:蛋白质分子量标准Protein molecular weight marker.FA:雌蛾触角Female antennae;MA:雄蛾触角Male antennae;FM:雌蛾口器Female mouthpart;MM:雄蛾口器Male mouthpart;FL:雌蛾足Female leg;ML:雄蛾足Male leg;FW:雌蛾翅Female wing;MW:雄蛾翅Male wing.红色框部分为PsauOBP7在不同组织中的显色条带。Red box indicates the colored bands of PsauOBP7 in different tissues.
2.5 PsauOBP7在疆夜蛾幼虫头部中的表达
PsauOBP7在疆夜蛾4-6龄幼虫头部均有分布,且表达量相近(图6)。
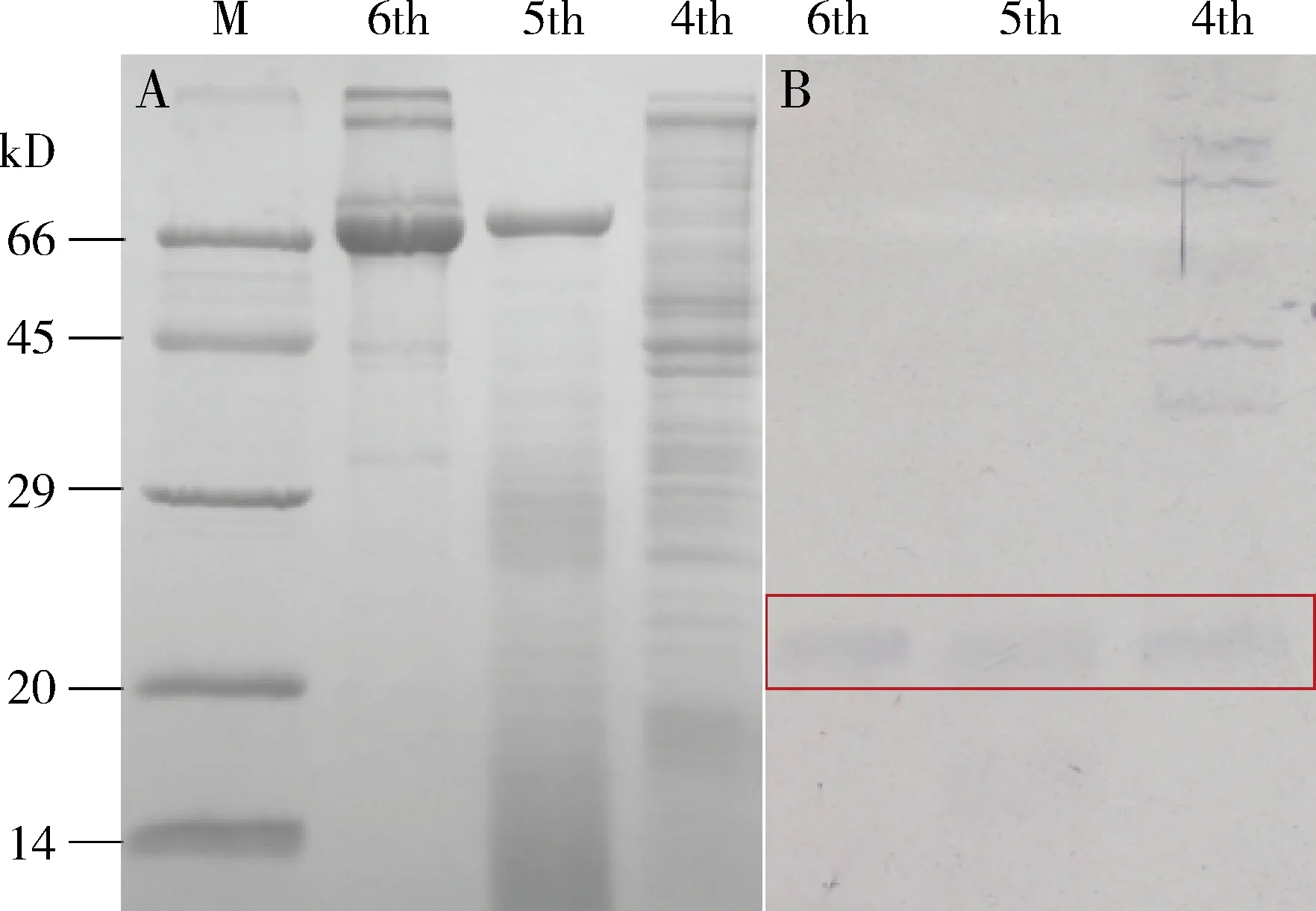
图6 SDS-PAGE (A)和Western blot (B)分析PsauOBP7在不同龄期疆夜蛾幼虫头部的表达Fig.6 SDS-PAGE (A) and Western blot (B) analysis of PsauOBP7 in heads of different instar larvae of Peridroma sauciaM:蛋白质分子量标准Protein molecular weight marker.4th:4龄幼虫4th instar larva;5th:5龄幼虫5th instar larva;6th:6龄幼虫6th instar larva.红色框住部分为PsauOBP7在不同龄期幼虫头部组织中的显色条带。Red box indicates the colored bands of PsauOBP7 in heads of different instar larvae.
2.6 荧光竞争性结合实验分析重组蛋白PsauOBP7的配体结合特性
1-NPN与PsauOBP7重组蛋白的解离常数为3.79 μmol/L (图7)。荧光竞争结合实验表明,PsauOBP7重组蛋白与反-2-己烯醛的结合能力最强,Ki值为1.4 μmol/L。此外,PsauOBP7与乙酸月桂酯、顺-3-己烯乙酸酯、乙酸苯乙酯、苯甲酸己酯和肉桂酸甲酯这5种酯类化合物有一定的结合能力,Ki值分别为5.7,6.5,8.9,9.5和10.2 μmol/L。两种醇类化合物顺-3-己烯-1-醇(Ki=5.8 μmol/L)和法尼醇(Ki=5.9 μmol/L)也与PsauOBP7有较强的结合能力(表1)。
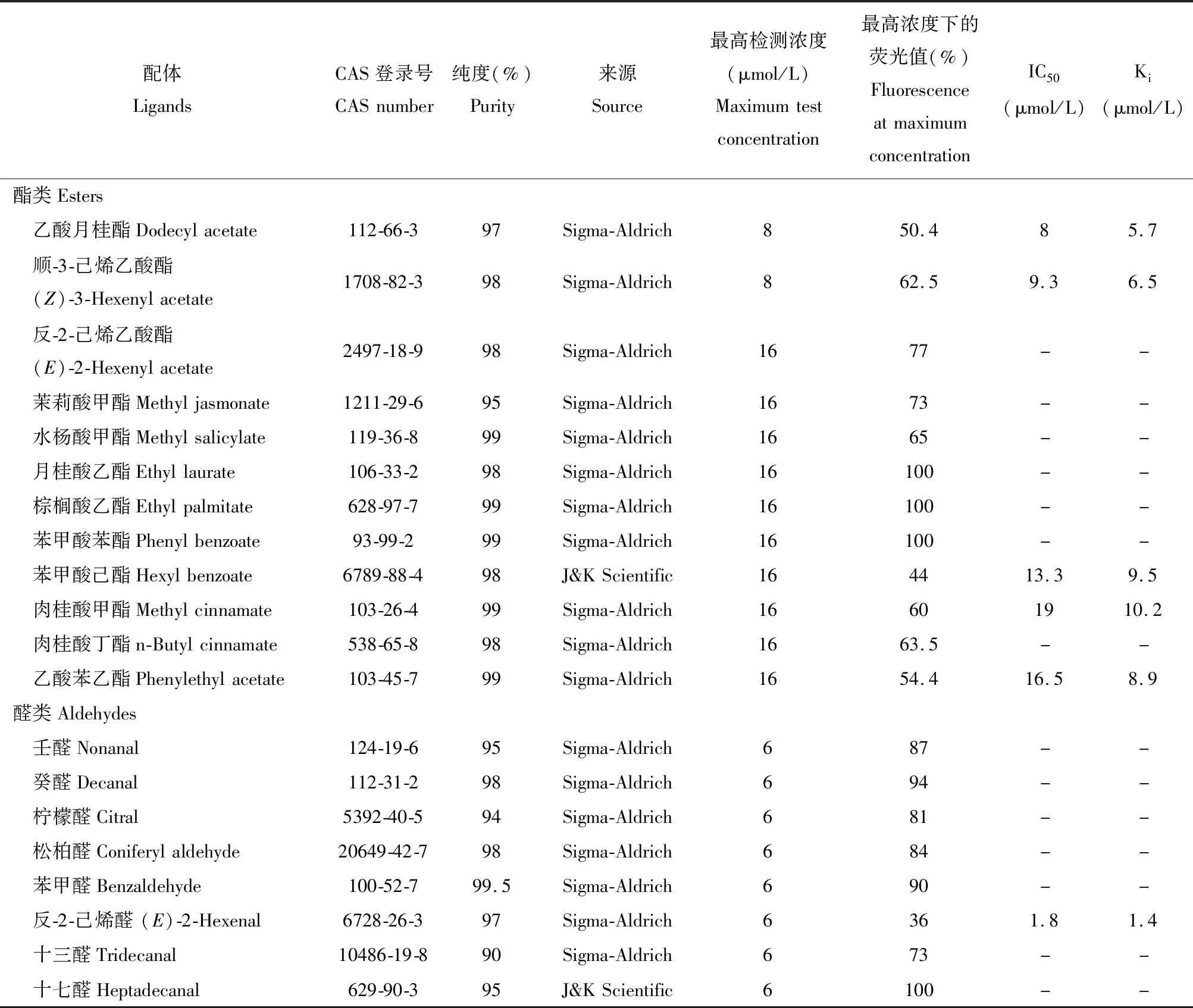
表1 PsauOBP7与候选气味化合物的结合能力Table 1 Binding capability of PsauOBP7 to candidate odorants
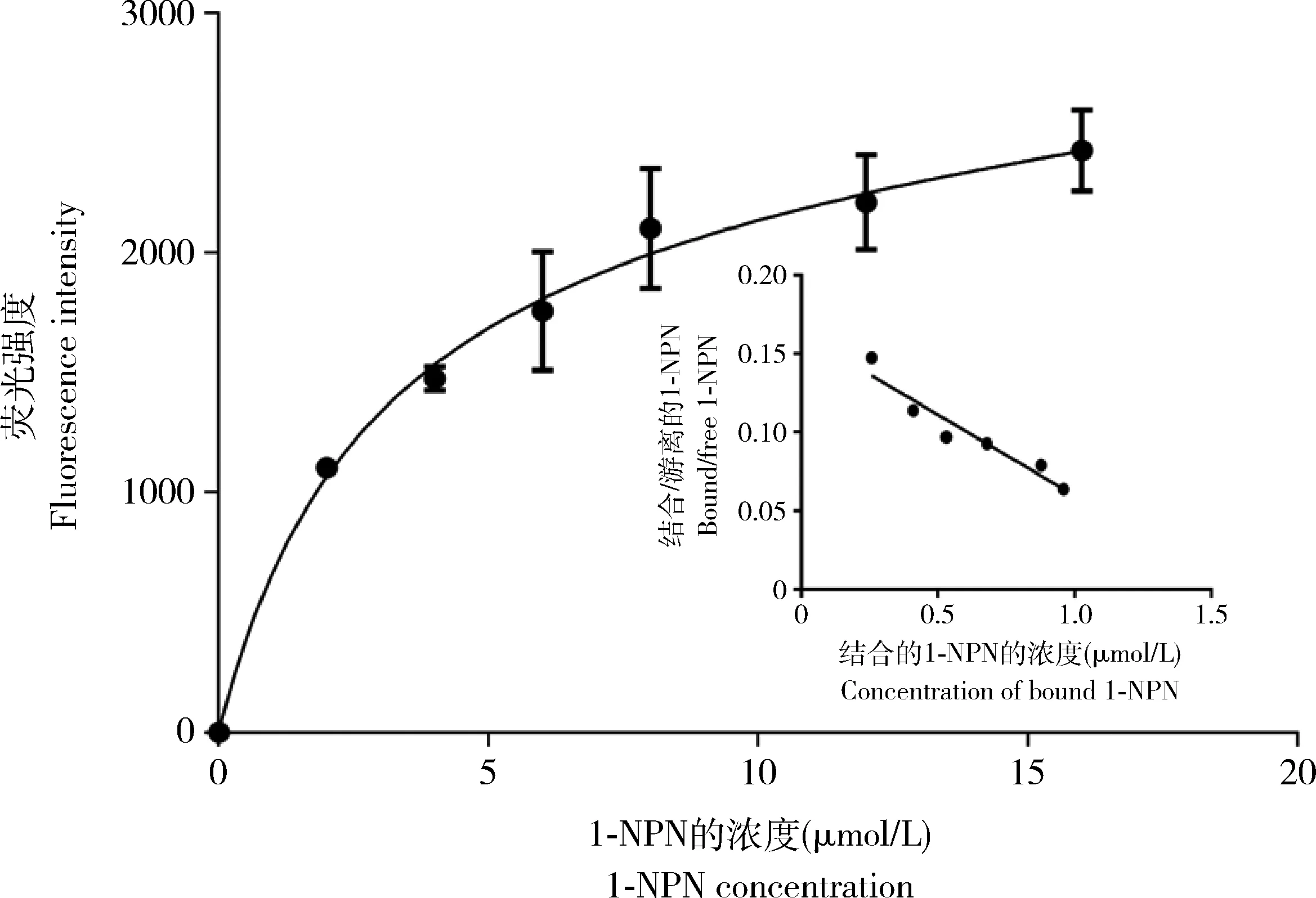
图7 1-NPN和疆夜蛾重组蛋白PsauOBP7的结合曲线及Scatchard方程Fig.7 Binding curve and Scatchard plot of 1-NPN to the recombinant protein PsauOBP7 of Peridroma saucia
3 讨论
昆虫经典的气味结合蛋白有6个半胱氨酸残基,在固定位置形成二硫键(C1-C3,C2-C5,C4-C6)(Lealetal.,1999;Braidetal.,2001)。本研究中的疆夜蛾PsauOBP7有8个半胱氨酸残基,分子量约为21 kD,属于Plus-C OBPs亚家族中的一员。序列分析以及三维结构在线预测结果表明,与经典气味结合蛋白相比,PsauOBP7羧基端多出的30多个氨基酸(包括2个半胱氨酸残基)位于结合腔外。根据鳞翅目昆虫气味结合蛋白释放气味化合物的分子机制(Lealetal.,1999,2005;Xu and Leal,2008;Xuetal.,2011),我们推测,PsauOBP7在中性的感受器淋巴液中运输气味分子,到达pH值较低的嗅觉受体神经元树突膜附近后,其三维构象发生改变,羧基末端的氨基酸伸入结合腔中,促使蛋白将气味分子释放出来。
一般来说,OBPs表达于触角感受器的淋巴液中。在早期的研究中,识别鳞翅目昆虫气味结合蛋白的一个主要依据就是该蛋白专一表达于触角中(Pelosi and Maida,1995)。随着研究的深入,发现多数OBPs表达于不止一种组织中,除触角外,还包括下颚须、喙、足、翅等嗅觉或味觉器官中(Guoetal.,2012;Leal,2013)。在本研究中,我们通过qRT-PCR以及Western blot的方法,发现PsauOBP7表达于疆夜蛾成虫多种化学感受器官中,包括雌蛾和雄蛾的触角、口器、足和翅(图2和5),说明PsauOBP7不仅参与了疆夜蛾的嗅觉感受过程,也可能结合味觉信息化合物,参与味觉感受过程。此外,我们还发现PsauOBP7表达于疆夜蛾4,5及6龄幼虫头部(图6),说明PsauOBP7可能与幼虫的嗅觉或味觉识别功能有关,在疆夜蛾幼虫对寄主植物的识别过程中发挥作用。
续表1 Table 1 continued
在随后的竞争结合实验中,我们共检测了包括酯类、醛类、醇类以及疆夜蛾信息素组分等39种气味化合物,结果表明PsauOBP7重组蛋白与3种化合物反-2-己烯醛、顺-3-己烯-1-醇和顺-3-己烯乙酸酯有较强的结合能力(表1)。作为绿叶气味物质(green leaf volatiles,GLVs),这3种化合物在玉米、棉花和烟草等多种植物中释放(Loughrinetal.,1995;Yanetal.,2005;Yan and Wang,2006),说明PsauOBP7在疆夜蛾识别寄主植物过程中起到重要作用。同时,PsauOBP7与酯类化合物,包括乙酸月桂酯、苯甲酸己酯、肉桂酸甲酯、乙酸苯乙酯有一定的结合力(表1)。已知开花植物的花朵或被害虫取食后的植物枝叶中均可释放此类气味化合物(Knudsen and Tollsten,1993;Röse and Tumlinson,2004),推测疆夜蛾成虫可通过PsauOBP7感受此类化合物从而寻找合适的产卵或蜜源地,而幼虫可由此寻找合适的寄主植物。此外,PsauOBP7还可结合法尼醇,这种化合物低挥发性的特点暗示其可能在疆夜蛾近距离识别寄主植物过程中起重要作用。
此外,鉴于PsauOBP7广泛表达于本研究中所检测的幼虫头部和成虫的多种化学感受器官中,一方面说明PsauOBP7的功能具有多样性,也可能说明PsauOBP7功能很保守,不同组织都需要。因此,在今后的实验中,如果能检测PsauOBP7在其他非化学感受器官的表达情况,同时广泛筛选PsauOBP7对味觉相关的气味化合物以及其他体内代谢物的结合能力,会对我们更深一步了解PsauOBP7的功能提供更多的参考。
综上所述,作为Plus-C气味结合蛋白家族中的一员,PsauOBP7表达于疆夜蛾幼虫和成虫的化学感受器官中,结合多种植物气味化合物,该研究结果对我们进一步开展疆夜蛾幼虫和成虫的行为实验有指导意义。此外,本结果对我们研究其他Plus-C气味结合蛋白的功能有一定的参考价值。
