褐飞虱丝氨酸蛋白酶抑制剂基因Nlserpin4的克隆及表达模式分析
2020-10-12王正亮朱杭锋潘海波俞晓平
王正亮,朱杭锋,潘海波,俞晓平
(中国计量大学生命科学学院,浙江省生物计量及检验检疫技术重点实验室,杭州 310018)
丝氨酸蛋白酶抑制剂(serine protease inhibitor,serpin) 是广泛存在于昆虫体内一类结构保守、功能多样的蛋白酶抑制剂超家族,参与调控虫体生长发育、激素分泌和免疫应答等诸多重要生理过程(赵丽芳等,2016;Meekinsetal.,2017)。Serpin分子量大小一般在40~50 kD,蛋白质序列N末端存在serpin的特有结构域,C末端存在由大约20个氨基酸残基组成的反应中心环(reactive center loop,RCL)。Serpin的靶蛋白酶识别切割RCL的活性裂解位点并与之共价结合,以不可逆的自杀性机制失活,从而阻断蛋白酶水解级联过程,抑制免疫应答反应(Huntington,2011)。鉴于其重要的免疫调控功能,昆虫serpin一直备受国内外研究者关注(Ooietal.,2015;魏川川等,2017;朱笑婷等,2017;Shakeeletal.,2019)。
在昆虫中,serpin最初从家蚕Bombyxmori血淋巴中分离获得,之后又在烟草天蛾Manducasexta体内被检测到,主要通过抑制丝氨酸蛋白酶级联反应,进而负调控Toll信号通路和酚氧化酶原激活通路,以防止过量的抗菌肽表达和过度的黑化反应对昆虫自身造成的伤害(Zhaoetal.,2012;Li Betal.,2017;Li Metal.,2018)。目前相关研究主要集中在一些隶属双翅目和鳞翅目的模式昆虫中。如黑腹果蝇Drosophilamelanogaster全基因组含有29个serpin基因,功能研究显示其中Spn43Ac通过参与Toll信号通路而调节宿主的先天性免疫反应,Spn27A能有效抑制酚氧化酶原级联反应而调控宿主应对外来入侵物的防御响应(Levashinaetal.,1999;Ligoxygakisetal.,2002)。在烟草天蛾中,serpin1J和serpin5分别通过抑制宿主血淋巴蛋白酶HP8和HP6而对Toll信号通路进行负调控,与果蝇Spn27A同源的serpin3则可通过抑制酚氧化酶原的激活而阻断黑化反应的进程(Zhuetal.,2003;Anetal.,2011)。然而,针对其他科目的昆虫,特别是一些重要农业害虫中serpin的免疫调控功能研究较少,相关研究有待加强。
褐飞虱Nilaparvatalugens隶属半翅目(Hemiptera)飞虱科(Delphacidae),是我国水稻上的主要害虫,不仅直接吸食水稻汁液,造成枯干倒伏(即“虱烧”),而且还能传播水稻病毒病,对水稻生产造成毁灭性损失(吕进等,2013)。微生物防治是当前褐飞虱综合防控中的优选策略(陈列忠等,2006;Jinetal.,2011)。然而,其防效在很大程度上受到宿主昆虫自身免疫防御系统的制约,极大限制了相关微生物农药的开发及规模化应用(Lu and St Leger,2016;Qu and Wang,2018)。因此,研究褐飞虱的免疫调控机制对于开发褐飞虱生物防治技术工作具有重要理论和现实意义。本研究以褐飞虱为研究对象,对其免疫调控因子Nlserpin4基因进行克隆鉴定和生物学信息分析,并利用qRT-PCR分析该基因的时空表达谱以及病原真菌诱导表达模式,以期为深入研究褐飞虱serpin的生物学功能奠定基础,也为利用serpin基因进行褐飞虱虫害治理提供理论依据。
1 材料与方法
1.1 供试昆虫和病原真菌
供试褐飞虱种群为本实验室保存建立,于人工气候室内(温度24±1℃、相对湿度70%±5%、光周期16L∶8D)以TN1水稻苗饲养,维持种群。金龟子绿僵菌Metarhiziumanisopliae菌株Ma456于PDA(马铃薯葡萄糖琼脂培养基)斜面上4℃保存,25℃培养传代。
1.2 褐飞虱RNA提取及cDNA合成
取羽化24 h内的褐飞虱成虫30头,首先使用75%的酒精表面消毒虫体3次,每次3 min,再用无菌蒸馏水清洗5遍。虫体后晾干置于研钵中用液氮研磨均匀。采用Trizol法提取褐飞虱总RNA,并用微量紫外分光光度计(NanoDrop ND-2000,美国)和琼脂糖凝胶电泳检测RNA的质量和浓度。以检测合格后的RNA为模板,使用PrimeScriptTM1st Strand cDNA Synthesis Kit (TaKaRa,日本)试剂盒参照说明书合成cDNA,并于-20℃保存备用。
1.3 Nlserpin4基因克隆及测序
根据本实验室测得的褐飞虱转录组数据,结合GenBank中褐飞虱全基因组信息,筛选获得一条注释为褐飞虱丝氨酸蛋白酶抑制剂serpin的cDNA序列,命名为Nlserpin4。使用Primer Premier 5设计Nlserpin4扩增引物cS4F(5′-ATGGTGGTCTTCAAA CAAATGGTTC-3′)和cS4R(5′-TCAATTTCCAGTATA TTTTCCACTG-3′),以1.2节所得褐飞虱cDNA为模板,进行PCR扩增。PCR扩增体系:cDNA模板 2 μL,dNTPs (10 mmol/L) 4 μL,正反向引物(10 μmol/L)各1 μL,10×Buffer(含Mg2+) 5 μL,Taq酶0.5 μL,ddH2O补充至50 μL。扩增程序:94℃预变性5 min;94℃变性30 s,55℃复性30 s,72℃延伸1.5 min,35个循环;72℃延伸7 min。PCR反应完成后,用1.5%的琼脂糖凝胶电泳检测反应产物数量及分子量大小。目标扩增产物经割胶回收后与pMD18-T载体(TaKaRa,日本)连接,并转化入大肠杆菌EscherichiacoliDH5α感受态细胞中。将菌液(100 μL)涂布于含氨苄的(100 μg/mL)并涂有IPTG及X-gal的LB琼脂板上,37℃倒置培养24 h后进行蓝白斑筛选,阳性转化子送上海桑尼测序有限公司测序。
1.4 Nlserpin4基因及编码蛋白质序列分析
利用ORF Finder(http:∥www.ncbi.nlm.nih.gov/orffinder)预测Nlserpin4基因的开放阅读框,并翻译获得氨基酸序列;运用BLASTP(http:∥ blast..ncbi.nlm.nih.gov/blast.cgi)比对NCBI蛋白质数据库进一步确认目标基因,并获得同源序列;用SMART Server(http:∥smart.embl-heidelberg.de/)分析编码蛋白序列中的保守结构域;用NetNGlyc1.0 Server(http:∥www.cbs.dtu.dk/services/NetNGlyc/)进行糖基化位点预测;用ProtParam(http:∥web.expasy.org/protparam/)对编码蛋白质的分子量和等电点进行分析;用SignalP-5.0 Server(http:∥www.cbs.dtu.dk/services/SignalP/)分析信号肽序列;通用MEGA X软件以邻接(neighbor-joining,NJ)法构建系统进化树,经1 000次重复抽样检测其置信度(Kumaretal.,2018)。
1.5 Nlserpin4基因时空表达特征分析
收集褐飞虱不同发育时期(卵、1-5龄若虫以及羽化24 h的雌雄成虫)样品,其中卵300粒,1-2龄若虫分别50头,3-4龄若虫分别40头,5龄若虫30头,初羽化雌雄成虫分别为20头。褐飞虱不同组织(血淋巴、脂肪体、肠道和剩余虫体)样品取自5龄若虫。随机选取100头褐飞虱5龄若虫,首先用75%的酒精表面消毒虫体3次,每次3 min,再用无菌蒸馏水清洗5遍,晾干虫体。用解剖镊在体视显微镜下解剖收集脂肪体、肠道和剩余虫体。通过切胸足法收集血淋巴,收集的血淋巴置于冰浴的放有少量苯硫脲晶体的离心管中,并加入等体积的PBS(pH 7.4),4℃下13 000 r/min离心10 min,弃上清(张艺馨,2014)。各样品RNA提取和cDNA合成步骤同1.2节。根据Nlserpin4基因cDNA序列,设计一对定量PCR引物qS4F(5′-CGTAGAACAA CCACAACTG-3′)和qS4R(5′-ATCTCTTGTCCTGCG TTAT-3′)。qRT-PCR分析采用SYBR® Premix Ex TaqTMII试剂盒,反应体系(20 μL):2×SYBR® Premix Ex TaqTMII 10 μL,上下游引物(10 μmol/L)各1 μL,适量稀释的cDNA 2 μL和ddH2O 6 μL。扩增程序:95℃预变性30 s,进入40个扩增循环(95℃变性5 s,60℃退火34 s);融解曲线:95℃ 15 s,60℃ 1 min,95℃ 15 s。以褐飞虱RPS11基因作为内参,正向引物RPS11-F:5′-ATGGCCGACATTCT TCCAGGTCC-3′;反向引物RPS11-R:5′-CCGATCGT GTGGCGTTGAAGGG-3′。其反应体系和程序同上。每个组织或龄期样品设置3次生物学重复和3次技术重复。Nlserpin4基因在褐飞虱不同发育时期和不同组织中的相对表达量用2-ΔΔCt法(Livak and Schmittgen,2001)计算,其中以不同发育时期和组织中的最低表达量为基数,数值设为1。
1.6 Nlserpin4基因的金龟子绿僵菌诱导表达模式分析
将病原真菌金龟子绿僵菌分生孢子以0.02% Tween-80水溶液制成1×107孢子/mL浓度的悬液,用显微注射法接种5龄褐飞虱若虫,接种体积为10 nL,接种3批次,每批次注射100头,以注射相同体积的0.02% Tween-80水溶液为对照。分别于0 h(未接种),接种后6,12,24和48 h后收集虫体,用75%的酒精表面消毒虫体3次,每次3 min,再用无菌蒸馏水清洗5遍,晾干虫体备用。样品RNA提取和cDNA合成步骤同1.2节。qRT-PCR程序和基因相对表达量计算方法(2-ΔΔCt)同1.5节,以未注射组的表达量为基数,其值设为1。
1.7 数据分析
利用绘图软件 Graphpad Prism 7.0作图。利用DPS软件对实验数据进行分析与处理,计算平均值和标准误(Tang and Zhang,2013)。利用单因素方差分析(one-way ANOVA)及Tukey氏HSD (Tukey’s honestly significant difference)法对Nlserpin4基因在褐飞虱不同发育时期、不同组织以及病原真菌不同诱导时间下的表达量进行比较分析,差异显著性水平为P<0.05。
2 结果
2.1 Nlserpin4基因的克隆鉴定及序列特征
以褐飞虱cDNA 为模板扩增得到的产物经过测序和序列分析,结果显示:褐飞虱Nlserpin4基因cDNA序列(GenBank登录号:MN822802)全长1 227 bp,编码408个氨基酸,分子量大小为45.91 kD,等电点6.23。SMART预测显示Nlserpin4氨基酸序列在第39-408位氨基酸残基之间含有一个serpin家族特有的保守性结构域。NetNGlyc1.0预测表明Nlserpin4蛋白无糖基化位点。信号肽预测结果显示Nlserpin4包含一个长度为23个氨基酸信号肽序列(图1)。多序列比对显示,与其他昆虫serpin相似,Nlserpin4在C末端具有RCL区,其中第367位苯丙氨酸(Phe)和第368位丙氨酸(Ala)之间为预测的被靶蛋白酶特异性识别的活性裂解位点(图2)。

图1 褐飞虱Nlserpin4基因cDNA序列及其编码氨基酸序列Fig.1 cDNA sequence and the coded amino acid sequence of Nlserpin4 of Nilaparvata lugens下划线部分为信号肽序列;RCL区以阴影显示,其中活性裂解位点以黑框表示;星号为终止密码子。Signal peptide sequence is underlined.The RCL region is shaded and the active cleavage site is marked with box.Asterisk indicates the termination codon.

图2 褐飞虱Nlserpin4与其他昆虫同源蛋白质序列RCL区多序列比对Fig.2 Multiple sequence alignment of the RCL region of Nlserpin4 from Nilaparvata lugens with those of homologous serpins from other insect speciesSeripn蛋白来源物种Origin species of serpins:Apserpin4:豌豆蚜Acyrthosiphon pisum;Sfserpin4:蔗黄伪毛蚜Sipha flava;Nlserpin4:褐飞虱Nilaparvata lugens;Clserpin4:温带臭虫Cimex lectularius;Lhserpin4:阿根廷蚁Linepithema humile;Oaserpin4:寄生树黄蜂Orussus abietinus;Btserpin4:烟粉虱Bemisia tabaci;Bmserpin4:家蚕Bombyx mori.RCL区预测活性裂解位点以阴影显示;星号和冒号分别代表完全保守的和大部分相似的的氨基酸。The predicted active cleavage site in the RCL region is shaded.Asterisk and colon indicate completely conserved and partially similar amino acids,respectively.
2.2 Nlserpin4蛋白的序列比对及进化树
利用Blast同源性搜索比对,发现Nlserpin4蛋白与褐飞虱全基因组中预测的serpin-4 (GenBank登录号:AGK40928)氨基酸序列完全一致。Nlserpin4氨基酸序列与蔗黄伪毛蚜Siphaflavaserpin4(GenBank登录号:XP_025406327)的一致性最高,为40.26%。其次为与温带臭虫Cimexlectulariusserpin4(GenBank登录号:XP_014251604),两者氨基酸序列一致性为39.95%。采用MEGA6.0软件以邻接法将Nlserpin4与其他17种昆虫的serpin构建系统进化树,结果显示:包括褐飞虱Nlserpin4在内所有半翅目昆虫serpin聚为一支,并与膜翅目昆虫serpin互为姐妹群,与鳞翅目昆虫家蚕Bombyxmoriserpin4亲缘关系较远(图3)。
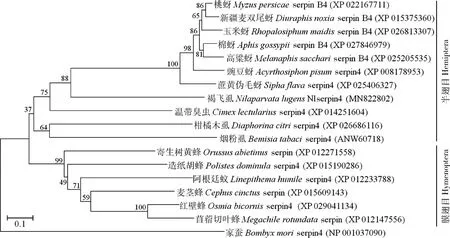
图3 基于氨基酸序列采用邻接法构建的褐飞虱和其他昆虫serpin蛋白系统发育树(1 000次重复)Fig.3 Phylogenetic tree of serpin proteins from Nilaparvata lugens and other insects based on amino acid sequences by neighbor-joining method (1 000 replicates)
2.3 Nlserpin4基因时空表达特征
褐飞虱Nlserpin4基因在宿主不同发育时期和若虫不同组织部位中的表达量如图4所示。结果表明,Nlserpin4基因在褐飞虱的卵期、若虫期和雌雄成虫中均有表达,且在成虫期表达量显著高于卵期和若虫期(P<0.05)。雄成虫中Nlserpin4表达量最高,分别是雌成虫、卵和若虫期表达量(1-5龄若虫期表达量的平均值)的1.5,5.0和6.8倍。Nlserpin4表达量在1-3龄若虫中无显著性差异(P>0.05),此后随龄期增加而显著上升,如4龄和5龄若虫中Nlserpin4表达量较低龄若虫期表达量(1-3龄若虫期表达量的平均值)分别增加了2.1和3.2倍(图4:A)。Nlserpin4基因在5龄若虫脂肪体、血淋巴、肠道和剩余虫体中均有表达,且在剩余虫体组织中表达量最高。此外,在血淋巴中Nlserpin4表达量显著高于肠道和脂肪体(P<0.05),分别是肠道和脂肪体中表达量的2.5和2.9倍(图4:B),但Nlserpin4表达量在5龄若虫肠道和脂肪体中差异不显著(P>0.05)。
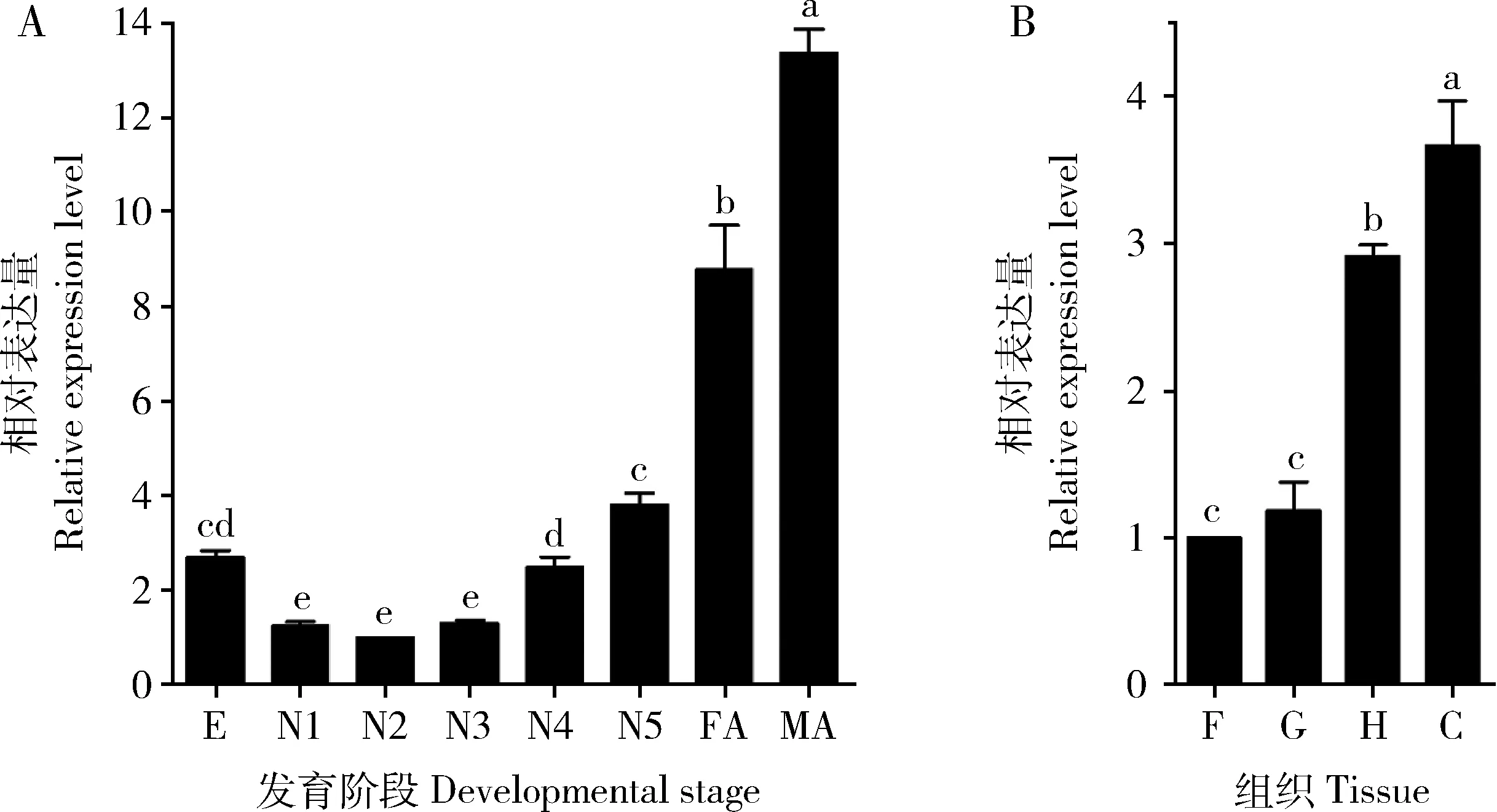
图4 Nlserpin4在褐飞虱不同发育时期(A)和5龄若虫不同组织(B)中的表达模式Fig.4 Expression profiles of Nlserpin4 during different developmental stages (A) and different tissues of the 5th instar nymphs (B) of Nilaparvata lugensE:卵Egg;N1- N5:分别为 1-5龄若虫1st-5th instar nymph,respectively;FA:雌成虫Female adult;MA:雄成虫Male adult;F:脂肪体Fat body;G:肠道Gut;H:血淋巴Hemolymph;C:剩余虫体Carcass.图中数据为平均值±标准误,柱上不同字母表示不同发育阶段或不同组织间基因表达量差异显著(P<0.05,one-way ANOVA检验)。Data in the figure are mean±SE,and different letters above bars indicate significant difference in the gene expression level among different developmental stages or tissues (P<0.05,one-way ANOVA test).
2.4 金龟子绿僵菌侵染后Nlserpin4的表达模式
用金龟子绿僵菌分生孢子悬液(1×107孢子/mL)显微注射接种褐飞虱5龄若虫,检测诱导不同时间后褐飞虱Nlserpin4的表达量,结果如图5所示。与对照组(注射0.02% Tween-80水溶液)相比,病原真菌诱导(处理组)48 h内各时间点Nlserpin4表达量均呈显著下调(P<0.05);在金龟子绿僵菌刺激6 h后,Nlserpin4表达量最低,仅为对照的50%水平(P<0.05);随着诱导时间的增加,Nlserpin4表达量呈回升趋势,如诱导24 h和48 h后其表达量显著上升,分别是诱导6 h时的1.4和1.6倍,但与对照组相比依然是下调,且差异达到显著水平(P<0.05)(图5)。
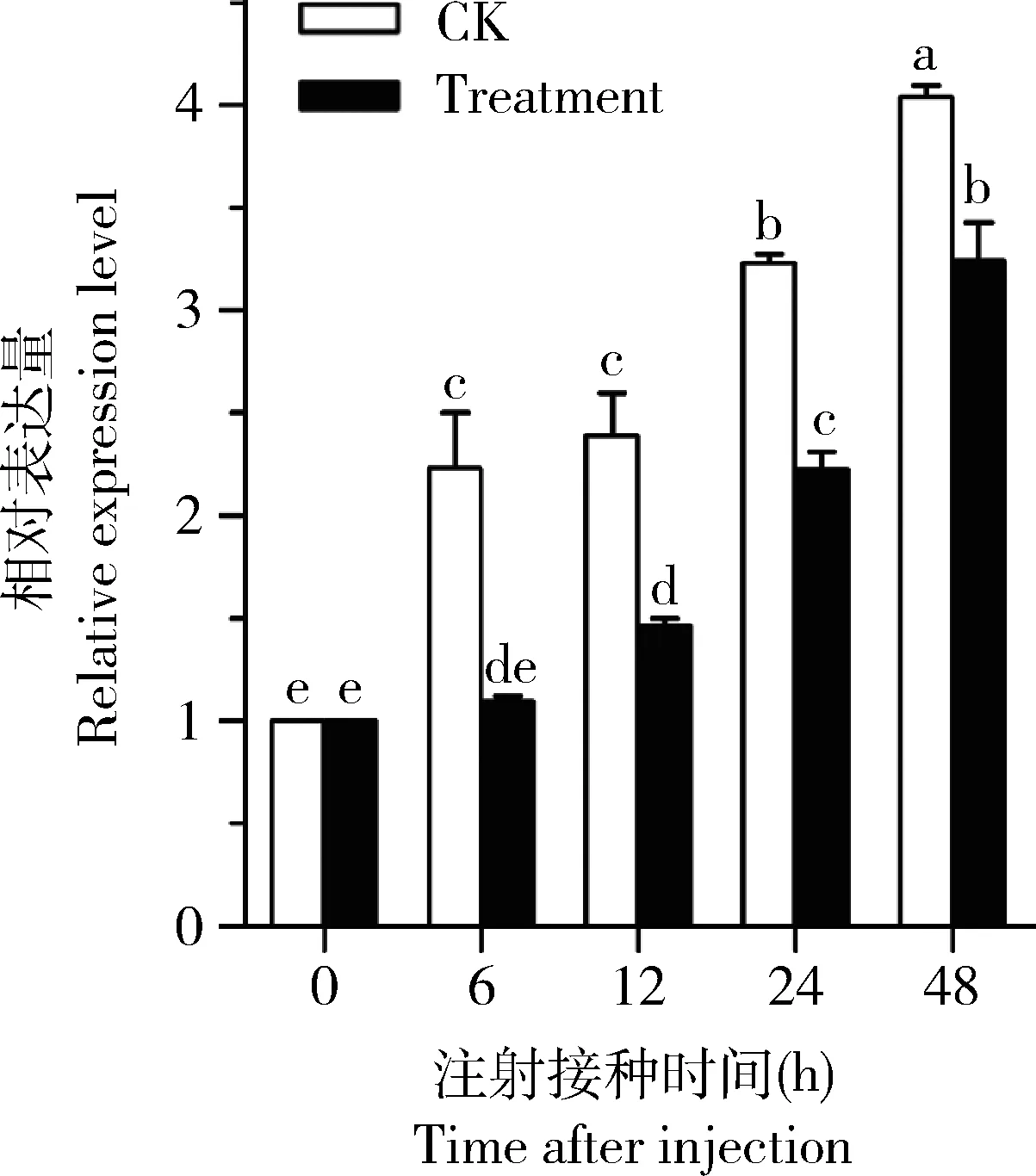
图5 金龟子绿僵菌(1×107孢子/mL孢子悬液)侵染褐飞虱5龄若虫后Nlserpin4的诱导表达模式Fig.5 Expression pattern of Nlserpin4 in the 5th instar nymphs of Nilaparvata lugens after infection with Metarhizium anisopliae (1×107 conidia/mL spore suspension)CK:对照组(注射0.02% Tween-80) Control group (injected with 0.02% Tween-80);Treatment:处理组Treatment group.图中数据为平均值±标准误,柱上不同字母表示不同时间点间基因表达量差异显著(P<0.05,one-way ANOVA检验)。Data in the figure are mean±SE and different letters above bars indicate significant difference in the gene expression level among different time post injection (P<0.05,one-way ANOVA test).
3 讨论
Serpin是一类广泛分布于动物、植物和微生物中的蛋白酶活性调节剂,参与调节生物体内一系列重要的生理和病理过程(Lucasetal.,2018;Cohenetal.,2019)。近年来,serpin家族成员及其生物学功能已经在许多昆虫中被分离和鉴定,但相关研究主要集中于一些模式昆虫,如果蝇、蚊和家蚕(Gulleyetal.,2013;Gaoetal.,2018;Katsukawaetal.,2018),而对于飞虱科重要农业害虫的相关研究则相对贫乏。本研究成功从水稻重要害虫褐飞虱中克隆了Nlserpin4基因的全长cDNA序列,利用生物信息学手段分析了其序列特征,并通过qRT-PCR技术检测了其时空表达谱和病原真菌诱导表达模式。
氨基酸序列分析显示,Nlserpin4与已鉴定的其他物种serpin一样,具有保守的serpin结构域(第39-408位氨基酸残基)(图1),表明Nlserpin4属于serpin 超家族成员。目前研究发现,很多昆虫serpin在N端具有信号肽序列,如在25个小菜蛾Plutellaxylostellaserpin中,11个具有信号肽序列(Linetal.,2017)。SignalP预测显示Nlserpin4在蛋白质N端(第1-23位氨基酸残基)亦存在信号肽,表明其可能是分泌型蛋白。此外,与柞蚕Antheraeapernyiserpin6和亚洲玉米螟Ostriniafurnacalisserpin2具有糖基化位点(曾军等,2017;赵雅,2018)不同,NetNGlyc1.0预测Nlserpin4氨基酸序列中不存在糖基化位点,表明其可能是非糖基化蛋白。多序列比对显示,Nlserpin4具有serpin蛋白家族典型的RCL区,且含有能被靶标蛋白酶识别的活性裂解位点(图2)。RCL区作为捕获靶蛋白酶的“诱饵”,决定了serpin 抑制活性的专一性(Huntington,2011)。一般认为,serpin通过其RCL区与靶蛋白酶以酯键共价结合后被靶蛋白酶裂解,进而引起自身构象发生转变。Serpin构象改变继而导致靶标蛋白酶的构象变化,从而发挥蛋白酶活性抑制功能(Gettins,2002)。由系统进化树分析结果可知,Nlserpin4与同属半翅目昆虫的serpin4聚为一支,其中与蔗黄伪毛蚜和温带臭虫serpin4的亲源关系最近,而与鳞翅目昆虫家蚕serpin4亲缘关系较远(图3),该结果与Blastp比对结果一致,表明serpin4在半翅目昆虫中具有相对保守的进化特性,其聚类关系在一定程度上反映其亲缘关系。
Nlserpin4在褐飞虱各发育阶段均有表达,成虫期表达量显著高于其他龄期,1-3龄若虫期表达量显著低于卵期和高龄若虫期(图4:A),表明Nlserpin4在褐飞虱具有龄期表达特异性。Serpin的龄期特异性表达模式同样见于其他昆虫中,如烟粉虱serpin在卵期和成虫期表达量最高,其他龄期表达量则较低(冯佳颖,2016)。家蝇Muscadomesticaserpin基因SP2和SP16在2龄和3龄幼虫中呈普遍的高表达,而在卵期和成虫期表达量相对较低(魏川川等,2017)。Nlserpin4在褐飞虱各组织部位亦均有转录,但在不同组织部位的表达水平差异显著。定量PCR结果显示Nlserpin4在褐飞虱5龄若虫血淋巴中表达量最高,在肠道中次之,在脂肪体中的表达量较低(图4:B)。类似的表达模式同样见于其他昆虫serpin的研究,如家蚕serpin6的表达量在不同组织部位从高到低排列为血淋巴>肠道>脂肪体(Lietal.,2017)。然而,此表达模式与烟草天蛾serpin4基因不同,烟草天蛾serpin4在脂肪体中的表达水平明显高于其在血淋巴中的表达水平(Tong and Kanost,2005)。可见,褐飞虱Nlserpin4的表达特征具有明显时空特异性,这表明其在褐飞虱生长发育过程中可能发挥重要调控作用。
诸多研究表明,昆虫serpin主要通过抑制丝氨酸蛋白酶的活性来负调控酚氧化酶原激活系统和其他有关防御通路(如Toll通路)的蛋白酶水解级联反应,从而抑制病原微生物诱导下过度的免疫防御反应对昆虫自身造成伤害(Yuanetal.,2017;Wangetal.,2019)。目前关于serpin在昆虫-病原微生物互作过程中的表达调控研究主要以“昆虫-病原细菌”为研究模型。如烟草天蛾受大肠杆菌Escherichiacoli刺激后,幼虫血淋巴中serpin4的表达量显著上升,其表达产物可抑制丝氨酸蛋白酶的级联反应,从而阻断黑色素的合成(Tong and Kanost,2005)。昆虫病原真菌以其体壁接触侵染致死模式在防治刺吸式口器害虫方面具有独特的优势(Laceyetal.,2015)。解析刺吸式口器害虫与病原真菌之间免疫防御与免疫逃避的“攻防”关系对于开发基于病原真菌的褐飞虱生物防治新技术具有重要的理论和现实意义。本研究检测了Nlserpin4在褐飞虱注射接种病原真菌后的诱导表达模式(图5),结果显示金龟子绿僵菌处理褐飞虱初期(6 h)Nlserpin4基因表达量显著下调,表明褐飞虱免疫防御反应可能被注射进入宿主血淋巴的病原真菌显著激活;随接种时间的延长Nlserpin4基因表达量呈现回升趋势,这可能是为了缓解由病原真菌诱导的免疫防御反应的持续激活。由此可见,Nlserpin4在褐飞虱免疫防御病原真菌过程中扮演重要调控分子的角色,但其是如何调控宿主信号转导途径以及免疫应答反应的,暂不清楚,还有待于进一步研究。
