双翅目害虫性别分离技术的研究进展及展望
2020-10-12李云欣翁诗函周若涵李佳洋韩宝瑜
彭 威,李云欣,翁诗函,周若涵,潘 熙,李佳洋,韩宝瑜
(中国计量大学生命科学学院,浙江省生物计量及检验检疫技术重点实验室,杭州 310018)
双翅目病媒昆虫每年导致数百万人和家畜感染寄生虫和病毒,因而发展新型有效的防治技术显得异常重要(Kassebaumetal.,2016)。昆虫不育技术(sterile insect technique,SIT)是害虫区域防治的主要技术之一。传统的不育昆虫技术概念最早由Knipling在20世纪40年代提出来,其主要策略是通过大量人工饲养靶标害虫,经过辐射处理后,连续释放不育雄性个体,与野生靶标雌性害虫个体交配,产生不育后代,将靶标害虫种群数量控制在经济阈值之下,甚至彻底根除靶标害虫(Knipling,1955)。但传统的SIT由于使用辐照技术造成雄虫在野外生存力和交配竞争力降低,而且缺乏有效的雌雄区分手段,因此在实践中有诸多限制。SIT是一种更环保的广谱化学杀虫剂替代品,已成功应用于多种害虫的防治,但在释放之前必须先将雌性移除,这导致其防治速度放慢。除了尽量减少释放雌性所带来的健康和经济风险之外,模型和实验结果还表明仅释放雄性比同时释放雄性和雌性更具成本效益(Knipling,1955;Rendonetal.,2004)。节约的成本可能是由于昆虫大规模饲养的成本降低和田间释放的雄性不会被同时释放的雌性所吸引。
其他遗传防治措施包括释放携带显性致死的昆虫不育技术(release of insects carrying a dominant lethal,RIDL)和基于沃尔巴克氏体Wolbachia的昆虫不相容技术(incompatible insect technique,IIT)。RIDL通过释放携带可抑制的显性致死转基因雄虫与野生雌虫交配,导致后代在特定发育阶段或特定性别中条件致死(Thomas,2000)。由于需要释放大量转基因个体使得其应用成本相当昂贵,且四环素抑制系统会降低RIDL雄虫的适应性(Alpheyetal.,2010)。IIT通过释放携带与野生雌蚊不同沃尔巴克菌型的雄蚊,从而诱发胞质不相容,使雌蚊不育(Sinkins,2004;Panagiotis and Bourtzis,2007)。IIT虽然不会降低雄蚊的竞争交配力和生存力,但是在田间条件下严格要求没有感染的雌性被释放是极其困难的。模型实验显示,释放只有一小部分感染Wolbachia的雌性会导致种群替代而不是种群灭绝。雌性蚊子能传播病原菌,任何遗传控制策略中都不能容忍雌性污染。在这些遗传防治措施的应用中,性别分离是指将雄性和雌性进行分离,更确切地说是移除雌性。性别分离一方面依赖于性二态差异的机械分离,另一方面可以利用更复杂的技术来调控基因表达,从而在发育过程中条件性地将雌虫雄性化或杀死雌性。
昆虫性别决定和发育已被多次阐述,主要关注特定种或属及性别调控分子机制(Alphey,2014;Gillesetal.,2014;Bernardinietal.,2018)。在本文中,我们对双翅目昆虫最近开发的所有性别分离策略进行综述,关注的对象不仅包括蚊子在内的病媒昆虫,还包括其他双翅目农业重要性害虫,这些新的性别分离技术可以完善基于靶标性别决定的昆虫不育防治技术。本文侧重于性别分离方法的可操作性,对目前正在进行的性别分离技术进行了比较,探讨了大规模饲养中每项技术创新的优缺点。
1 双翅目昆虫大规模释放中的性别分离现状
目前大多数针对实蝇害虫的遗传防治策略没有进行性别分离。例如,澳大利亚和泰国果实蝇属Bactrocera大规模饲养设施每周能生产数以千万计的没有移除雌性的果实蝇(Orankanoketal.,2007;Fansonetal.,2014)。通过每周释放1 500万头不育对旋丽蝇Cochliomyiahominivorax对巴拿马-哥伦比亚边境的对旋丽蝇进行防治,其中没有大规模的性别分离策略(Scottetal.,2017)。而随着不育对旋丽蝇生产规模的增加,一种基于四环素抑制系统的转基因品系导致雌虫在蛹期雌性特异性致死,从而实现蛹期性别分离用于对旋丽蝇的防治,预计每年可节省超过100万美元(Conchaetal.,2016)。到目前为止,只有地中海实蝇Ceratitiscapitata和墨西哥实蝇Anastrephaludens两种农业重要性实蝇在大规模饲养中采用性别分离策略,极大提高了释放效率(Augustinosetal.,2017)。
在必须进行性别分离的情况下,耗时的方法通常是唯一可行的选择。蚊亚科包括伊蚊属Aedes和库蚊属Culex,性二态表现为蛹大小不一致,已经对伊蚊采用基于蛹的大小进行机械性别分离(Papathanosetal.,2018)。在意大利SIT防治中,利用金属筛对200万头白纹伊蚊Aedesalbopictus雄虫进行了性别分离,该方法仅回收了26%~29%的雄虫,雌虫污染仍约为1.2%(Bellinietal.,2013)。基于雌雄蛹大小的Fay-Morlan玻璃分选机,对中国两个岛上的白纹伊蚊进行了昆虫不相容技术和不育技术相结合的实验,释放了超过1.97亿头雄蚊。雄蚊恢复较多,雌蚊污染率约为0.3%(Zhengetal.,2019)。利用基于性二态的方法对留尼旺岛的白纹伊蚊和法属波利尼西亚的埃及伊蚊Aedesaegypti和波利尼西亚伊蚊Aedespolynesiensis进行防治,从而控制登革热的发生。目前按蚊性别分离方法是基于蚊蛹人工识别,每小时只能对500头蚊蛹进行性别分离(Papathanosetal.,2018)。这导致工期非常长,很难获得害虫不育防治中所需的蚊虫数量。采采蝇Glossinamorsitansmorsitans雌雄虫均以血液为食,可作为锥虫的载体。释放少量锥虫杀灭剂处理的采采蝇雄虫可以通过成虫人工分离,而大量释放可以利用雌蛹羽化早于雄蛹进行分离(Bouyeretal.,2014;Secketal.,2015)。基于雌蛹羽化早于雄蛹的性别分离方法生产了500万头须舌蝇Glossinapalpalisgambiensis雄虫,用于消除塞内加尔的须舌蝇(Secketal.,2015)。
在蛹期或成虫期进行性别分离需要对雌雄幼虫进行饲喂,在不育防治释放中只需要雄虫,因而雌虫被丢弃只仅保留雄虫。此外,增加幼虫密度会降低其适应性并减缓雌雄幼虫发育(Agnewetal.,2002)。因此,在昆虫发育早期移除雌虫有利于避免雌雄之间的竞争(Phucetal.,2007)。在饲养数百万头害虫时,早期的性别分离可以节省大量的时间、劳动力和金钱。在大规模饲养蚊虫中,早期的性别分离可以降低雌蚊饲咬工人的风险。释放性别分离后的不育雄性个体,通过与野外靶标雌性害虫个体交配,产生不育后代,能够降低靶标害虫种群密度,甚至彻底根除靶标害虫。
2 双翅目昆虫性别决定及分化机制
双翅目昆虫具有多种机制决定性别和分化(图1)。模式物种黑腹果蝇Drosophilamelanogaster是XX/XY染色体性别决定系统,雌性个体双倍剂量的X染色体连接信号元件(X chromosome-linked signal elements,XSE)作为初始性别决定因子启动Sexlethal(Sxl)基因的表达,SXL蛋白指导transformer(tra)和doublesex(dsx)基因mRNA前体进行雌性特异剪切(traf,dsxf),雌性特异DSX蛋白指导雌性分化。XY个体单倍剂量的XSE不足以启动Sxl基因的表达,导致tra和dsx基因mRNA前体进行雄性特异剪切(tram,dsxm),产生雄性特异DSX蛋白指导雄性分化(Erickson and Quintero,2008;Lucchesi and Kuroda,2015;Vicoso and Bachtrog,2015)。在家蝇Muscadomestica中,性别决定系由雄性决定因子maledeterminer(Mdmd)的存在与否来决定。在XY雄性胚胎中,父本继承的Mdmd阻止合子中母本tra正向反馈调控表达,导致tra和dsx基因进行雄性特异剪切,进而实现雄性决定和雄性性别分化。在XX雌性胚胎中,缺少Mdmd基因,来源于母本的tra基因产物在雌性中建立一个自动调控通路,转录产生有功能的TRA蛋白,TRA蛋白指导dsx进行雌性特异剪切,完成雌性性别决定和分化(Sharmaetal.,2017)。地中海实蝇性别决定基本信号是位于Y染色体的雄性决定因子Maleness-onthe-Y(MoY) (Meccarielloetal.,2019)。Y染色体连接的MoY阻止合子中tra基因活化,导致tra基因进行雄性特异剪切,引起雄性发育。XX胚胎由于缺乏MoY基因,tra雌性特异自动调节回路被激活产生功能蛋白,推动雌性性别发育(Paneetal.,2002;Gabrielietal.,2010)。蚊子性别是由位于Y染色体上的雄性决定因子调控的,埃及伊蚊、冈比亚按蚊Anophelesgambiae和斯氏按蚊Anophelesstephensi雄性决定基因Nix,Yob和Guy1调控dsx基因进行雄性别特异性剪切和表达,实现雄性性别发育。雌性缺少Nix,Yob和Guy1基因,导致dsx基因进行雌性特异性剪切和表达,从而实现雌性性别发育(Halletal.,2015;Criscioneetal.,2016;Krzywinskaetal.,2016)。

图1 双翅目昆虫性别决定途径(Erickson and Quintero,2008;Hall et al.,2015;Criscione et al.,2016; Krzywinska et al.,2016;Sharma et al.,2017;Meccariello et al.,2019)Fig.1 Sex determination pathways in dipteran insects (Erickson and Quintero,2008;Hall et al.,2015;Criscione et al.,2016; Krzywinska et al.,2016;Sharma et al.,2017;Meccariello et al.,2019)dsxf:doublesex转录本的雌性特异性亚型 Female-specific isoform of the doublesex transcript;dsxm:doublesex转录本的雄性特异性亚型Male-specific isoform of the doublesex transcript;traf:transformer转录本的雌性特异性亚型Female-specific isoform of the transformer transcript;tram:transformer转录本的雄性特异性亚型Male-specific isoform of the transformer transcript.
3 双翅目昆虫性比失衡性别分离策略
鉴定昆虫雌性性别发育关键的基因,从而破坏其性别决定途径的防治策略已在多种害虫中得以应用,利用RNA干扰(RNA interference,RNAi)、clustered regularly interspaced short palindromic repeats/CRISPR-associated protein 9 (CRISPR/Cas9)敲除和转基因技术,在昆虫胚胎发育早期对性别决定关键基因进行调控可以产生雄性偏向的种群(表1)。性别完全分离成本效益较低的方法是生产包括雄虫和部分雌虫雄性化组成的种群,通过以上方法生产的雄性化雌虫通常是不育。在饲养设施中,这些雌虫仍将与雄虫竞争食物和空间,在田间释放该种群防治害虫时效率更高。地中海实蝇转基因品系在热激启动子调控下表达双链RNA靶向性别决定关键基因tra,产生95%雄性和5%双性后代,大多数基因型雌性(XX)发育为雄性表型,并且是可育的(Sacconeetal.,2007)。橘小实蝇Bactroceradorsalis胚胎期干扰性别决定关键基因tra和tra-2的表达,导致后代出现96%的雄性和4%的不能交配的不育双性个体(Liuetal.,2015)。通过将埃及伊蚊幼虫浸泡在dsRNA混合物中或者饲喂表达dsRNA的细菌,干扰tra-2基因表达,导致后代存活率约为50%以及高达97.6%的雄性性别偏向(Hoangetal.,2016)。干扰埃及伊蚊dsx基因雌性亚型后,97%的后代为雄性表型,3%为不育雌性且丧失吸血冲动(Whyardetal.,2015)。在冈比亚按蚊生殖细胞系中过表达Yob基因获得雄性偏向性转基因品系,该品系后代75%为雄性,25%为雄性化的不育雌性,表现出生存能力降低和不同程度两性性表型缺陷,表明通过转基因优化构建能使基因型雌性完全转化为功能性雄性(Krzywinska and Krzywinski,2018)。利用CRISPR/Cas9系统敲除加勒比按实蝇Anastrephasuspensatra-2的表达,导致后代42%为雄性、47%为双性个体、11%为雌性,而只有13%个体存活至成虫期,这为在加勒比按实蝇中开发转基因条件性别系统提供了可能(Li and Handler,2019)。Yob基因是冈比亚按蚊雄性性别决定因子,调控dsx基因雄性特异性剪切。胚胎期注射YobmRNA导致后代全部发育为雄性表型(Krzywinskaetal.,2016)。在埃及伊蚊中通过调控雄性决定因子Nix基因的表达,实现了基因型雌性向雄性表型的转化(Aryanetal.,2019),表明利用昆虫雄性决定因子的条件性表达来构建雄性性别品系将是未来的发展方向。最近,Kandul等(2019)在黑腹果蝇中开发出一种生产100%不育雄性化的系统,该系统将表达Cas9蛋白品系与同时表达β-微管蛋白基因(β-tub)和CRISPR靶标基因sxl品系杂交,可以实现F1代性别分离,获得的雄虫不育且具有和野生型相同的交配竞争力。
4 双翅目雌性条件性致死分离策略
雌性条件性致死通常用于获得性别品系,而其中一部分致死系统是基于四环素抑制系统雌性特异性表达(表1)。四环素抑制系统的核心是四环素反式激活因子(tetracycline-repressible transactivator,tTA),tTA是含有能序列特异识别四环素来抑制DNA结合特性的一类融合蛋白。当受到上游启动子的调控,tTA会结合到下游特异受体序列,启动效应致死基因的表达。在四环素存在条件下,tTA不能结合受体,因而不会实现下游效应致死基因的表达。一方面tTA调控致死基因的表达,另一方面tTA自身能够触发致死。基于四环素抑制系统构建的转基因性别品系在含有四环素的培养基中饲养时,昆虫表现出正常的孵化率和雌雄性比。缺少四环素导致雌性致死,昆虫只有50%的孵化率且仅后代都为雄性(Schetelig and Handler,2012;Ogaugwuetal.,2013;Yanetal.,2017)。加勒比按实蝇开发了基于四环素抑制的胚胎性别系统,利用胚胎特异启动子启动促凋亡细胞致死基因雌性特异表达,导致胚胎发育过程中雌性死亡,转基因后代80%~100%为雄性。在大规模实验中,利用四环素系统成功孵化30 000头转基因胚胎,获得100%的雄性后代,表明其可以应用于加勒比按实蝇大规模饲养(Schetelig and Handler,2012)。利用tra基因性别特异性剪接调控致死基因的表达,成功构建地中海实蝇雌性致死品系(Fuetal.,2007)。在橄榄果实蝇Bactroceraoleae建立的显性致死释放系统(RIDL)品系通过携带性别特异性荧光,导致雄虫不育且雌性条件性致死。通过每周释放该转基因品系雄虫,能够在室内试验中有效消除橄榄果实蝇野生种群(Antetal.,2012)。利用tra基因雌性特异性剪切和促凋亡细胞致死基因相结合的方法,成功构建铜绿蝇Luciliacuprina和对旋丽蝇四环素抑制的雌性特异性致死系统(Yan and Scott,2015;Conchaetal.,2016)。其中一种对旋丽蝇目前正在接受大规模饲养项目的评估(Scottetal.,2017)。
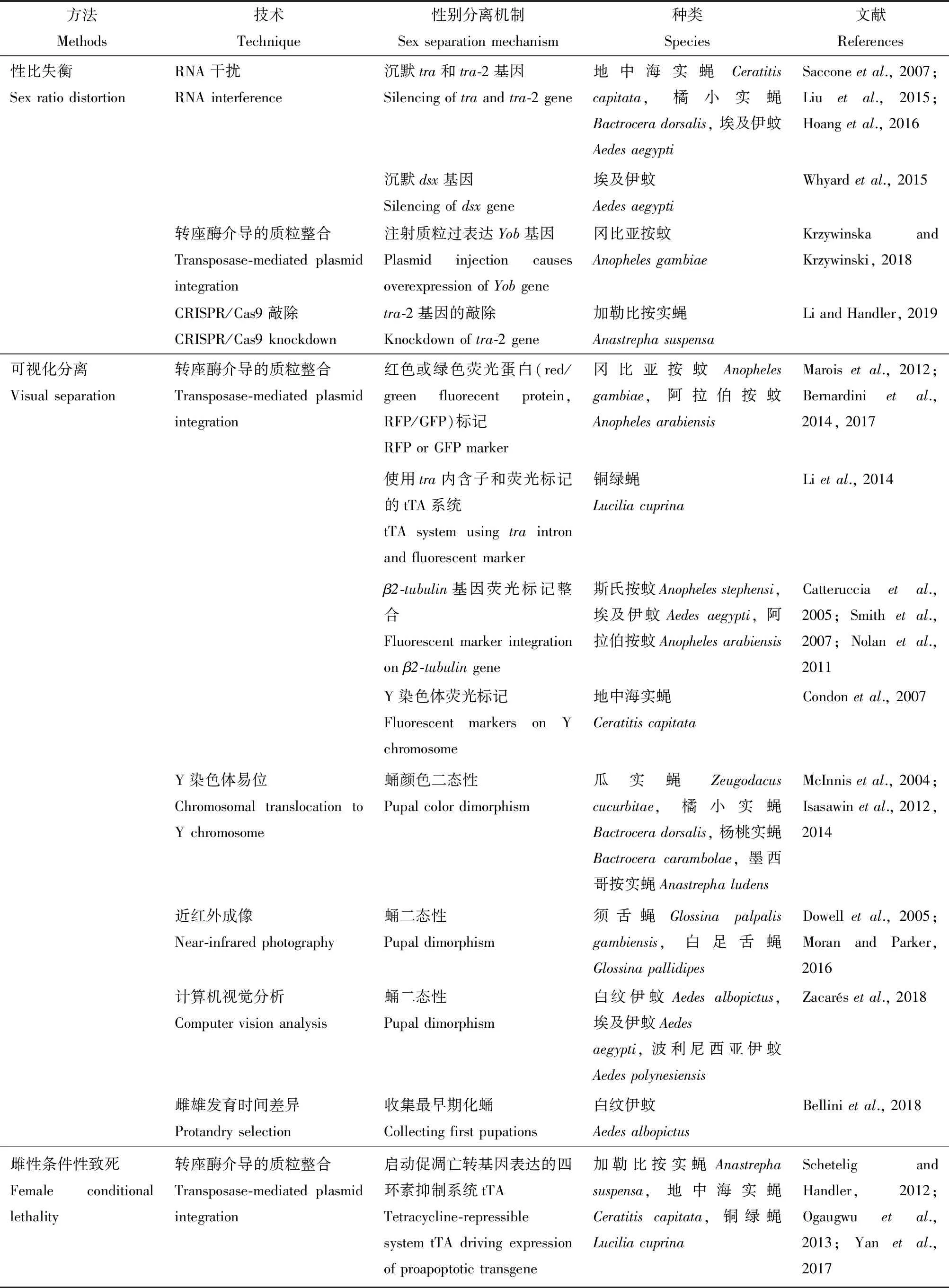
表1 双翅目昆虫性别分离方法及其机制Table 1 Sex separation methods for dipteran insects and their mechanisms

续表1 Table 1 continued
actin-4基因雌性特异性表达系统已在多种蚊子中用于条件性表达致死效应因子。由于actin-4在雌性飞行相关肌肉中特异表达,条件性表达系统所获得的表型是不具备飞行能力的雌性,并不会导致雌性致死。埃及伊蚊、白纹伊蚊和斯氏按蚊中已开发出这样一个系统,在缺少四环素的情况下导致无飞行能力的表型(Fuetal.,2010;Labbéetal.,2012;Marinottietal.,2013)。尽管该系统在实验室研究中是有效的,但是四环素会影响斯氏按蚊肠道微生物群落并损害其适应性,导致在野外无意释放的雌性斯氏按蚊更容易感染恶性疟原虫(Sharmaetal.,2013)。将狄氏剂抗性等位基因易位至阿拉伯按蚊AnophelesarabiensisY染色体,导致雄蚊抗狄氏剂,而雌蚊对狄氏剂敏感,从而实现雌雄蚊分离(Yamadaetal.,2012,2013a)。Lebon等(2018)在白纹伊蚊中开发出类似的狄氏剂抗性品系,其性别分离效率达到98%。鉴于只有雌蚊吸食血液,在血餐中添加有毒物质也能实现阿拉伯按蚊性别分离,其雌蚊在取食含伊维菌素的血餐4 d后死亡,而雄蚊取食后没有损伤(Yamadaetal.,2013b)。由于伊维菌素随粪便排出,导致所有饲养设备的污染,这是该系统用于大规模饲养应用中的主要缺陷。
5 双翅目昆虫可视化性别分离策略
性别自动分离已在多种害虫中得到应用(表1),如在橘小实蝇、杨桃实蝇Bactroceracarambolae、瓜实蝇Zeugodacuscucurbitae和墨西哥实蝇中通过对蛹颜色决定基因的突变构建了遗传性别品系(GSS) (McInnisetal.,2004;Isasawinetal.,2012,2014;Zepeda-Cisnerosetal.,2014)。通过该方法能达到100%性别分离,在田间试验中,这些遗传性别品系表现出良好的竞争力(McInnisetal.,2007;Isasawinetal.,2012;Orozco-Dávilaetal.,2015)。由于突变与染色体易位相关,品系中的个体是半不育的。在难以发现或调控颜色突变的情况下,利用性别特异性启动子调控荧光标记蛋白来实现性别分离是可行的。在斯氏按蚊、埃及伊蚊和阿拉伯按蚊中,利用与β2-微管蛋白基因启动子连锁的标记实现了蚊虫晚期幼虫和蛹阶段的性别分离(Catterucciaetal.,2005;Smithetal.,2007;Nolanetal.,2011)。Condon等(2007)在地中海实蝇幼虫晚期阶段建立了两个高荧光表达的转基因性别品系,其蛹的性别自动筛选分离准确率为97.5%~100%。
利用冈比亚按蚊精子特异性β2-微管蛋白启动子表达增强型绿色荧光蛋白(EGFP),从而在4龄幼虫阶段将雄蚊分离(Catterucciaetal.,2005)。Magnusson等(2011)在冈比亚按蚊1龄幼虫阶段开发出另一种性别分离标记,该品系的雄虫携带含有雌性特异性dsx基因内含子的EGFP报告基因,由于dsx基因进行雄性特异剪切使得EGFP报告基因得以表达。而将绿色荧光蛋白(GFP)插入冈比亚按蚊Y染色体,雄蚊表达绿色荧光蛋白,而雌蚊表达红色荧光蛋白(Bernardinietal.,2014)。携带X染色体标记的性别品系和携带Y染色体标记的性别品系通过杂交产生非转基因的雄蚊种群,从而在避免释放转基因品系的前提下将雄蚊分离出来。此外,Bernardini等(2017)通过种间杂交将冈比亚按蚊Y染色体表达的荧光标记渗入阿拉伯按蚊。在铜绿蝇中开发了一种在雌性幼虫中过表达荧光标记报告基因的转基因品系,从而实现早期幼虫性别分离(Lietal.,2014)。
基于成像技术的非转基因性别分离策略也在开发中,并且在基因改造受限制的物种中得到应用(表1)。利用基于雌雄性别二态性的近红外(NIR)成像技术能对野生型白足舌蝇Glossinapallidipes(WT)蛹进行性别分离,且准确率为80%~100% (Dowelletal.,2005;Moran and Parker,2016)。结合性别二态性和成像技术对多种按蚊和伊蚊开发出雌雄蛹自动分拣器,其雌蚊污染率小于1%。对阿拉伯按蚊的分拣效率不高,但对伊蚊的分拣能实现65%~98%的雄蚊恢复,展示出其优异的性能(Zacarésetal.,2018)。基于白纹伊蚊雌雄蚊化蛹时间的差异,Bellini等(2018)开发出一种新的非转基因性别分离方法,他们经过10代的雌雄蚊化蛹时间的差异筛选出雌蚊和雄蚊的品系,该品系28%的早期蛹中99%为雄蚊。该系统表明其他表型可以作为基于遗传操作的性别分离策略的未来研究方向。
6 小结与展望
尽管昆虫不育技术(SIT)在害虫防治中已使用长达60年,但并未被公众广泛熟知,尤其是在携带致病菌的种群之中。对正在防治白纹伊蚊试验的法国La Reunion岛上居民进行的一项民意调查显示,只有34%的居民了解昆虫不育技术。当获悉昆虫不育技术的应用原则时,61%的人支持释放野生型辐照不育雄性。相较于利用雌雄性二态特征,释放基因改造过的蚊虫面临更多反对意见。由于公众缺少SIT相关专业知识所引起的担忧,导致一些害虫防治项目被迫取消(Panjwani and Wilson,2016)。Antonelli等(2015)发现,公众舆论对转基因蚊虫不同术语的态度各不相同。即使是遗传状态相关性不高的不育昆虫,释放转基因品系比释放通过传统方法突变获得的品系更令人担忧。当Oxitec公司在加勒比地区进行田间试验释放转基因蚊虫时,科学界本身也提出了担忧(Phucetal.,2007;Antonellietal.,2015;Panjwani and Wilson,2016)。相似的情况是,一些政府反对在其领土上释放转基因昆虫,因而科学家们在开发昆虫不育新技术时不得不考虑以上种种担忧。
雌性条件性致死系统虽然无需初始成本,但仍需化学药剂如狄氏剂、四环素的日常处理成本以及处理污染的饲养用水。由于雌蚊能叮咬并传播病原菌,因此规模化的性别分离方案必须使雌性移除率达到99%以上。大多数早期和晚期性别分离方法都依赖于转基因技术。基于转基因技术的性别分离策略的饲养成本效率是可观的,但由于公众消极认知或监管禁令导致其实际应用受到限制。尽管伊蚊蛹分拣机和白足舌蝇近红外成像的发展速度和成本受到抑制,但是这两种技术仍不失为一种切实可行的方案(Moran and Parker,2016;Zacarésetal.,2018)。当必须规避转基因方法时,基于蛹颜色相关等位基因如stripe或redeye突变的传统遗传性别品系(genetic sexing strains,GSS) (McInnisetal.,2004;Isasawinetal.,2012,2014),对雌雄蛹的自动分离是行之有效的(Seawrightetal.,1982;Mukiama,1985)。最近,Ndo等(2018)在按蚊中分离出一种温度致死性突变,也可用于构建其遗传性别品系。在允许使用转基因技术的情况下,利用四环素反式激活因子(tTA)调控促凋亡基因的表达能够导致多种害虫早期发育阶段雌性特异性致死(Schetelig and Handler,2012;Ogaugwuetal.,2013;Yanetal.,2017)。发育晚期性别分离策略雌雄分离阶段偏晚,但是结合释放携带显性致死的昆虫不育技术(RIDL)可以实现释放的雌性幼虫在死亡前和野生幼虫竞争食物和空间,从而提高害虫防治效率。当释放同等竞争力和同等数量的昆虫时,RIDL系统比传统昆虫不育技术(SIT)更有效(Blacketal.,2011)。在本综述中,我们没有对X染色体断裂系统导致的性比失衡(Galizietal.,2014,2016)进行讨论,是由于这个品系产生的是非条件性雄性性别偏向种群。但是X染色体断裂系统对于大规模室内试验中遗传调控仍是十分有效的(Facchinellietal.,2019)。如果这种性比失衡品系可以实现规模化饲养,其释放效率可比SIT高16~3 000倍,比RIDL高2~70倍(Schliekelmanetal.,2005)。
双翅目雌雄性别分离在过去15年中受到了诸多关注,提出的包括性比失衡、雌性条件性致死和昆虫可视化性别分离策略由于分离效率的差异,其防治效果高低不一。性别分离策略中分离技术、治理成本和品系特征等因素会影响公众和政府对实施这些害虫不育防治技术的可行性和可接受性。性别分离新策略不仅需要满足分离效率要求,而且还需满足社会和监管机构的验收标准。近年来相继在埃及伊蚊、冈比亚按蚊、斯氏按蚊、家蝇和地中海实蝇中鉴定出雄性性别决定基因Nix,Yob,Guy1,Mdmd和MoY,极大丰富和完善了双翅目昆虫性别决定和分化分子机制,通过对这些雄性决定基因改造改变昆虫性别,使其性别分化向着有利于人类的方向发育,如:使害虫种群全部产生雄性后代,导致其不能繁衍,发展不依赖辐射处理的昆虫不育防治技术(SIT);或使天敌种群全部产生雌性后代,扩大害虫天敌的种群数量,为害虫天敌的遗传改良提供有效途径。特别是发展基于CRISPR/Cas9的基因驱动系统进行害虫性别分离,将加快害虫遗传调控和不育防治技术的发展。
