产γ-内酰胺酶菌株的筛选及鉴定
2020-10-12孙康李盼盼于爽迟乃玉
孙康,李盼盼,于爽,迟乃玉*
1(大连大学 生命科学与技术学院,辽宁 大连,116622)2(辽宁省海洋微生物工程技术研究中心,辽宁 大连,116622)
2-氮杂二环-[2.2.1]-庚烷-5-烯-3-酮是一种双环酰胺类化合物,俗称γ-内酰胺、文斯内酯。它是制药工业的一种重要医药中间体,可以合成包括治疗艾滋病的阿巴卡韦及治疗甲型流感的帕拉米韦在内的诸多药物[1]。作为多种药物的合成原料,γ-内酰胺自身却是未经拆分的外消旋体化合物,包含(-)γ-内酰胺及(+)γ-内酰胺两种构型。从源头上拆分(±)γ-内酰胺,能为合成单一构型药物奠定坚实基础,实现更安全和更有效的临床给药[2]。
目前,制备单构型γ-内酰胺的方法有不对称合成法、循环优先结晶法和生物不对称拆分法[3-5]。前2种方法存在产率低纯度不高等缺陷,生物不对称拆分法是利用环境中筛选到的特定菌株,选择性降解某一构型的γ-内酰胺,从而达到拆分(±)γ-内酰胺的目的。生物法具有反应条件温和、效率高、环境友好、利于工业放大等优点[5-6]。TAYLOR等[7]最早利用产γ-内酰胺酶的菌株实现了(±)γ-内酰胺的拆分,并利用(-)γ-内酰胺合成了(-)阿巴卡韦。国内郑国钧团队最早开展这方面研究,相继发现了硫磺矿硫化叶菌(Sulfolobussolfataricus)、慢生型大豆根瘤菌(Bradyrhizobiumjaponicum)、氧化烃微杆菌(Microbacteriumhydrocarbonoxydans)、砖红色微杆菌(Microbacteriumtestaceum)等产γ-内酰胺酶菌株[8-13]。目前存在的普遍问题是菌株立体选择性差,已报道菌株中相当一部分既产(+)γ-内酰胺酶又产(-)γ-内酰胺酶,制约了其在工业生产中的应用[14-15]。
本研究利用平板筛选法结合液相色谱法,从渤海海泥样品中筛选出2株具有高立体选择性的产γ-内酰胺酶菌株,采用形态观察及分子生物学技术对其进行鉴定,并进行了生产小试研究,为2种构型γ-内酰胺的制备提供了优质的菌种资源。
1 材料与方法
1.1 材料
1.1.1 样品与试剂
海泥,采集于辽宁省大连渤海湾;异丙醇、乙腈、正丁醇(均为色谱级),天津科密欧化学试剂有限公司;N-乙酰-L-苯丙氨酸(分析纯),上海阿拉丁生化科技股份有限公司;2-氮杂双环[2.2.1]庚-5-烯-3-酮(分析纯),上海麦克林生化科技有限公司;细菌基因组提取试剂盒,上海生工生物工程股份有限公司;剩余其他试剂,均为国产分析纯。
1.1.2 培养基
筛选培养基[16](g/L):N-乙酰-L-苯丙氨酸2,酵母浸粉0.1,NH4Cl 2,NaH2PO40.1,Na2HPO40.1,MgSO40.1,琼脂粉20,pH 7.0。
种子培养基[17](g/L):酵母浸粉5,葡萄糖5,KH2PO47,MgSO40.4,FeSO40.02,CaCl20.02,NH4Cl 5,pH 7.0。
发酵培养基:同种子培养基。
以上培养基均在121 ℃高温灭菌20 min。
1.1.3 仪器与设备
SHIMADZU-20A高效液相色谱仪,日本岛津公司;250 mm×4.6 mmAS-H手性色谱柱,日本大赛璐公司;LA2-4A1生物安全柜,新加坡艺思高科技有限公司;LTI-700恒温培养箱,上海爱郎仪器有限公司;2WY-2102C恒温摇床,上海智城分析仪器制造有限公司;CR21N大容量冷冻离心机,日本日立公司;D-37520小容量离心机,美国赛默飞世尔科技公司;pHS-3EpH计,上海仪电科学仪器股份有限公司;YXQ-LS-100Ⅱ立式压力蒸汽灭菌器,上海博讯实业有效公司;5 L发酵罐,上海百仑生物科技有限公司;RV8旋转蒸发仪,德国艾卡公司。
1.2 试验方法
1.2.1 产γ-内酰胺酶菌株的初筛
自然界中存在一些微生物能够利用N-酰基化合物作为它们唯一的碳源,它们中相当一部分产γ-内酰胺酶[18]。筛选培养基以N-乙酰-L-苯丙氨酸作为主要碳源,微生物能在其上生长即证明菌体有水解酰胺键的能力,是γ-内酰胺酶的潜在来源菌株。大连渤海湾海泥样品共5份,每次取1.0 g左右海泥土样加入到5 mL无菌蒸馏水中,充分混匀,随后进行梯度稀释,取200 μL梯度稀释液涂布于筛选培养基平板,28 ℃条件下培养2~5 d,菌株陆续长出,挑取单菌落使用平板划线法进一步纯化。
1.2.2 产γ-内酰胺酶菌株的复筛
将初筛得到的菌株接种于液体筛选培养基,28 ℃、150 r/min条件下培养2~5 d。按5%(体积比)的接种量将菌液接种于种子培养基,菌株在种子培养基中生长较快,28 ℃、150 r/min条件下培养1 d即可。取100 mL菌液8 000 r/min离心10 min,弃上清液,离心沉淀表面用0.05 mol/L、pH 7.0的磷酸钠缓冲液清洗,加入10 mL上述磷酸钠缓冲液重悬菌体。设立1 h反应组和24 h反应组,分别取2 mL重悬菌液,加入0.5 mL含质量浓度为50 g/L (±)γ-内酰胺的磷酸钠缓冲液,置于28 ℃、 150 r/min摇床中反应1、 24 h。反应完成后取1.5 mL反应液8 000 r/min离心5 min,取0.75 mL上清液,加入0.75 mL正丁醇,反复混匀静置实现萃取。将反应液-正丁醇混合液10 000 r/min离心5 min,吸取上层液体过0.45 μm针头式滤膜。
采用高效液相色谱检测(±)γ-内酰胺[19],高效液相色谱条件为AS-H手性色谱柱,流动相为V(乙腈)∶V(异丙醇)=9∶1,流速0.6 mL/min,上样量10 μL,检测波长230 nm。
1.2.3 产γ-内酰胺酶菌株的鉴定
形态观察:将试验菌株划线于固体LB(Luria-Bertani)平板上,28 ℃恒温培养1~2 d,观察菌株的菌落形态特征,并挑取单菌落,进行革兰氏染色,观察细菌的细胞形态。
分子生物学鉴定:挑取单菌落于5 mL种子培养基,28 ℃、200 r/min恒温过夜培养,采用细菌基因组提取试剂盒提取基因组,以其为模板,利用引物5′-AGAGTTTGATCCTGGCTCAG-3′、5′-GGTTACCTTGTTACGACTT-3′对菌株的16S rDNA序列进行PCR扩增[20],将PCR扩增产物送至上海生工股份有限公司进行测序。将测序结果提交至美国国家生物技术信息中心(National Center of Biotechnology Information,NCBI)的GenBank数据库中,与已知菌种的16S rDNA序列进行BLAST比对,选取若干条同源性较高的菌株的16S rDNA序列,采用MEGA-X软件中的邻接算法(neighbor joining,NJ)构建系统发育树。
1.2.4 产γ-内酰胺酶菌株的小试生产
种子液的制备:将菌株接种于200 mL液体种子培养基,28 ℃、150 r/min条件下培养1 d。
发酵罐培养及转化:按1%(体积比)接种量将种子液接种于含有发酵培养基的发酵罐中,装液量为4 L/5 L,于25 ℃、200 r/min条件下培养20 h。将培养液8 000 r/min离心10 min,采用0.05 mol/L、pH 7.0的磷酸钠缓冲溶液洗涤沉淀,将沉淀加入到装有1 L 50 g/L (±)γ-内酰胺磷酸钠缓冲液的发酵罐中,于25 ℃、200 r/min条件下反应24 h。其间每隔数小时取样检测,计算产物的对映体过量值(enantiomeric excess,ee值),该数值能直观反映手性化合物的光学纯度,ee值越高,光学纯度也越高[21],对映体过量值计算如公式(1)所示:
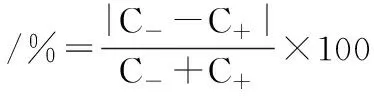
(1)
式中:C-为液相分析中(-)γ-内酰胺的峰面积;C+为液相分析中(+)γ-内酰胺的峰面积。
产物回收:当ee值达到99.0%及以上时,将反应液8 000 r/min离心10 min,上清用500 mL乙酸乙酯萃取,利用旋转蒸发仪回收干燥,即得到终产物。
2 结果与分析
2.1 产γ-内酰胺酶菌株的筛选
2.1.1 菌株的初筛
利用筛选培养基从海泥样品中筛选得到24株菌,它们能够在筛选培养基上生长即证明了它们具有水解酰胺键的能力,是γ-内酰胺酶的潜在来源菌株,它们中部分在筛选培养基上培养的菌落形态如图1所示。
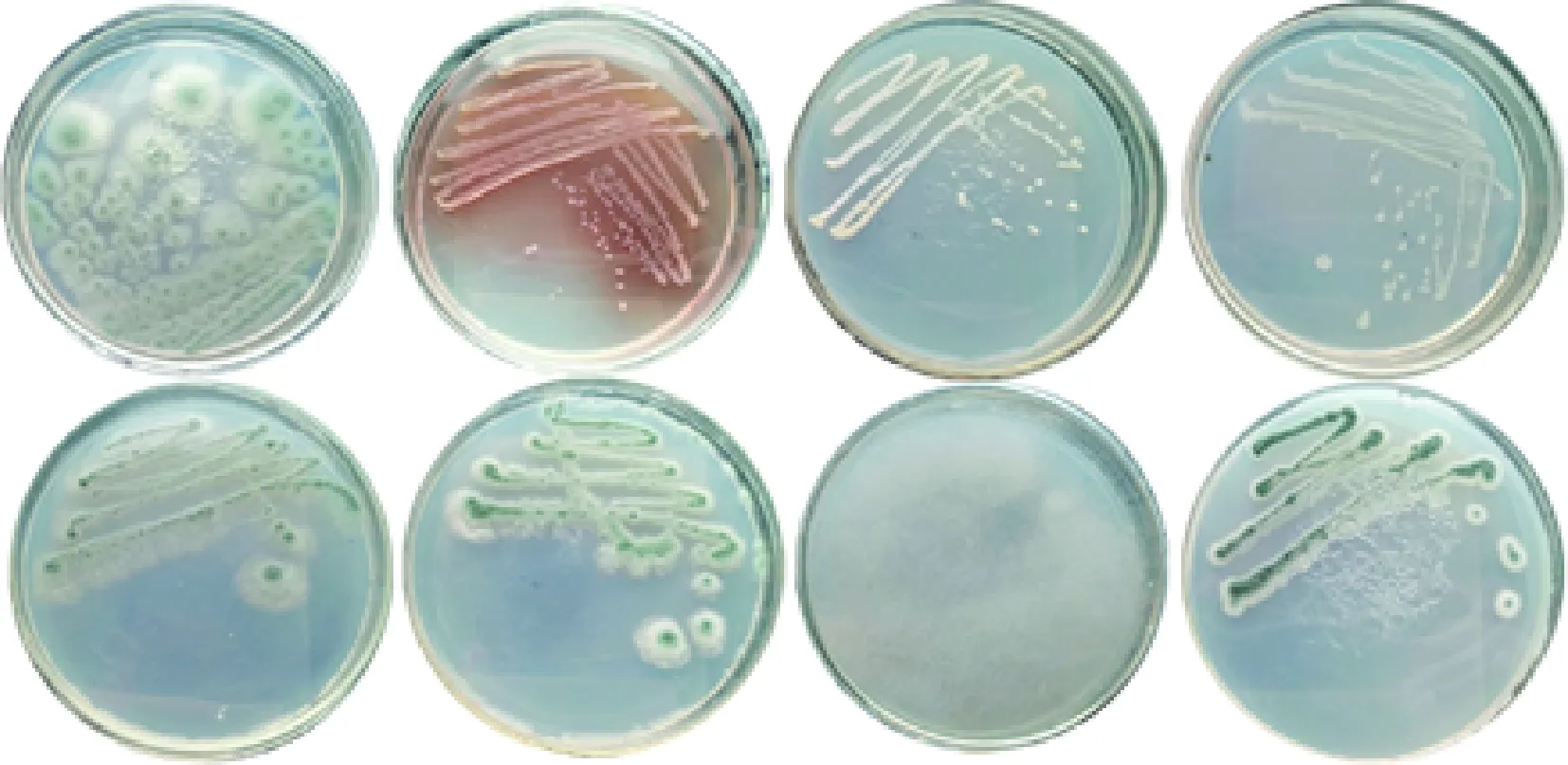
图1 部分初筛菌株的菌落形态图Fig.1 Colony morphology of some primary screened strains
2.1.2 菌株的复筛
复筛过程中发现,放线菌、霉菌不适合液体培养及离心以致于无法继续复筛实验,所以复筛检验的主要是初筛结果中的各类细菌。如表1所示,初筛得到的菌株近乎都具有降解(±)γ-内酰胺的能力,其中菌株LP7与LY9的立体选择性较好,菌株LP7只降解(+)γ-内酰胺,菌株LY9只降解(-)γ-内酰胺。

表1 复筛菌株降解(±)γ-内酰胺情况Table 1 Degradation of (±)γ-lactam by rescreened strains
菌株LP7及LY9降解(±)γ-内酰胺的结果如图2所示。由图2可知,反应1 h内,菌株LP7选择性降解了(+)γ-内酰胺,菌株LY9选择性降解了(-)γ-内酰胺。且反应24 h组与反应1 h组结果相当,未有另一构型的γ-内酰胺被降解的迹象,所以菌株LP7和菌株LY9都不产另一种构型的γ -内酰胺酶,立体选择较好。经多次传代,菌株LP7及LY9依旧具有较好的立体选择性,菌株稳定性良好。
值得注意的是,氧化烃微杆菌(Microbacteriumhydrocarbonoxydans)[22-23]、慢生型大豆根瘤菌(Bradyrhizobiumjaponicum)[24-25]、苏云金芽孢杆菌(Bacillusthuringiensis)[17]等并不是一开始就发现菌体内包含(±)2种γ-内酰胺酶,而是在进一步研究过程中发现的,究其原因还是实验方法中菌体参与量过小、反应时间不够长,以致另一种酶的作用被掩盖忽略。本研究在复筛方法中加大了菌体参与反应的量,并在1 h和24 h两个时间节点检测底物降解情况,因而很容易观察到第2种酶的存在,避免了上述情况的发生。
2.2 产γ-内酰胺酶菌株的鉴定
2.2.1 形态观察
菌株LP7和菌株LY9菌落形态如图3所示。由图3-a可知,菌株LP7在LB固体培养基上菌落呈淡粉红色、圆形、表面光滑。由图3-b可知,菌株LY9在LB固体培养基上菌落呈米黄色、圆形、表面光滑。
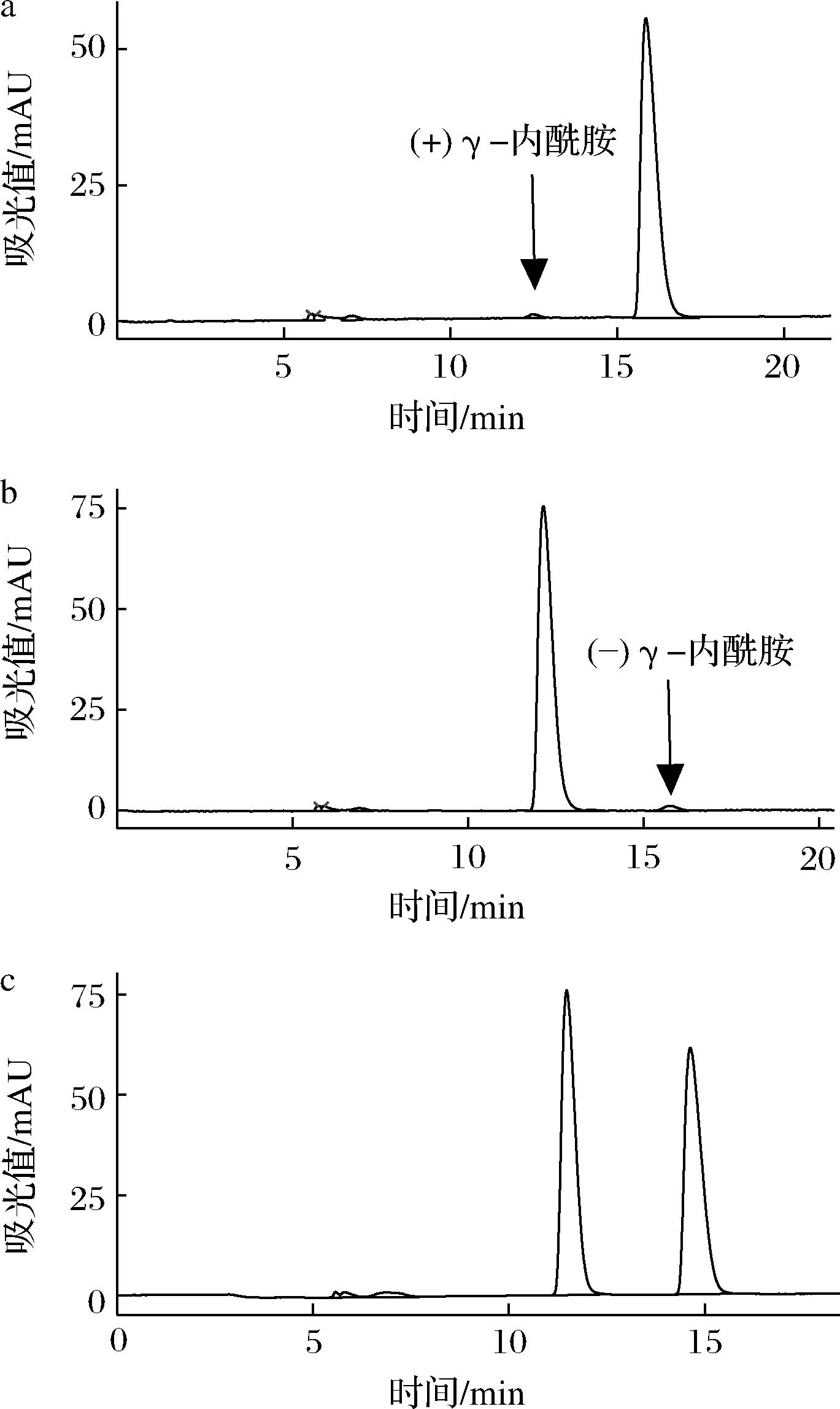
a-菌株LP7;b-菌株LY9;c-对照组图2 反应1 h组菌株LP7及LY9底物降解液的高效液相色谱图Fig.2 High performance liquid chromatography of substrate degradation solution of strain LP7 and LY9 in 1 h group
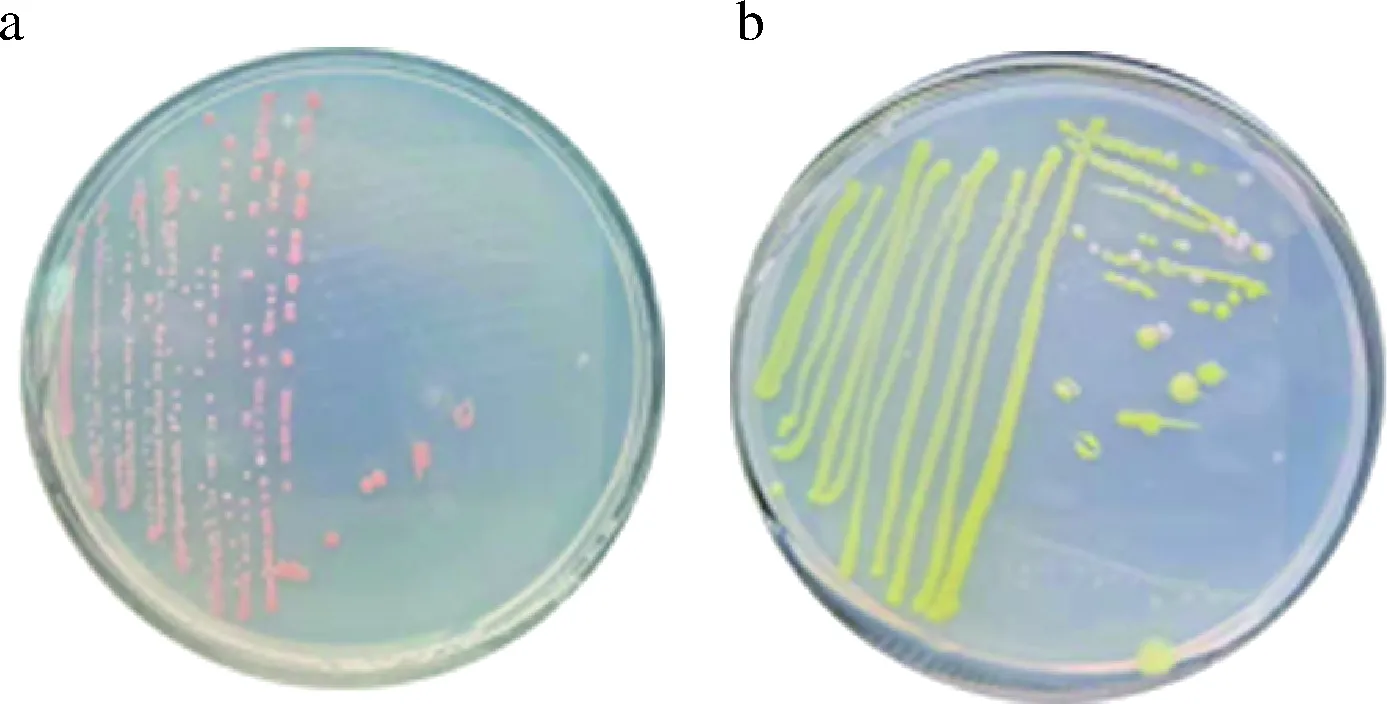
a-菌株LP7的平板培养;b-菌株LY9的平板培养图3 菌株LP7和LY9的菌落形态Fig.3 Colonial morphology of strain LP7 and LY9
2.2.2 分子生物学鉴定
将菌株LP7及LY9的16S rDNA序列在GenBank数据库中进行同源性比对,结果表明,菌株LP7与Arthrobacter属的多个菌种的序列相似性>97%,菌株LY9与Psychrobacter属的多个菌种序列相似性>97%。采用MEGA-X软件中的NJ算法构建系统发育树,结果如图4所示。由图4可知,菌株LP7与运动节杆菌(Arthrobacteragilis)聚于一支,亲缘关系最近,且菌株LP7与运动节杆菌菌落呈粉红色的性状一致,因此鉴定菌株LP7为运动节杆菌(Arthrobacteragilis)。菌株LY9与粪嗜冷杆菌(Psychrobacterfaecalis)聚于一支,亲缘关系最近,且菌株LY9与粪嗜冷杆菌菌落呈米黄色的性状一致,因此鉴定菌株LY9为粪嗜冷杆菌(Psychrobacterfaecalis)。
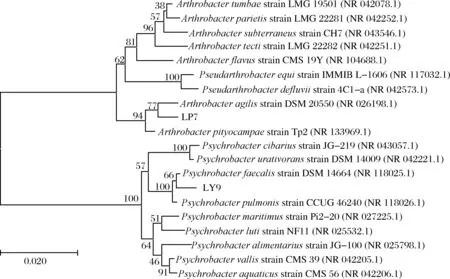
图4 基于16S rDNA序列菌株LP7及菌株LY9的系统发生树Fig.4 Phylogenetic tree of strain LP7 and strain LY9 based on 16S rDNA sequence
2.3 产γ-内酰胺酶菌株的小试生产
相较菌种筛选,小试生产扩大了反应体系、降低了菌株参与反应的比例、加大了底物质量浓度,因而降解所需时间有所延长,但更为经济实用。利用菌株LP7和LY9降解(±)γ-内酰胺的产物ee值变化曲线如图5所示。由图5-a可知,利用LP7降解的产物第35 h ee值达到99.4%,(+)γ-内酰胺基本降解完毕。由图5-b可知,利用LY9降解的产物第10 h ee值达到99.5%,(-)γ-内酰胺基本降解完毕。菌株LY9降解(-)γ-内酰胺的效率要快于菌株LP7降解(+)γ-内酰胺,后经过产物回收,分别得到了光学纯度达99.0%以上的(+)γ-内酰胺、(-)γ-内酰胺。
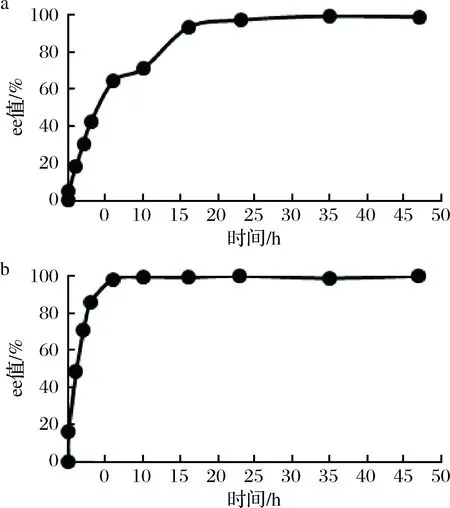
a-菌株LP7;b-菌株LY9图5 菌株LP7、菌株LY9降解(±)γ-内酰胺产物ee值变化图Fig.5 Changes in ee values of (±)γ-lactam products degraded by strain LP7 and strain LY9
3 结论
本研究利用平板筛选法及液相色谱法,从渤海海泥中筛选得到2株具有高立体选择性的产γ-内酰胺酶菌株。菌株LP7产(+)γ-内酰胺酶,通过16S rDNA测序分析结合形态学观察,鉴定为运动节杆菌(Arthrobacteragilis);菌株LY9产(-)γ-内酰胺酶,通过16S rDNA测序分析结合形态学观察,鉴定为粪嗜冷杆菌(Psychrobacterfaecalis)。经小试生产验证,2株菌可分别用来制备高光学纯度的(-)γ-内酰胺、(+)γ-内酰胺,因而具备有开发应用价值,为进一步合成单构型药物奠定了坚实基础。
