微冻保鲜对红鳍东方鲀贮藏品质的影响
2020-10-12刘欣荣申亮齐凤生刘红英
刘欣荣,申亮,齐凤生,刘红英*
1(河北农业大学 食品科技学院,河北 保定,071000)2(河北农业大学 海洋学院,河北 秦皇岛,066000)
东方鲀属是典型可食用鲀类代表,其中红鳍东方鲀个体大,成长所需时间短,是营养价值很高的经济鱼类[1]。养殖红鳍东方鲀毒素含量低,味道鲜美,营养价值高,脂肪含量低,蛋白质、不饱和脂肪酸、氨基酸等物质含量丰富[2-3],维生素B1、B2、硒、锌等多种微量元素含量较高[4]。市场上红鳍东方鲀主要以活鱼和处理后无毒的低温保鲜鱼肉进行销售。随着社会经济的发展,人们对红鳍东方鲀贮藏过程中的营养价值及感官品质的要求越来越严苛。鱼肉在贮藏过程中会出现质构软化、口感变软和刺鼻气味加重等品质劣变现象[5],导致营养价值和消费者满意度下降。可食用鲀类的贮藏保鲜问题已成为行业和学者共同关注的话题。
微冻保鲜技术是一种轻度冷冻或者部分冷冻的保鲜技术[6-7],是保鲜领域一项新技术[8-9],微冻保鲜下细胞内形成的冰晶较小,对于细胞结构的破坏程度小[10],可最大程度保持水产品细胞的完整度,保存水产品原有的营养物质,而且可以抑制细菌繁殖,解冻时汁液流失率较低,解冻后水产品表观颜色佳,无干耗,耗能较低[11-12]。微冻贮藏过程中温度波动会产生重结晶,会加剧水产品的劣变,因此微冻保鲜对温度控制技术的要求很严苛,使得该技术尚未在市场普遍应用。季晓彤[13]研究了微冻过程中金鲳鱼的品质变化,结果表明鱼肉硬度、咀嚼性、肌浆、肌原纤维中巯基含量均呈下降趋势,贮藏期间内源性蛋白酶一直具有生物活性。LILIAN等[14]研究了微冻过程中真空包装三文鱼的微观结构,发现贮藏过程中冰晶分布存在显著差异。
据调查,国内外对于红鳍东方鲀保鲜方面的研究甚少,且红鳍东方鲀鱼肉中蛋白质和水分含量较高,较其他鱼类而言更容易发生腐败变质,不利于贮藏过程中的品质保持。相对于低温冻藏而言,微冻贮藏对细胞造成的损伤较小,更有利于水产品营养的保留,因此对于红鳍东方鲀微冻过程中品质变化的研究格外重要。本文以红鳍东方鲀为研究对象,通过分析微冻过程中鱼肉理化指标、质构及微观组织结构的变化,研究了微冻对红鳍东方鲀鱼肉品质的影响,以期为红鳍东方鲀保鲜技术的研究提供一定的理论依据。
1 材料与方法
1.1 材料试剂与仪器
1.1.1 材料与试剂
红鳍东方鲀,购于秦皇岛市场,个体鲜活,组织良好,体长约19 cm,质量约500 g;硼酸,天津市科密欧化学试剂有限公司;HCl,天津市凯通化学试剂有限公司;K2CO3、溴甲酚绿、NaCl、95%乙醇,天津欧博凯化工有限公司;凡士林、甲醛,天津市风船化学试剂科技有限公司;甲基红,天津市北辰方正试剂厂;2-硫代巴比妥酸,国药集团化学试剂有限公司;三氯乙酸,福晨(天津)化学试剂有限公司;平板计数琼脂,青岛高科技工业园海博生物技术有限公司;冰醋酸,广州市信洪贸易有限公司;苦味酸,北京盈泽通汇生物科技有限公司。
1.1.2 仪器与设备
电子天平,上海光正医疗仪器有限公司;FA2004分析天平,上海舜宇恒平科学仪器有限公司;721型可见分光光度计、HH-6数显恒温水浴锅,上海梅香仪器有限公司;MJ-BL25B3搅拌机,广东美的生活电器制造有限公司;F6/10手持式高速匀浆机,上海净信实业发展有限公司;3K30台式高速冷冻离心机,德国SIGMA实验室离心机公司;PHS-3CpH计,上海仪电科学仪器股份有限公司;电热恒温鼓风干燥箱,上海精宏实验设备有限公司;BC/BD-320HK海尔冰柜,青岛海尔特种电冰柜有限公司;XFH-30CA电热式压力蒸汽灭菌器,浙江新丰医疗器械有限公司;BX51奥林巴斯显微镜,上海通灏光电科技有限公司;徕卡R2235切片机,德国;SW-CJ-2F无菌操作台,苏州安泰空气技术有限公司;美国FTC-质构仪TMS-PRO,美国。
1.2 试验方法
1.2.1 红鳍东方鲀预处理
鲜活红鳍东方鲀除去内脏、鱼皮、鱼骨,切成 4 cm×2 cm×2 cm大小的鱼块,用无菌蒸馏水洗净,吸水纸吸干表面水分,然后将鱼肉分装到无菌自封袋中,每袋300 g左右,置于-3 ℃冰柜中进行微冻保鲜,每隔5 d进行取样测定。
1.2.2 冰点的测定[15]
取5 cm×3 cm×2 cm的红鳍东方鲀鱼肉置于温度为-25 ℃的冰柜中,将温度计插头插入鱼块中心,每隔2 min测1次鱼肉中央的温度,以冻结时间为横坐标、中心温度为纵坐标绘制红鳍东方鲀鱼肉冻结曲线,根据冻结曲线的拐点得出红鳍东方鲀鱼肉的冰点。
1.2.3 菌落总数的测定[16]
参照GB 4789.2—2016《食品安全国家标准 食品卫生物学检验 菌落总数测定》的平板培养计数法检测鱼肉微生物的总数。实验平行3次。
1.2.4 pH值的测定[17]
准确称5.00 g绞碎的鱼肉于烧杯中,加入50 mL蒸馏水,混匀后浸提30 min,pH计测量上清液pH值。实验重复3次。
1.2.5 水分含量的测定[18]
准确称3.00 g绞肉机绞碎的鱼肉于称量皿中,(105±1) ℃烘箱干燥恒重3 h。测定重复3次。记录干燥恒重前后称量瓶和鱼肉的总质量分别为W1和W2,水分含量计算如公式(1)所示:
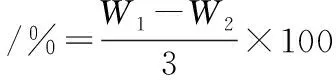
(1)
1.2.6 持水力的测定[19]
准确称5.00 g鱼肉于带滤纸的离心管中,称离心管和鱼肉的总质量记作W1,-2 ℃下5 000 r/min离心30 min,然后取出滤纸,除去鱼肉表层和管内壁的汁液,称离心管和鱼肉的总质量记作W2。测定重复3次。持水力计算如公式(2)所示:
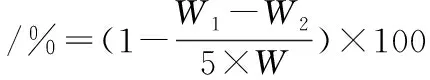
(2)
式中:W是1.2.5中得出的水分含量。
1.2.7 汁液流失率的测定[20]
取出贮藏的鱼肉,准确称10.00 g鱼肉于烧杯中,25 ℃恒温水浴锅中加热30 min,用滤纸除去烧杯外的水,称烧杯、鱼肉、渗出汁液的总质量记作W1,以及烧杯质量W3,除去烧杯内壁和鱼肉表层的汁液,记烧杯和鱼肉的总质量W2。实验平行3次。汁液流失率按公式(3)计算:
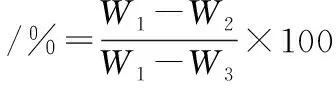
(3)
1.2.8 挥发性盐基氮(total volatile base nitrogen,TVB-N)的测定[21]
参照GB 5009.228—2016《食品安全国家标准 食品中挥发性盐基氮的测定》中的微量扩散法测定TVB-N的值。每个样品做3次平行。
1.2.9 硫代巴比妥酸(thiobarbituric acid,TBA)的测定
参照徐贞[22]的测定方法,略有改动。
(1)样品预处理
准确称取5.00 g绞碎的鱼肉于烧杯中,先后加25 mL三氯乙酸溶液(质量分数为20%)和20 mL蒸馏水,均质后浸提1 h。
(2)测定方法
将浸提后的溶液过滤至50 mL容量瓶中,蒸馏水定容。取5 mL滤液于试管中,加5 mL硫代巴比妥酸溶液(浓度为0.02 mol/L),振荡混匀,沸水浴(99 ℃)20 min,然后用自来水降至室温,用分光光度计测定532 nm处吸光度(A)。测定重复3次。TBA计算如公式(4)所示:
TBA/[mg·(100g)-1]=7.8×A
(4)
1.2.10 质构的测定[23]
取2 cm×2 cm×1 cm红鳍东方鲀背部肌肉,采用质构仪全质构模式对其硬度、弹性、咀嚼性、回复性进行测定。实验参数:压缩变形60%,触发力5 g,测前速度3 mm/s,测试速度1 mm/s,测后速度1 mm/s,二次压缩间隔时间5 s。测定重复3次。
1.2.11 微观组织结构的测定[24]
切取2 cm×2 cm×1 cm大小的红鳍东方鲀背部肌肉,将肌肉置于配制好的甲醛固定液中进行固定,固定48 h,然后在流水下冲洗12 h,将肌肉切成4 mm×3 mm×2 mm大小,用不同浓度梯度的乙醇溶液进行脱水,用二甲苯透明,然后将肌肉浸蜡包埋切片,将切片浸入Bouin氏液中,把切片和Bouin氏液一同置于37 ℃恒温箱2 h,在流水下冲洗至没有黄色,切片分别通过天青石蓝染色液、Mayer苏木素染色液、酸性乙醇分化液、丽春红品红染色液、苯胺蓝染色液进行染色,弱酸处理2 min,95 %(体积分数)乙醇溶液脱水,二甲苯透明3次,中性树胶封盖,然后盖上盖玻片,用10倍显微镜进行观察。
1.3 数据分析
试验数据采用Excel 2010进行统计,并绘制试验数据曲线,试验结果采用平均数表示,采用SPSS 17.0进行显著性分析,经双变量分析方法进行两两比较,采用双尾检验,P<0.05时显著相关。
2 结果与分析
2.1 红鳍东方鲀冻结曲线
图1为红鳍东方鲀的冻结曲线。由图1可以看出,红鳍东方鲀鱼肉中心温度由初始19.3 ℃开始下降,在24 min时降到0.4 ℃,鱼肉中心温度在前24 min下降迅速,冷冻至32 min以后进入一段平稳期,在这个温度范围内,水产品中大部分水分结成冰,放出相应的潜热,整个冻结过程中大部分热量是在这一阶段放出,所以温度变化速度慢,曲线平坦。平稳期鱼肉中心温度为-0.9 ℃,冷冻至62 min时结束平稳期,这段平稳期为鱼肉最大冰晶生成带,平稳期后鱼肉中心温度下降趋势增大,142 min时鱼肉中心温度降到-25 ℃,温度进入平稳阶段不再下降。冰点是指水和冰平衡共存时的温度,此时由于水和冰之间的相变热使鱼肉的温度维持平稳的状态,因此将-0.9 ℃定为红鳍东方鲀的冰点。微冻保鲜是将鱼肉置于略低于其冰点1~2 ℃的温度下进行保鲜的方法[25]。由于试验测定红鳍东方鲀的冰点为-0.9 ℃,故将微冻保鲜温度定为-3 ℃。
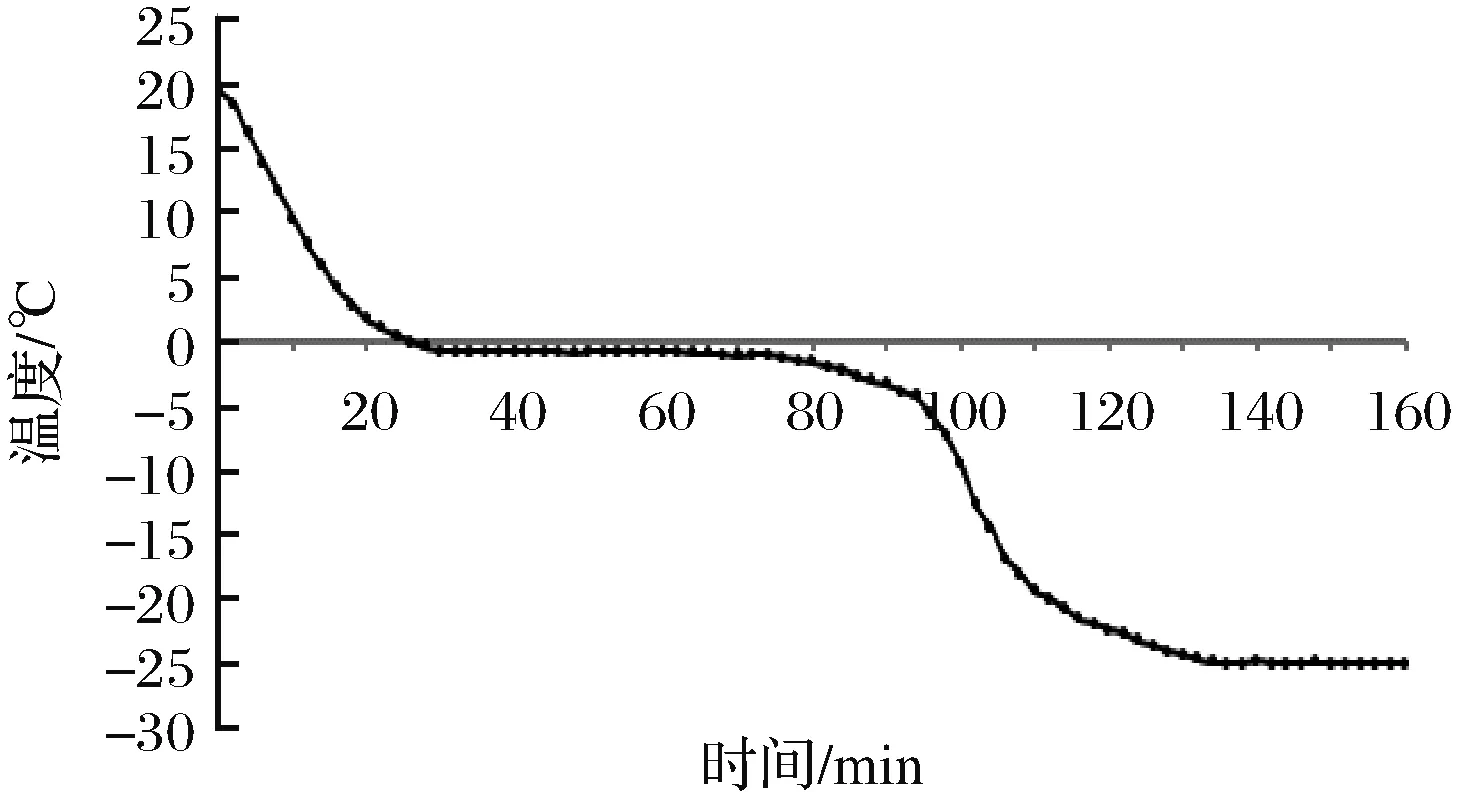
图1 红鳍东方鲀冻结曲线Fig.1 Freezing curve of Takifugu rubripes
2.2 菌落总数的变化
微冻过程中红鳍东方鲀鱼肉菌落总数的变化如图2所示,新鲜红鳍东方鲀的菌落总数为2.97 lg CFU/g,微冻过程中菌落总数呈上升趋势,上升速率逐渐增大。这是由于微冻可以抑制微生物体内的酶活性,使微生物几乎不能繁殖,同时,微冻期间微生物体内部分水结冰,使水分活度降低,细胞液浓度升高[26],理化反应发生改变。贮藏过程中鱼肉中的有机物被微生物和酶分解为小分子营养物质,促进微生物生长繁殖,故微生物数量增加速率随着贮藏时间的延长逐渐增加。贮藏第10天菌落总数为4.58 lg CFU/g,至第15天时菌落总数增加到6.54 lg CFU/g,超过了国家标准规定的水产品可食用阈值5.0 lg CFU/g[27]。
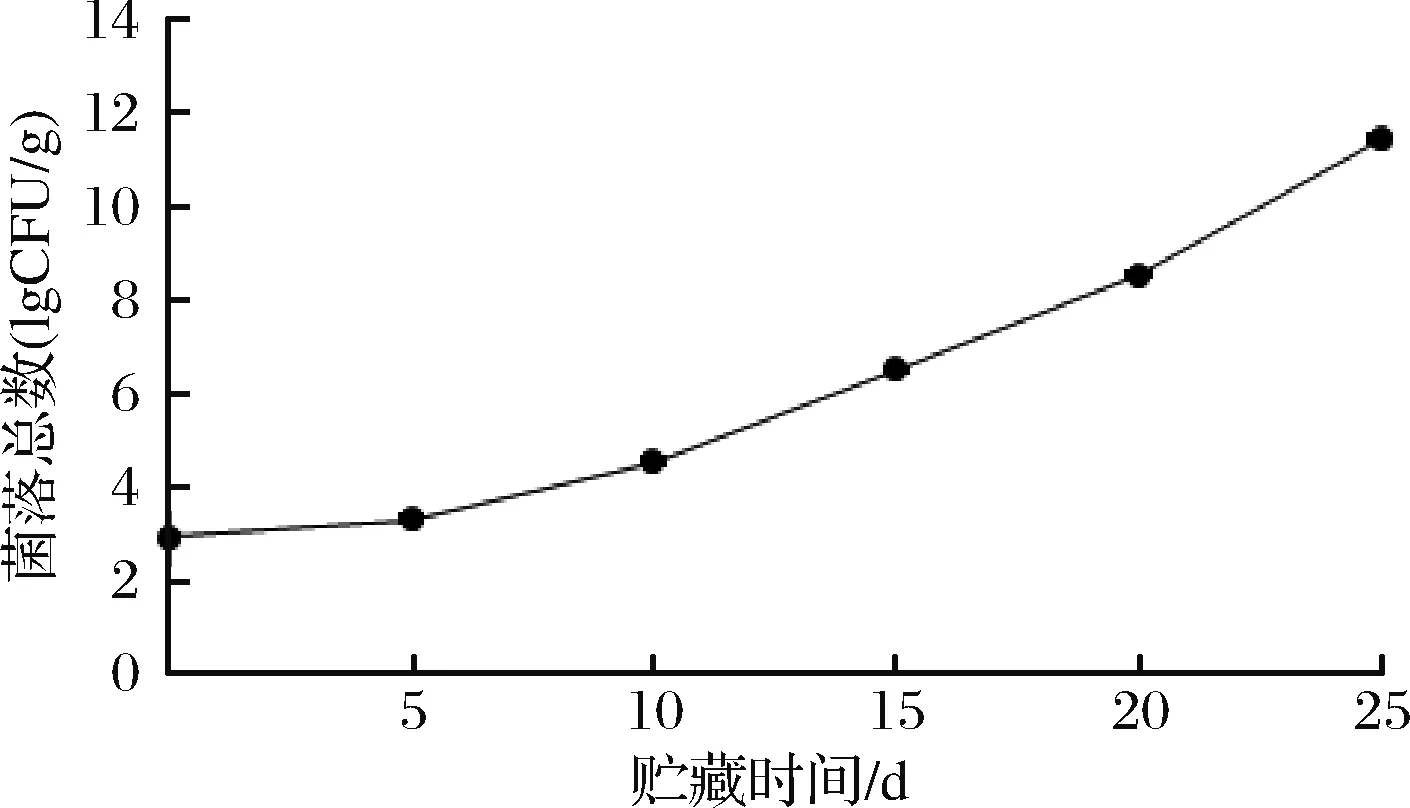
图2 红鳍东方鲀微冻过程中菌落总数的变化Fig.2 Change of total plate counts during micro-frozen of Takifugu rubripes
2.3 pH值的变化
微冻过程中红鳍东方鲀鱼肉pH的变化如图3所示,红鳍东方鲀pH值先下降后上升,在贮藏第10天时pH达到最低值,最低点之前pH值下降速率较快,pH值从第10天开始上升,上升速率缓慢,贮藏第25天时pH为6.21。这是由于微冻贮藏降低了鱼肉酶和微生物对蛋白质的分解作用,使氨等碱性物质生成量减少,故上升速率较慢。较冷藏而言,微冻保鲜可有效抑制红鳍东方鲀的自溶作用,产生的碱性物质减少,磷酸化水平较低[28-29],从而使鱼肉的保鲜期延长。
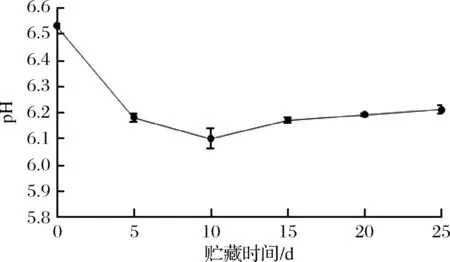
图3 红鳍东方鲀微冻过程中pH的变化Fig.3 Change of pH during micro-frozen of Takifugu rubripes
2.4 持水力的变化
微冻过程中红鳍东方鲀鱼肉持水力的变化如图4所示,鱼肉持水力随着贮藏时间的延长呈下降趋势,贮藏前15 d持水力下降速率较小,第15~25天持水力下降速率增大,贮藏至第25天下降到68.62 g/100g。由于微冻使鱼肉中的水分结冰,贮藏过程中细胞内冰晶数量逐渐增多,部分冰晶体积增大,对细胞结构的破坏程度逐渐增大,且微冻抑制了内源酶和外源微生物的分解作用,前期微生物和酶数量少,组织细胞较完整,离心时细胞内的组织液外渗较少;贮藏后期微生物繁殖使得分解作用增大,部分微生物代谢产物含有酶,与鱼肉内源酶共同作用,使分解速率加快,细胞内、细胞间水分和组织液增多,且细胞被破坏程度逐渐增大,故鱼肉离心损失量逐渐增大。鱼肉的持水力越大,说明鱼肉组织蛋白被破坏的程度越小,鱼肉品质越好。

图4 红鳍东方鲀微冻过程中持水力的变化Fig.4 Change of water holding capacity during micro-frozen of Takifugu rubripes
2.5 汁液流失率的变化
微冻过程中红鳍东方鲀鱼肉汁液流失率的变化如图5所示,贮藏过程中汁液流失率呈上升趋势。贮藏前5 d上升速率较大,第5~25天上升速率较小,呈逐渐增大的趋势,贮藏至第25 d上升到16.93 g/100g。这是由于微冻过程中鱼肉pH的变化,一方面使蛋白质对水分子的束缚力减弱,另一方面使蛋白质分子的正负基团相互吸引靠近,使分子内水分被挤出[30]。鱼肉中酶和微生物的分解作用,使细胞结构被破坏,以上原因均使鱼肉汁液流失率增大。微冻后期由于冰晶数量和体积的增大、蛋白质结构的变化导致汁液流失率增大[26]。微冻过程中细胞中的水分变成冰晶,使细胞结构被破坏,解冻后融化的冰晶不会被细胞完全吸收,便会形成汁液流失,而冰晶的形成改变了细胞的渗透压,有抑菌的作用,可减少细胞液的流失[31]。汁液流失率增大,鱼肉中营养物质流失的增多,鱼肉品质变劣。
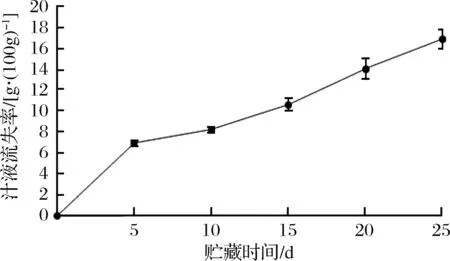
图5 红鳍东方鲀微冻过程中汁液流失率的变化Fig.5 Change of juice loss rate during micro-frozen of Takifugu rubripes
2.6 TVB-N的变化
挥发性盐基氮是度量鱼类鲜度的重要指标,根据GB/T 18108—2019[32]可知,一级鲜度界限为≤15 mg/100g,二级鲜度界限为≤20 mg/100g,三级鲜度界限为≤30 mg/100g。微冻过程中红鳍东方鲀鱼肉TVB-N的变化如图6所示,微冻过程中红鳍东方鲀的TVB-N呈上升趋势。贮藏第10天时TVB-N为11.9 mg/100g,属于一级品鲜度,贮藏第15天为15.87 mg/100g,属于二级品鲜度,贮藏至第25天上升到21.7 mg/100g,属于三级品鲜度,在可食用范围内。贮藏过程中鱼肉中含氮物质在酶和微生物的分解作用下,生成氨氮类挥发性物质[33]。随着菌落总数的增加,氨氮类物质含量增加,曲线上升速率逐渐增大。
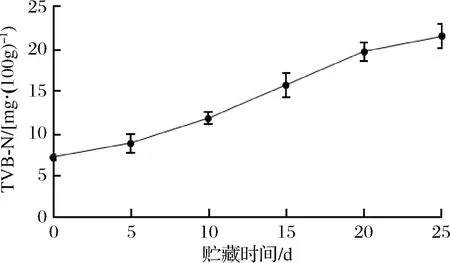
图6 红鳍东方鲀微冻过程中TVB-N的变化Fig.6 Change of TVB-N during micro-frozen of Takifugu rubripes
2.7 TBA的变化
硫代巴比妥酸值是常用的判定水产品脂肪酸氧化程度的指标,其原理是脂肪酸氧化产生的丙二醛和硫代巴比妥酸反应生成粉红色化合物。微冻过程中红鳍东方鲀鱼肉TBA的变化如图7所示,贮藏过程中TBA呈上升趋势。贮藏前期是脂肪酸氧化酸败诱导期[34],贮藏前10 d增加速率平缓,至第10天开始TBA值增加速率明显增加,增加速率随贮藏时间的延长逐渐增大。贮藏第10天时TBA值为0.185 mg/100g,贮藏至第25天升到0.328 mg/100g。这是由于微冻过程中细胞结构被破坏,使不饱和脂肪酸与空气接触面积增加,氧化产生的丙二醛增加,与硫代巴比妥酸反应增加。故TBA值可代表鱼肉中脂肪的氧化程度,TBA值越大,鱼肉中脂质被氧化的程度越大,鱼肉品质越差。
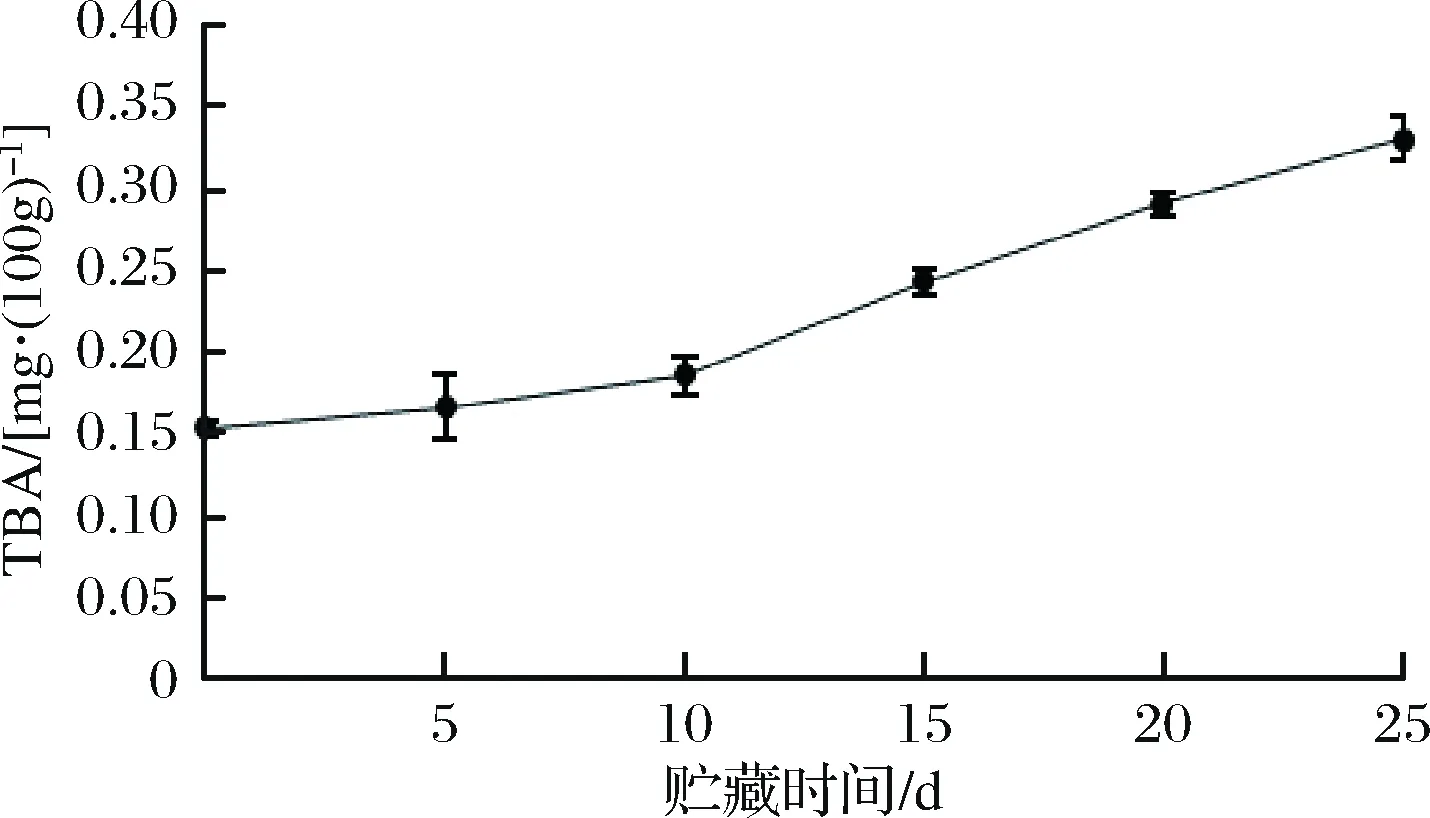
图7 红鳍东方鲀微冻过程中TBA的变化Fig.7 Change of TBA during micro-frozen of Takifugu rubripes
2.8 质构的变化
质构是评价水产品优劣的重要因素。细胞结构随冻融过程发生很大变化,冰晶使细胞中自由水含量降低,使组织细胞比表面积增大[35],使组织细胞受损,细胞间隙增大,从而使肉质变软且失去弹性。水产品的质构在一定程度上反映了食品的感官质量,通常可以通过硬度、弹性、咀嚼性等来表征。
2.8.1 硬度的变化
微冻过程中红鳍东方鲀背部肌肉硬度的变化如图8所示,新鲜红鳍东方鲀背部肌肉的硬度为0.233 N。微冻过程中硬度呈下降趋势。其中微冻贮藏前15 d硬度下降速率较大,贮藏第15天硬度为0.113 N,贮藏第15~25天背部肌肉的硬度下降速率变缓慢,贮藏第25天下降至0.080 N。这是由于微冻过程中,微生物和酶的分解作用使得肌肉组织中蛋白质结构发生变化,鱼肉中肌原组织、连接组织被破坏,从而使肌肉硬度下降。随着鱼肉硬度的下降,软化程度增加,鱼肉品质变差。软化是鱼肉加工及贮藏过程中需解决的关键性问题,减缓鱼肉的软化进程对于鱼肉相关产业具有很高的经济价值[36]。
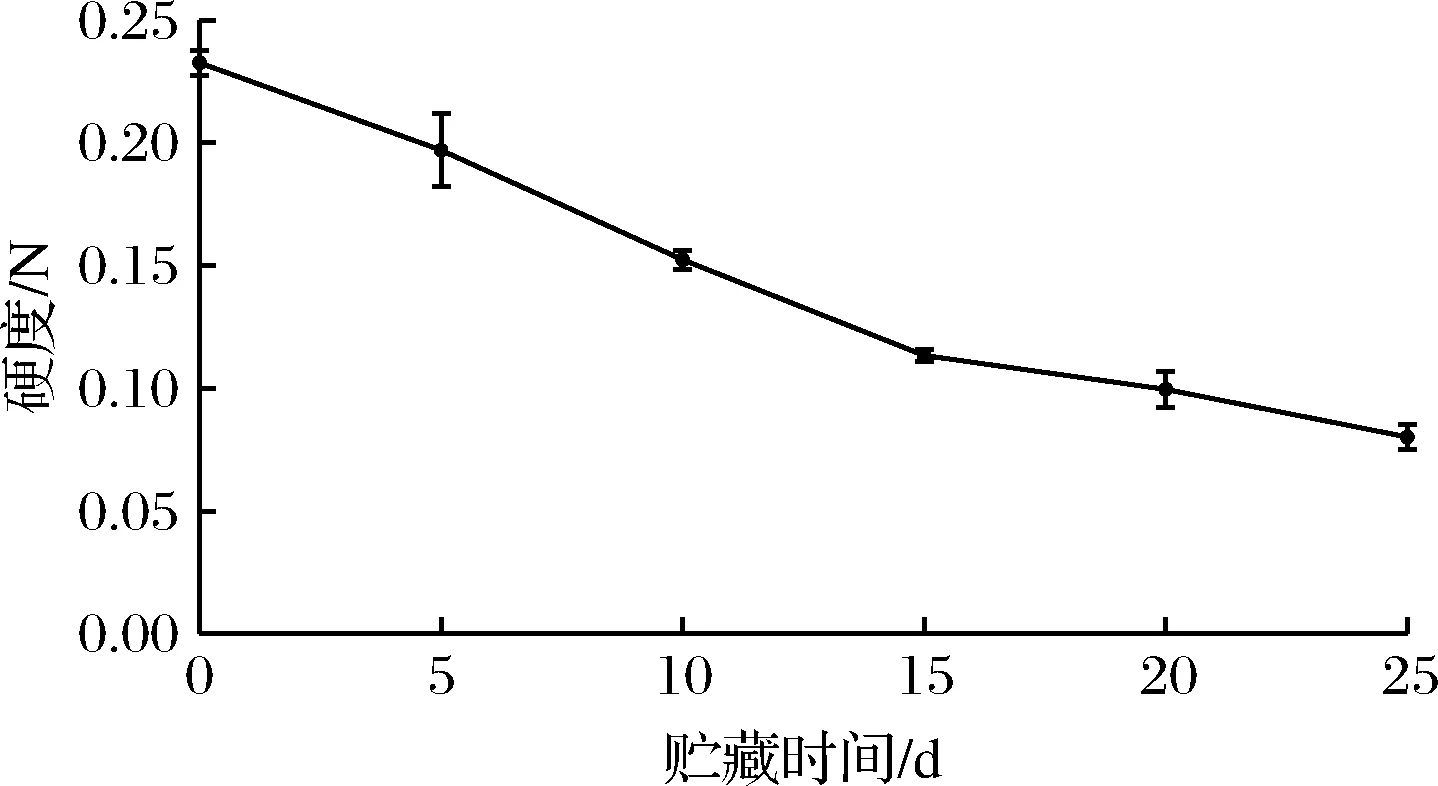
图8 红鳍东方鲀微冻过程中硬度的变化Fig.8 Change of hardness during micro-frozen of Takifugu rubripes
2.8.2 弹性的变化
微冻过程中红鳍东方鲀背部肌肉弹性的变化如图9所示,红鳍东方鲀背部肌肉的弹性随着微冻贮藏时间的延长呈下降趋势,与硬度显著性正相关(P<0.01)。新鲜红鳍东方鲀背部肌肉的弹性为0.98,微冻贮藏至25 d时弹性下降至0.56,其中微冻贮藏前5 d背部肌肉硬度下降速率较大。贮藏期间出现的上升点,可能是由于红鳍东方鲀致死时间的差异,使得贮藏过程中蛋白质组成出现差异。
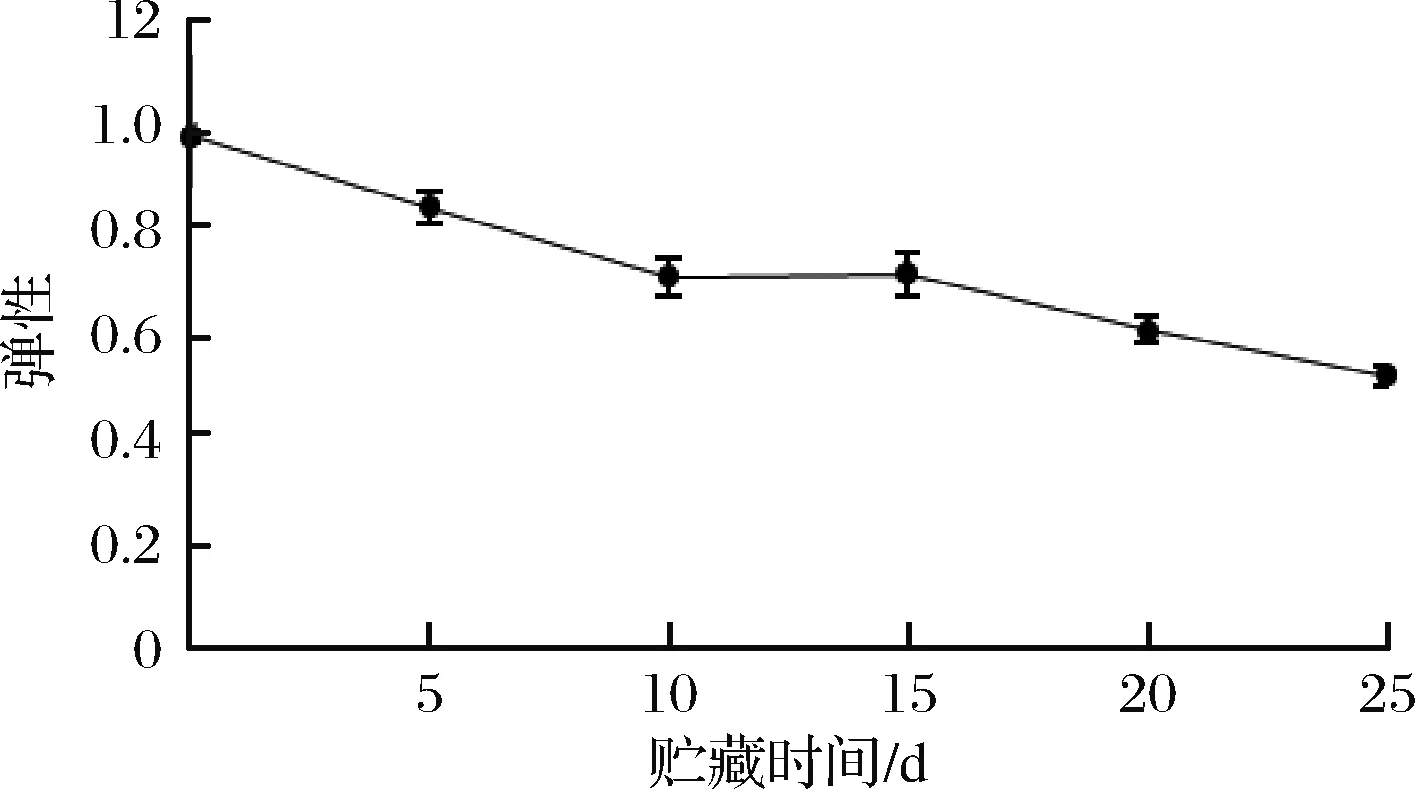
图9 红鳍东方鲀微冻过程中弹性的变化Fig.9 Change of springiness during micro-frozen of Takifugu rubripes
2.8.3 咀嚼性的变化
微冻过程中红鳍东方鲀背部肌肉咀嚼性的变化如图10所示,微冻过程中咀嚼性呈下降趋势。微冻贮藏前20 d背部肌肉的咀嚼性下降趋势缓慢,贮藏第20天咀嚼性为-0.159 N,贮藏第20~25天背部肌肉咀嚼性下降速率急剧增大,贮藏至第25天下降到-0.395 N。
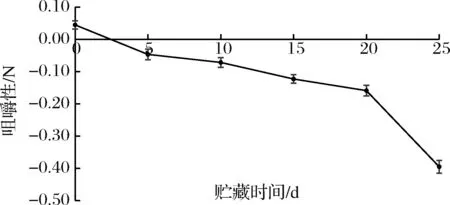
图10 红鳍东方鲀微冻过程中咀嚼性的变化Fig.10 Change of chewiness during micro-frozen of Takifugu rubripes
2.8.4 回复性的变化
微冻过程中红鳍东方鲀背部肌肉回复性的变化如图11所示,新鲜红鳍东方鲀背部肌肉的回复性是0.721,微冻过程中回复性呈下降趋势。贮藏过程中回复性下降速率随着贮藏时间的延长而逐渐增大,微冻贮藏至第25天时红鳍东方鲀背部肌肉的回复性降至0.383。
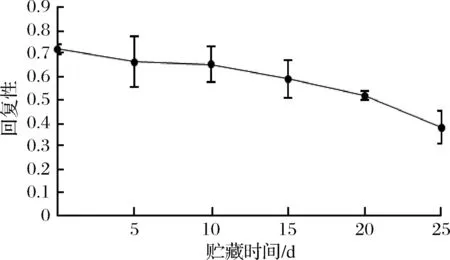
图11 红鳍东方鲀微冻过程中回复性的变化Fig.11 Change of resilience during micro-frozen of Takifugu rubripes
2.9 微观组织结构的变化
2.9.1 横向组织切片分析
微冻过程中红鳍东方鲀背部肌肉组织横向切片如图12所示,新鲜红鳍东方鲀背部肌肉组织细胞大小均匀,排列紧密,肌肉内膜光滑平缓,分布均匀,细胞内无空隙。贮藏至第10天,细胞内出现空隙。随着贮藏时间的延长,肌肉组织细胞间的空隙逐渐变大,细胞内空隙增多。一方面,微冻过程中细胞内、细胞间生成冰晶,对细胞产生机械损伤,使细胞内水分流失,且冰晶使细胞液浓度上升,使部分结构蛋白质发生变性[37],贮藏时间越久,蛋白质变性程度越大,细胞的机械损伤程度越大,细胞间空隙越大。另一方面,pH的下降导致了Ca2+的外泄[38],使肌细胞无法收缩,从而造成细胞间空隙逐渐增大。
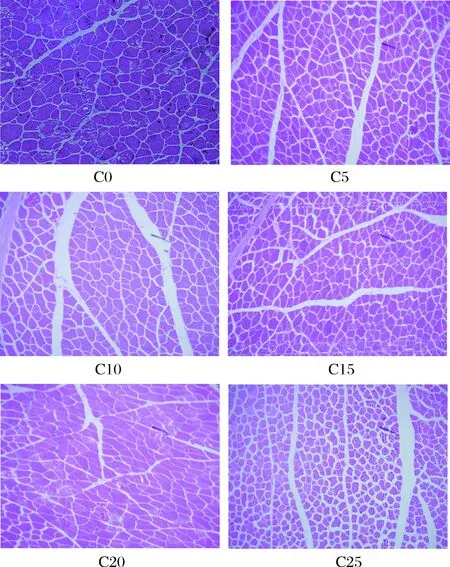
C0、C5~C25分别为新鲜红鳍东方鲀微冻贮藏5、10、15、20、25 d肌肉组织横向切片图12 微冻过程中红鳍东方鲀肌肉组织横向切片Fig.12 Muscle tissue transverse section of Takifugu rubripes during micro-frozen
2.9.2 纵向组织切片分析
微冻过程中红鳍东方鲀背部肌肉组织纵向切片如图13所示,新鲜红鳍东方鲀背部肌肉组织纵切面细胞排列紧密,微冻过程中红鳍东方鲀鱼肉的肌肉束间的间隙随着贮藏时间的延长而逐渐增大,微冻贮藏初期肌肉束排列紧密且完整,随着贮藏时间的延长,部分肌肉纤维束出现断裂,且肌肉束间出现空隙。这是由于低温使得组织细胞内和细胞间生成大小不同的冰晶,细胞内外压力增大,对细胞造成机械损伤。贮藏后期肌原纤维、结构蛋白不断被降解,使肌肉束之间空隙增大,肌肉束断裂增多[39]。由此可知,肌肉束之间的间隙随着贮藏时间的延长而越来越大,肌肉束断裂随着贮藏时间的延长而逐渐增多,说明微冻贮藏的时间对红鳍东方鲀鱼肉肌肉束的完整度影响很大。
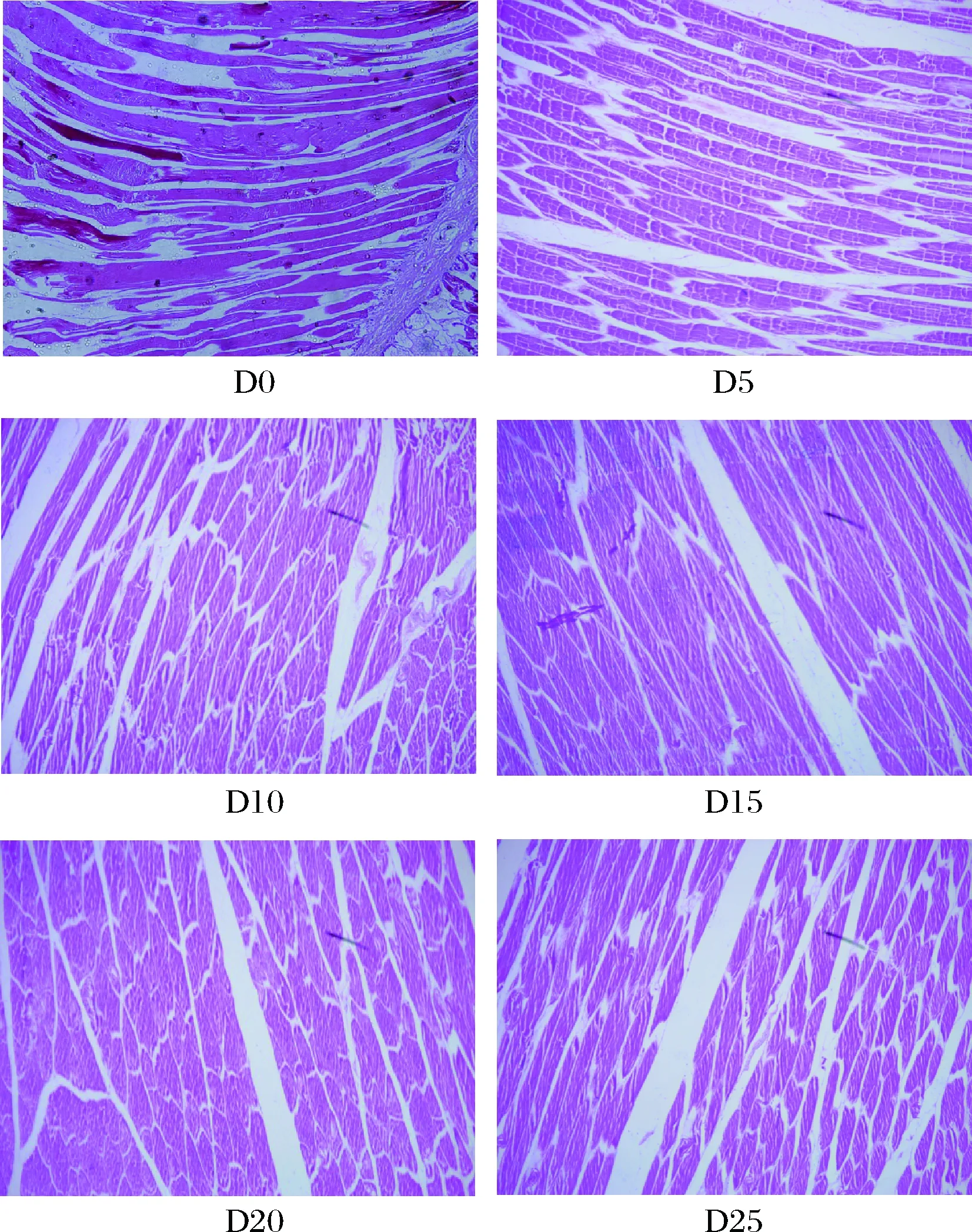
D0、D5~D25分别为新鲜红鳍东方鲀,微冻贮藏5、10、15、20、25 d肌肉组织纵向切片图13 微冻过程中红鳍东方鲀肌肉组织纵向切片Fig.13 Muscle tissue longitudinal section of Takifugu rubripes during micro-frozen
3 结论
本实验以红鳍东方鲀为研究对象,研究了微冻贮藏过程中红鳍东方鲀鱼肉品质的变化,主要结论如下,-3 ℃微冻贮藏过程中,红鳍东方鲀pH值呈先下降后上升的趋势,贮藏第10天时pH达到最低值6.10;汁液流失率、TVB-N、TBA、菌落总数呈上升趋势,其中贮藏第15天时TVB-N、TBA分别为15.87 mg/100g、0.242 mg/100g,属于二级品鲜度,贮藏至第15天时菌落总数增加到6.54 lg CFU/g,超过了水产品国家标准规定的可食用阈值5.0 lg CFU/g;持水力、硬度、弹性、咀嚼性、回复性呈下降趋势;由红鳍东方鲀背部肌肉横向和纵向切片显微结构观察结果得出,随着贮藏时间的延长,细胞内和细胞间空隙逐渐增大,纤维束逐渐松散,并出现断裂。微冻贮藏过程中红鳍东方鲀品质呈变劣趋势,贮藏1~15 d食用最佳。今后可从微冻过程中感官品质、蛋白质二级结构、气味物质组成及水分流动性的变化方面开展进一步研究。
