微小RNA-146a通过靶向信号转导与转录激活子1表达调节颈动脉粥样硬化中血管内皮细胞的生物学特性
2020-10-11欧福勇李珍丽姚晓喜
欧福勇 李珍丽 姚晓喜
423000 郴州市第一人民医院神经内科(欧福勇、姚晓喜),耳鼻喉科(李珍丽)
以发病率高、致残率高为特点的颈动脉粥样硬化(carotid atherosclerosis,CAS)是导致患者脑卒中和短暂性脑缺血发作的主要原因之一。其主要病理改变在于颈动脉内膜大量脂质沉积,血管内皮细胞功能障碍等进而导致动脉血管内膜增生、血管重构等恶性血管事件的发生[1]。研究表明,颈动脉血管内皮细胞损伤是CAS的始动环节[2]。因此,寻找有效的保护颈动脉血管内皮细胞的手段对于CAS的治疗具有重大意义。微小RNA(microRNA,miR)是具有调控功能的非编码RNA,参与调节血管内皮细胞的生物性能[3]。已经证实,miR-217、miR-34a参与调节内皮细胞的凋亡过程[4]。而近年来,miR-146a对血管内皮细胞的保护作用引起关注。Anzola等[5]研究证实,miR-146a能够调控肠道微血管内皮细胞抵抗炎症反应。Wang等[6]研究显示,miR-146a在由糖尿病引起的神经性血管重构中发挥关键作用。但有关miR-146a对颈动脉内皮细胞的作用尚未见报道。Janus激酶2/信号转导与转录激活子1(janus activated kinase 2/signal transducer and activator of transcription 1,JAK2/STAT1)通路是细胞内重要的信号转导通路,参与调控细胞生长、分化、增殖和凋亡等病理生理过程[7]。Gregersen等[8]报道,STAT1在CAS中存在表达异常的现象。本研究通过构建CAS动物模型,探讨miR-146a和STAT1对颈动脉内皮细胞生理功能的影响,以期为临床研究提供数据支撑。
1 材料与方法
1.1 材料
1.1.1 实验生物 4月龄清洁级雄性新西兰白兔40只,体重(2.0±0.2)kg,由我院实验动物中心提供,生产许可证号:SYXK(湘)2018-0008,动物使用许可证号:SYXK(湘)2018-0007;依照我院实验动物管理办法,室温21℃~25℃下,湿度维持在60 %左右,自然光照、标准饲料、自由饮水、单笼饲养1周后用于实验。
MiR-146a模拟物miR-146a-mimics及miR-146a模拟物阴性对照miR-146a-mimics-NC由上海吉玛技术有限公司设计完成。
1.1.2 试剂及主要仪器 LipofectamineTMRNAiMAX转染试剂(德国QIAGEN公司);全蛋白抽提试剂盒(日本TOYOBO公司);PBS缓冲溶液、EdU试剂盒(美国Invitrogen公司);双荧光素酶测定试剂盒Ⅰ、Ⅲ型胶原兔多克隆抗体(美国Abcamn公司);麻醉剂、JAK2抗体、磷酸化STAT1(p-STAT1)抗体(美国Jackson公司);反转录试剂盒、Western blot试剂盒(美国Sigma公司);Transwell小室(美国R&D公司);TUNEL试剂盒(美国Amresco公司)。
YJ-875A医用净化工作台(北京六一仪器厂);LIOOS600T荧光显微镜(日本尼康公司);Bio-rad凝胶成像系统(Bio-rad公司);-80℃深冷冰箱(德国维根斯公司);Leica RM2135组织切片机(德国Leica公司);高速低温离心机(北京六一仪器厂);qRT-PCR仪(美国Palo Alto公司)。
1.2 方法
1.2.1 构建颈动脉粥样硬化动物模型及实验分组将40只新西兰白兔按随机数字表法分成4组,每组10只,分别为:假手术组(sham组)、模型组、miR-146a-mimics-NC组(对照组)和miR-146a-mimics组(实验组)。
准确量取2.5 μL的LipofectamineTMRNAiMAX分别与9 μL的miR-146a-mimics-NC、miR-146a-mimics混合均匀,37℃下静置2 h。通过尾静脉分别注射7 μL混合液到对照组和实验组动物体内,注射速度维持在2 μL/min,留针时长5 min,sham组和模型组注射等剂量的生理盐水。注射完毕24 h后,采用150 g 2%L-蛋氨酸饲料喂养配合颈总动脉球囊损伤法构建颈动脉粥样硬化模型[9]。具体操作如下:sham组采用标准饲料喂养,模型组、对照组和实验组每日均使用150 g 2%L-蛋氨酸喂养,喂养2周后,施以球囊损伤造成颈内动脉内膜损伤,继续以150 g/d 2%L-蛋氨酸喂养4周。球囊损伤手术如下:术前12 h禁食不禁水,耳缘静脉注射1 ml/kg 3%戊巴比妥钠麻醉,兔板固定在手术台上,常规方法颈部备皮,沿颈正中线切开皮肤,剥离左侧颈总动脉,用虹膜剪在颈总动脉远心端剪开一个V型切口将直径为0.67 mm的球囊插入血管内,使用微型注射器来回抽插注入空气扩张球囊,抽插距离不超过1.5 cm,抽插3次后撤出球囊,使用无菌7-0结扎线在颈正中线切口近心端处结扎颈外动脉,同时松开所有血管钳,观察颈动脉内血流正常且无出血点,缝合颈部皮肤,术毕每日1次静脉注射80万单位青霉素注射液防止感染,连续3次。sham组只剥离颈内动脉,不进行球囊扩张和结扎,余同模型组。
1.2.2 HE染色检测CAS病理改变 喂养4周后,实验兔均禁食12 h后处死,剥离各组动物的颈内动脉,80%的组织标本进行液氮封存,20%的组织标本,56℃水浴1 h,生理盐水冲洗10 min,10%甲醛溶液固定1 h,石蜡包埋10 min,切片,蒸馏水清洗3次,HE染色,光镜下观察CAS病变程度。
1.2.3 原代培养各组动物颈动脉的血管内皮细胞取出20%各组组织标本,将标本上的脂肪、结缔组织剔除干净,使用微型剪在显微镜下将其剪成若干3 mm×3 mm的小片,内皮向下贴入培养瓶中,置入37℃、5%CO2培养箱常规培养4 h后,向培养瓶中加入含有灭活的10%FBS、peillin G、STC的DMEM培养基,在细胞密度达85%后,0.25%胰蛋白酶消化传代进行后续实验。
1.2.4 EdU标记实验检测各组细胞的增殖情况调整各组细胞浓度,以5×104个/孔接种于6孔培养板中,置入37℃、5%CO2培养箱常规培养,细胞培养2 h后,10%甲醛固定并进行EdU实验,操作严格按照试剂盒操作要求进行。
1.2.5 Transwell小室检测各组细胞的迁移 调整各组细胞浓度,以5×104个/孔接种于24孔无血清培养板中,置入37℃、5%CO2培养箱常规培养24 h,用DMEM重悬细胞至细胞浓度为3×105个/L,将250 μL的细胞悬液加入Transwell上室,同时在Transwell下室中添加500 μL浓度为10%的FBS培养液,37℃、5%CO2培养箱常规培养12 h,PBS漂洗后用棉棒擦Transwell小室内部,4%甲醛固定,0.1%结晶紫室温避光染色10 min,置于倒置荧光显微镜下观察并统计穿过基底膜材料Matrigel细胞数。
1.2.6 小管形成实验检测各组细胞的血管生成能力 在96孔培养板上平铺一层新鲜Matrigel溶胶,迅速转移进无菌培养箱设定37℃,待Matrigel溶胶凝固后,将人脐静脉内皮细胞以1×104个/ml接种在96孔板中,然后分组同上,分别加入各组细胞的培养上清液,继续培养48 h,倒置光学显微镜下观察人脐静脉内皮细胞的血管生成情况并拍照记录。
1.2.7 TUNEL染色检测各组细胞的凋亡 调整各组细胞浓度,以5×104个/孔接种于6孔培养板中,置入37℃、5 %CO2培养箱常规培养,10%甲醛固定,二甲苯浸洗两次,梯度乙醇浸洗5 min,风干后3%过氧化氢-甲醇浸泡10 min,PBS漂洗3次,每次3 min,然后4℃预冷乙醇上进行如下操作:0.1% TritonX-100、0.1%缓冲液处理2 min,PBS漂洗3次,每次3 min,加入TUNEL反应混合液,加封口膜在暗湿盒中反应1 h,温度37℃,PBS漂洗,梯度乙醇脱水,二甲苯透明,中性树脂封片,荧光显微镜进行观察。
1.2.8 qRT-PCR检测miR-146a和STAT1蛋白的mRNA表达 取出10%组织标本,采用常规方法提取各组实验动物颈动脉组织标本细胞的RNA,并利用比色法和琼脂糖凝胶电泳法测定RNA浓度和检测RNA完整性[10]。采用多基因梯度进行实时定量聚合酶链反应(qRT-PCR),根据引物设计原则,进行引物序列设计,反应过程:(1)预变性:75℃,120 s;(2)变性:90℃,5 min;(3)退火:60℃,60 s;(4)延伸72℃,30 s;(5)PCR仪采集荧光信号40个循环。GAPDH作为内参(上游引物为5’-CACATGGCCTCCAAGGA-3’,下游引物为5’-TCCCCTCTTCAAGGGGT-3’),目的基因miR-146a(上游引物为5’-GGACAATTTGGGCTAGA-3’,下游引物为5’-ACGTAGTTCTCCTGGCA-3’),STAT1的mRNA(上游引物为5’-AGACAAATGGGCTACA-3’,下游引物为5’-AAAGCTGAGTTTGCGGA-3’)。目的基因相对表达量用2-△△CT表示。
1.2.9 荧光素酶报告基因分析 采用RT-PCR技术从新西兰白兔的星形胶质细胞基因组中选择性扩增目的蛋白STAT1的3’-非翻译区(3’-untranslated region,UTR)序列,一方面用于构建双荧光素酶报告基因分析(luciferase reporter gene)中的载体pGL3(pGL3-STAT1-WT),另一方面构建突变型重组质粒(pGL3-STAT1-MUT),将人胚胎肾细胞(HEK293)按25%左右密度接种在36孔培养板中,待细胞培养24 h后,在培养板上将miR-146a-mimics和miR-146a-mimics-NC与空载质粒及上述质粒分别进行转染操作。转染完成24 h后,严格按照双荧光素酶测定试剂盒说明书进行操作测定样本的荧光素酶活性,而萤火虫荧光素酶/海肾荧光素酶活性值即为报告基因活性。
1.2.10 Western blot检测各组标本中JAK2、p-STAT1蛋白的表达 取出10%各组组织标本,按照常规提取目标蛋白JAK2和p-STAT1,加入RIPA组织裂解液中匀浆器打碎,冰上裂解30 min后,离心获得上清,采用BCA试剂盒检测蛋白浓度,每个样品取50 μg,然后进行SDS-PAGE电泳、PVDF转膜、加入封闭液TBST,维持4℃过夜孕育,然后分别加入1∶1 500一抗(JAK2、p-STAT1),孕育1 h,洗涤加入抗辣根过氧化物酶标记的羊抗兔IgG(1∶10 000),加入ECL显色30 min,以GAPDH作为内参表示蛋白相对表达水平。
1.3 统计学方法
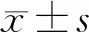
2 结果
2.1 HE染色检测各组实验兔的CAS病理改变
HE染色结果如图1所示,sham组兔的颈动脉颜色均匀,柔软且富有弹性,管腔通畅,内膜光滑,内皮细胞结构完整,胞核性状规则的定位在细胞中央,内膜、中膜以及外膜界限清晰,内膜细胞形状规整多为扁平状,中膜细胞多为椭圆形的平滑肌细胞,胶原和弹力纤维组织环绕周围;模型组兔的颈动脉颜色发白或略显黄色,管壁明显增厚,僵硬度增加,管腔表面失去光泽,管腔内可见粥样或纤维斑块,以致管腔狭窄,内膜可见白色条纹或黄白色斑块,内皮细胞脱落明显,脂质泡沫细胞增生明显,中层平滑肌细胞分布紊乱,性状不规整,泡沫细胞大量填充,弹力纤维缺失、断裂、溶解明显,胶原纤维大量形成;对照组兔的颈动脉颜色黄白相间,弹性缺失,内膜细胞增厚明显,泡沫状的细胞大量填充;实验组兔的颈动脉颜色略显红润,弹性明显恢复,内膜细胞性状较模型组明显好转,平滑肌细胞排列趋于规则,泡沫细胞的数量明显减少,管腔内的薄层脂斑沉积明显减少。
2.2 EdU标记实验检测各组细胞的增殖情况
EdU标记实验直接反映细胞内DNA合成能力进而代表细胞的增殖能力。本研究中EdU标记实验结果如图2 所示,与sham组相比,模型组细胞内DNA合成能力明显下降;与模型组相比,实验组细胞内的DNA合成能力明显增强,差异均有统计学意义(均为P<0.05)。模型组与对照组比较,差异无统计学意义(P>0.05)。
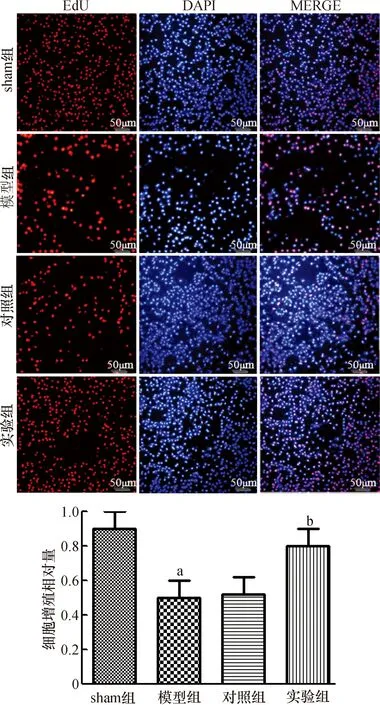
与sham组比较,aP<0.05;与模型组比较,bP<0.05
2.3 Transwell小室检测各组细胞的迁移
Transwell小室检测结果如图3所示,与sham组相比,模型组细胞迁移数量明显下降;与模型组相比,实验组细胞的迁移数量明显上升,差异均有统计学意义(均为P<0.05)。模型组与对照组比较,差异无统计学意义(P>0.05)。
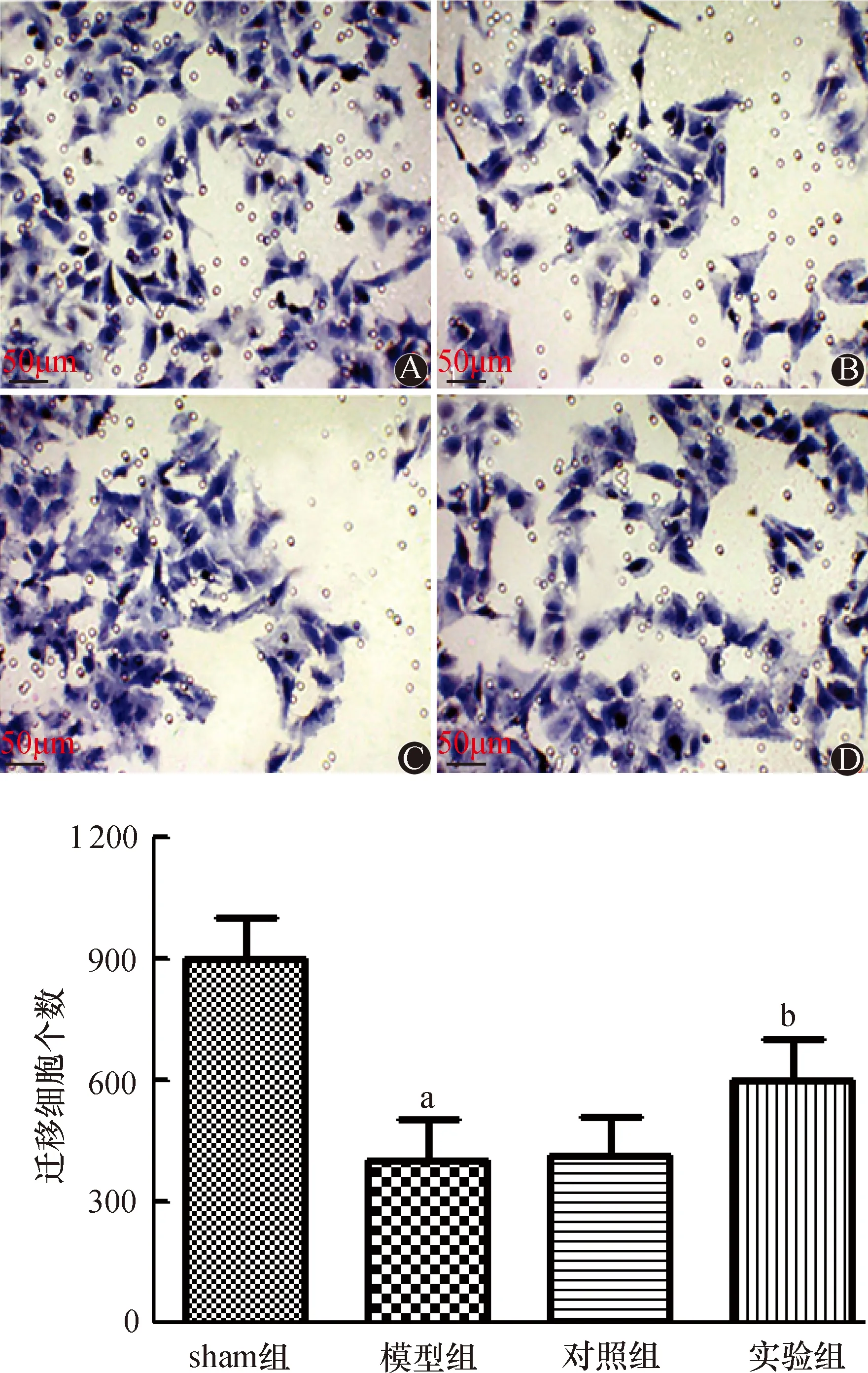
A:sham组;B:模型组;C:对照组;D:实验组;与sham组比较,aP<0.05;与模型组比较,bP<0.05
2.4 小管形成实验检测各组细胞的血管生成能力
血管生成主要是内皮细胞的活化、发芽、增殖、迁移和管样结构形成的复杂的细胞生理过程。本研究中小管形成实验结果如图4所示,与sham组相比,模型组细胞小管形成数量明显下降;与模型组相比,实验组细胞小管形成数量明显上升,差异均有统计学意义(均为P<0.05)。模型组与对照组比较,差异无统计学意义(P>0.05)。
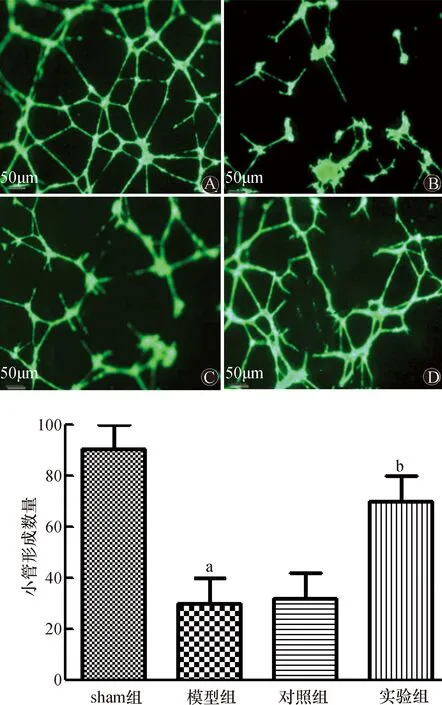
A:sham组;B:模型组;C:对照组;D:实验组;与sham组比较,aP<0.05;与模型组比较,bP<0.05
2.5 TUNEL染色检测各组细胞的凋亡
TUNEL染色结果如图5所示,与sham组相比,模型组细胞凋亡数量明显上升;与模型组相比,实验组细胞凋亡数量明显下降,差异均有统计学意义(均为P<0.05)。模型组与对照组比较,差异无统计学意义(P>0.05)。
2.6 Western blot检测各组标本中JAK2、p-STAT1蛋白的表达
Western blot检测各组标本中JAK2和p-STAT1的蛋白表达水平如图6所示,与sham组相比,模型组JAK2和p-STAT1的表达明显升高(均为P<0.05);与模型组相比,实验组JAK2和p-STAT1表达明显下降(均为P<0.05)。模型组与对照组比较,差异无统计学意义(P>0.05)。
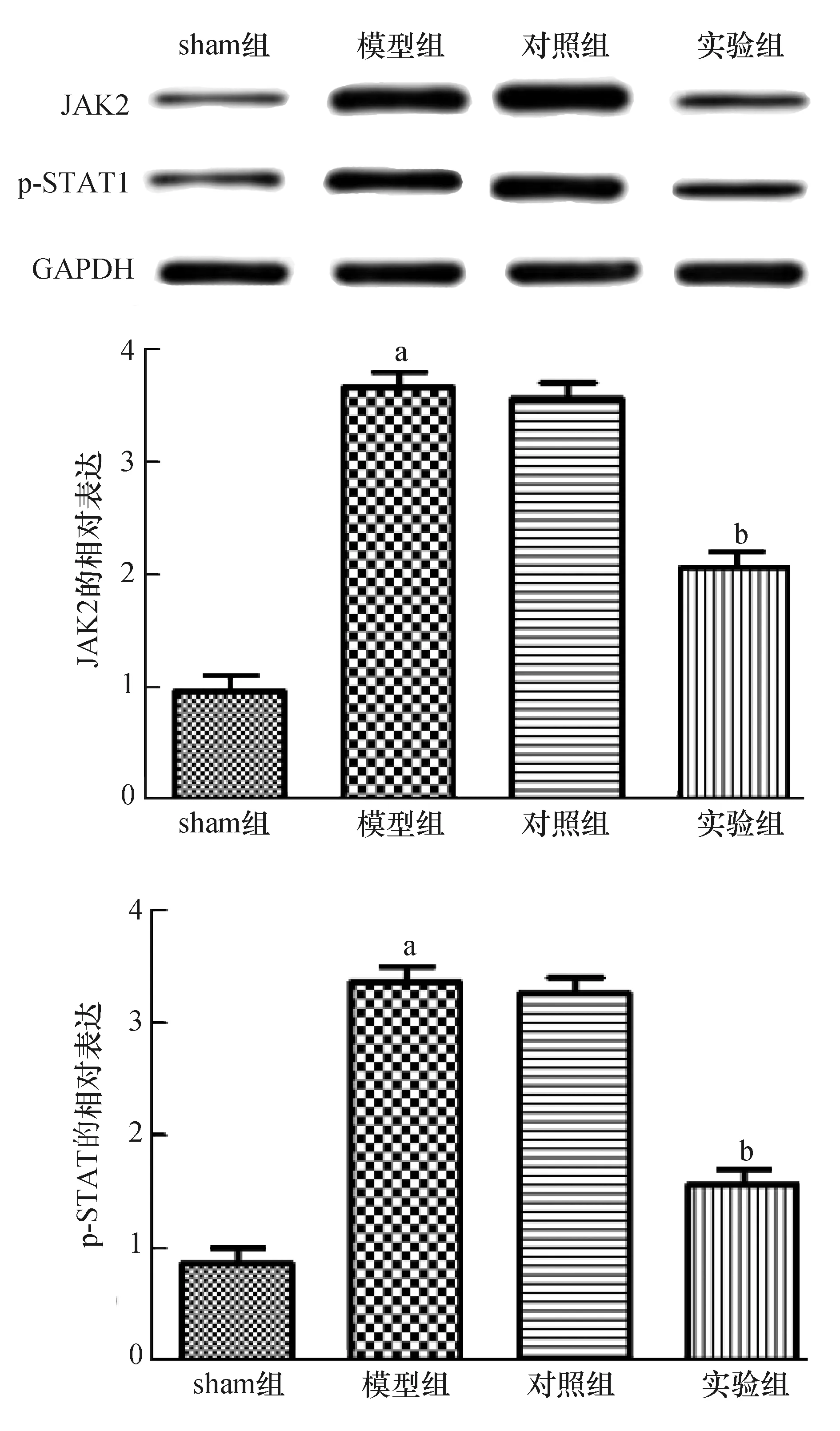
A:sham组;B:模型组;C:对照组;D:实验组;与sham组比较,aP<0.05;与模型组比较,bP<0.05
2.7 qRT-PCR检测各组标本中miR-146a和STAT1蛋白的mRNA表达
qRT-PCR检测各组标本中miR-146a和STAT1的mRNA表达水平如图7所示,与sham 组比较,模型组miR-146a的表达水平明显降低,而STAT1的mRNA表达水平明显升高(均为P<0.05);转染miR-146a-mimics后,与模型组相比,实验组miR-146a的表达水平明显升高,而STAT1的mRNA表达水平明显降低(均为P<0.05);模型组与对照组比较,差异无统计学意义(P>0.05)。

A:sham组;B:模型组;C:对照组;D:实验组;与sham组比较,aP<0.05;与模型组比较,bP<0.05
2.8 荧光素酶报告基因分析
miR-146a与STAT1蛋白和mRNA的表达的变化趋势存在一定的负向关系,在生物信息网站(www.microrna.org)上查询miR-146a(3’ uuggguaccuu-AAGUCAAGAG-u 5’)和STAT1(5’ acaauuauuuu-UACAGUUCUC-c 3’)存在结合位点。采用双荧光素酶报告基因分析来观察二者的关系结果如图8所示,转染miR-146a后,野生型STAT1的荧光素酶活性被抑制(P<0.05),突变型STAT1的荧光素酶活性无明显变化(P>0.05),表明miR-146a与STAT1具有靶向调控关系。
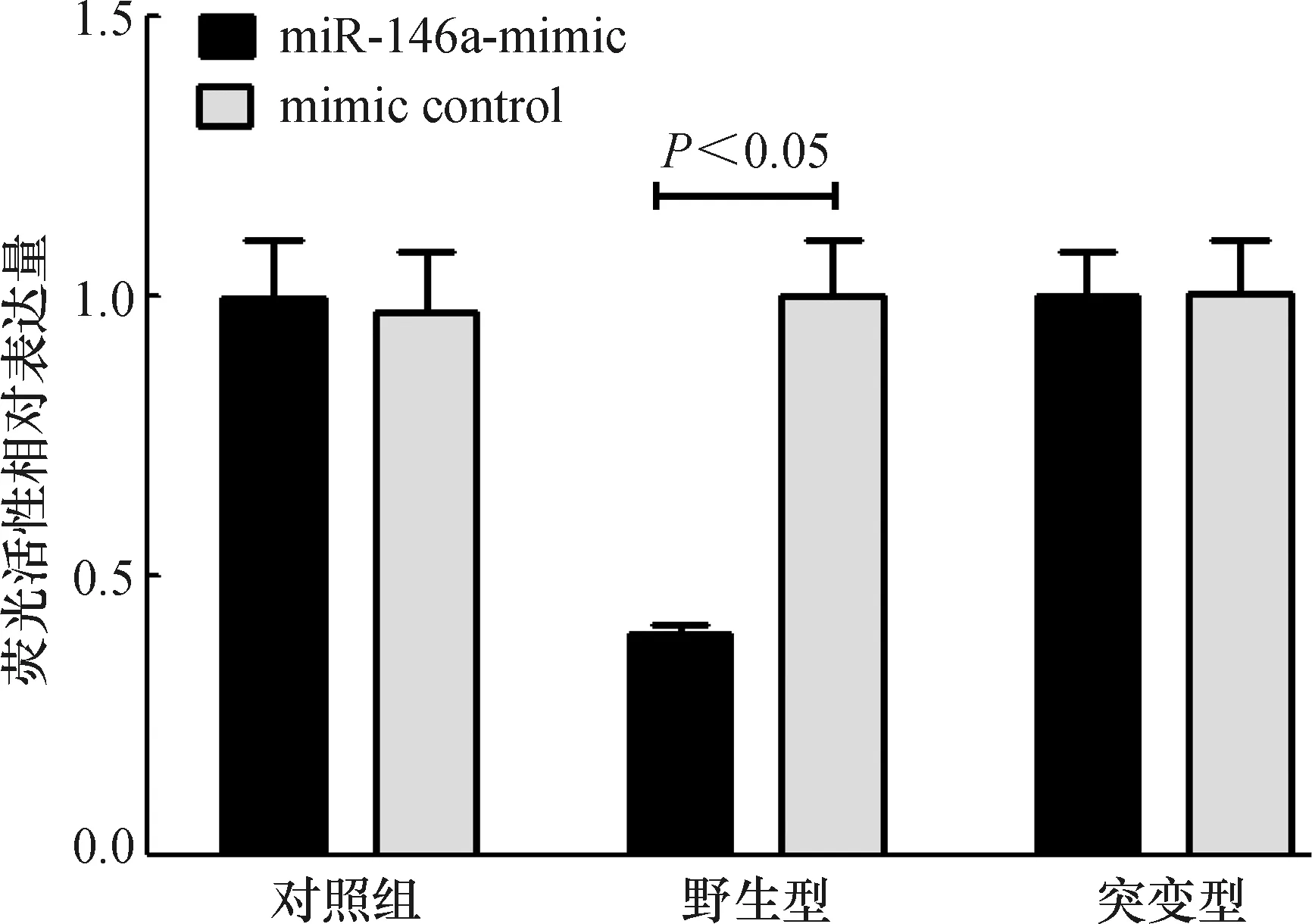
图8 双荧光素酶报告基因检测结果(n=10)
3 讨论
CAS是一种颈动脉壁的具有潜在致死性的炎症疾病,是机体全身动脉硬化的重要部分,血管内皮损伤是其基础病理改变。CAS的病因尚未完全阐明,年龄、肥胖、高血压、高血脂、糖尿病、遗传、生活方式等均可导致CAS的发生[11]。目前临床上治疗CAS主要通过外科手段如置入颈动脉血管成形支架手术、颈动脉粥样斑块切除手术及经皮腔内动脉成形术等来干预CAS的进程[12]。但这些治疗手段均对颈总动脉的血管内皮细胞带来二次损伤,使病灶位置出现动脉狭窄等严重病变[13]。因此,开展针对CAS的靶向治疗的研究在临床上具有重大研究意义。
绝大多数针对CAS的靶向治疗的研究处于实验室阶段。研究证实,miRNA不仅在CAS的细胞增殖与凋亡、自噬与分化中扮演重要角色,还可作为调控因子影响CAS的各个阶段,如内皮细胞功能障碍、血管平滑肌细胞的表型转换等[14]。Magenta等[15]研究发现,miR-200c在CAS的诊断中具有特异性。黄楦槟等[16]研究表明,过表达的miR-21直接推动CAS的发生、发展及恶性转化。miR-146a是定位在5号染色体上的具有免疫调控功能的小分子RNA[17]。研究表明,在如类风湿性关节炎、脓毒症等疾病中miR-146a能直接作用于炎症因子受体负调控炎症和免疫反应,抑制免疫过度,发挥细胞保护作用[18]。近来研究表明,miR-146a与血管的生物性能关系密切。Li等[19]研究表明,在单核细胞和巨噬细胞中增强miR-146a的表达,能明显增强内皮细胞的抗炎症反应。Wu等[20]研究证实,miR-146a通过调控核因子κB的表达来参与冠心病大鼠血管平滑肌的凋亡。Fang等[21]则证实,miR-146a联合内皮干细胞作用减少急性冠心病动物模型的细胞凋亡。Shen等[22]报道,在颈动脉球囊损伤的动物模型中miR-146a的表达异常。本研究构建CAS动物模型后,提取组织标本颈内动脉内皮细胞,研究结果表明过表达miR-146a能明显提高内皮细胞的增殖、迁移能力以及血管生成能力,明显降低了内皮细胞的凋亡率。这与之前的研究结果一致。
JAK/STAT信号通路能将细胞膜感受到的信号直接传导进细胞核内,瞬间激活靶基因的转录,直接参与调控细胞的增殖、分化、转移、凋亡等生理活动[23]。STATs是JAKs激酶的底物,在细胞受到刺激(如损伤、高氧、高糖等因素)磷酸化后能直接与DNA结合,瞬时将酪氨酸信号耦联放大,发挥转录调控作用。研究表明,p-STAT1在白细胞相关抗原、协同刺激因子、趋化因子等炎症基因的调控中发挥关键作用,促进炎症反应的发生发展[24]。葛会生等[25]研究证实,激活JAK2/STAT1通路严重损伤内皮细胞的生物学功能。本研究中qRT-PCR和Western blot结果表明,在CAS模型组中STAT1的mRNA和p-STAT1表达升高,STAT1信号被激活,内皮损伤明显。通过生物信息网站预测miR-146a与STAT1存在靶向结合位点,荧光素酶报告基因分析证实miR-146a靶向调控STAT1的表达,Western blot结果表明过表达miR-146a后,p-STAT1的表达明显下降。表明miR-146a通过靶向调控STAT1的表达,来保护CAS中内皮细胞的生物学功能。
综上所述,本实验证实了miR-146a和STAT1在颈动脉粥样硬化中存在表达异常的现象,过表达miR-146a,能够抑制STAT1的表达,发挥其保护颈动脉内皮细胞的功能。但miR-146a是否还通过其他信号通路影响颈动脉粥样硬化还需进一步的研究。本研究中对从颈动脉粥样硬化大白兔模型的颈内动脉分离出的血管内皮细胞进行了一系列的细胞实验,获得了较为明显的实验结果,但在体内实验中miR-146a的靶向作用能否缓解动物的动脉粥样硬化症状仍需深入考量。
利益冲突:无
