长链非编码RNA在动脉粥样硬化中的研究进展
2020-10-11孙琪田进伟刘跃光
孙琪 田进伟 刘跃光
157011 牡丹江医学院(孙琪、刘跃光);150001 哈尔滨医科大学附属第二医院心内科(田进伟)
动脉粥样硬化(atherosclerosis,AS)是心血管系统常见的慢性血管炎症疾病,其会导致动脉壁硬化和增厚,以及包含免疫细胞、间充质细胞和脂质等的斑块形成,一旦不稳定的AS斑块发生破裂,将会导致血栓形成和血流中断。AS也是许多心脑血管疾病的病理基础,如脑卒中、心肌梗死等,极度危害人类健康。虽然药物及介入等的进展使AS得到了一定程度的治疗,但AS所引起的心脑血管疾病仍未减少。因此,深入探讨AS的发病机制,找寻新的治疗靶点以改善AS显得尤为迫切。近年研究发现,长链非编码RNA(long non-coding RNA,lncRNA)可以通过影响血管内皮细胞功能、平滑肌细胞增殖与迁移、炎症反应和脂质代谢等过程来影响AS的发生、发展及预后。因此,本文就目前lncRNA在AS病程中的研究进展进行综述。
1 lncRNA的定义、分类和功能
LncRNA被广泛定义为长度超过200个核苷酸,并且不编码蛋白质的线性RNA。经过RNA聚合酶Ⅱ的作用,在转录后剪接5’帽和3’多聚A尾,形成完整成熟的lncRNA分子结构。
近年来随着高通量测序技术的发展,在癌症和其他包括心血管疾病中发现,lncRNA是基因转录过程中的重要调节因子[1-2]。在NONCODE数据库(version 4.0;http://www.noncode.org)中显示,人类和小鼠分别有145 331种和74 963种lncRNA。然而,数据库中所有lncRNA是否都具有生物学功能仍然不清楚,正待研究。
基于lncRNA与附近蛋白质编码基因之间的相关性,可将其粗略地分为以下4类:(1)同义,通过共享相同的启动子来重叠蛋白质编码基因;(2)反义,位于蛋白质编码基因的反义方向(相反的链);(3)内含子,由蛋白质编码基因的内含子产生;(4)基因间,也称为基因间的长链非编码RNA(long intergenic non-coding RNA,lincRNA),位于两个蛋白质编码基因之间[3](图1)。

lncRNA:长链非编码RNA;由上到下依次为同义lncRNA、反义lncRNA、内含子lncRNA和基因间lncRNA(即lincRNA),黄色箭头表示编码基因
此外,基于lncRNA在生理和病理状态中的功能作用也可分为以下6类:(1)作为微小RNA(microRNA,miRNA)的宿主基因;(2)作为miRNA海绵;(3)作为共同激活剂或共同抑制剂;(4)作为转录因子或RNAPⅡ的诱饵;(5)与染色质修饰复合物的募集和相互作用;(6)与组蛋白修饰相互作用[4-5]。
2 lncRNA与AS
AS的进展通常伴随着内膜的过度纤维化、炎症反应的级联、脂质斑块的形成。研究表明,lncRNA在内皮细胞功能障碍、平滑肌细胞增殖与迁移、单核细胞/巨噬细胞及炎症反应、脂质代谢等方面影响AS。
2.1 lncRNA对内皮细胞功能的影响
由内皮细胞损伤导致的内皮细胞功能障碍,代表着AS发生和发展的早期阶段。其中,受损的内皮细胞会引起粘附蛋白的积累与渗透性的增加,从而刺激白细胞迁移到血管壁中。病理性血管生成通常由细胞增殖、细胞迁移、免疫或炎症反应引起,在AS中起着关键作用[6]。以往研究表明,lncRNA可以调节内皮细胞功能。
肺腺癌转移相关转录本1(metastasis-associated lung adenocarcinoma transcript 1,MALAT-1)是一类可以调节CXC趋化因子受体2的lncRNA。Cremer等[7]研究发现,从ApoE-/-MALAT-1-/-小鼠分离的髓样细胞显示,髓样细胞对AS的血管内皮细胞的粘附力增强,且促炎介质的水平升高。研究显示,MALAT-1的抗炎作用部分归因于miR-503的减少。此外,Li等[8]利用氧化低密度脂蛋白(oxidized low-density lipoprotein,ox-LDL)刺激人脐静脉内皮细胞,发现ox-LDL通过激活lncRNA MALAT-1依赖性Wnt/β-catenin信号通路可诱导病理性内皮细胞间质化;在另一项研究中发现,lncRNA HOXA末端转录本反义RNA(HOXA distal transcript antisense RNA,HOTTIP)也可通过该通路促进内皮细胞的增殖与迁移[9]。LncRNA在血管内皮细胞内也能经由竞争性内源性RNA调控机制行使功能[10]。Song等[11]研究显示,lncRNA MALAT-1通过竞争性结合miR-22影响NOD样受体蛋白3的表达,从而促进高葡萄糖诱导的人内皮细胞焦亡,这可能为治疗AS提供了新的靶点。还有研究发现,在人冠状动脉内皮细胞中,lncRNA MALAT-1可通过竞争性结合miR-155来抑制炎症细胞因子的释放和细胞凋亡,从而上调细胞因子信号转导抑制因子1(suppressor of cytokine signaling 1,SOCS1)水平,进而抑制JAK-STAT通路[12],因此,调节MALAT-1/miR-155/SOCS1轴可缓解AS持续存在的炎症。综上,MALAT-1作为可以缓解AS炎症的lncRNA,有望成为治疗的新靶点。
研究发现,lncRNA母系表达基因3(maternally expressed gene 3,MEG3)在多种肿瘤中均下调,然而其在AS中的作用仍然未知。Wu等[13]研究发现,过表达MEG3可通过竞争性内源性RNA机制抑制内皮细胞中miR-21的表达,并上调miR-21的直接靶基因Ras同源物基因家族成员B(Ras homolog gene family member B,RhoB)和第10号染色体缺失的磷酸酶及张力蛋白同源基因(phosphatase and tensin homolog deleted on chromosome ten,PTEN)的表达水平,从而抑制内皮细胞的增殖和迁移。在另一项研究中提到,lncRNA MEG3可通过序列互补作用结合miR-223,以抑制miR-223的功能并上调NOD样受体蛋白3表达,进而促进人类主动脉内皮细胞焦亡[14],而其中细胞焦亡在AS中发挥着重要的作用。
还有研究发现,在AS斑块内部存在病理性的新生血管[15],在此过程中,因免疫细胞介导细胞因子的持续存在,导致持续合成内皮细胞,使得病理性新生血管的脆性大、渗透性高、稳定性差,因此新生血管极易破裂出血,从而增加了AS斑块内出血的风险。Leisegang等[16]研究发现,核定位的lncRNA MANTIS是一种能够促进内皮血管生成功能的差异调节的新型lncRNA。Zhu等[17]研究发现,被肿瘤生长因子β活化的lncRNA(lncRNA activated by tumor growth factor‐β,lncRNA-ATB)可通过内源性海绵作用靶向作用于miR-195,激活PI3K/AKT和MEK/ERK通路,从而增强人微血管内皮细胞的活性、迁移与管形成,以及上调血管内皮生长因子。另外Yin等[18]发现,沉默lncRNA 尿路上皮癌胚抗原1(urothelial carcinoma associated 1,UCA1)上调miR-195,在很大程度上抑制了人微血管内皮细胞的生长和管形成。而上调的miR-195反过来使MEK/ERK和mTOR信号通路失活,并最终抑制周期蛋白D1表达。
2.2 lncRNA对平滑肌细胞增殖与迁移的影响
血管平滑肌细胞的增殖和凋亡之间的平衡在AS病程发展中起重要作用。在AS形成的初始阶段,血管平滑肌细胞异常增殖并迁移至内膜积聚,导致内膜增厚,促进AS斑块形成;且在AS病程中,血管平滑肌细胞会从收缩型转变为增殖型并迁移进入内膜,导致AS斑块不稳定与新生内膜增生等血管病变。
细胞周期激酶抑制因子4(INK4)基因座中反义非编码RNA(antisense non-coding RNA in the INK4 locus,ANRIL)是一种新发现的lncRNA,位于染色体9p21,是与心血管疾病关联最强的遗传易感基因位点。全基因组关联分析已将该基因位点的单核苷酸多态性与心血管疾病及其他疾病(如糖尿病和癌症)联系起来。然而,这种lncRNA在AS进展中的作用仍然知之甚少。Congrains等[19-20]研究发现,在人主动脉平滑肌细胞中,9p21基因座中的几个与心血管疾病相关的单核苷酸多态性会影响ANRIL的表达,且ANRIL的剪接体通过细胞周期蛋白依赖性激酶抑制剂2A和2B调节细胞增殖、凋亡、细胞外基质的重构和炎症反应的基因表达,最终影响心血管等疾病的风险。
在另一项研究中发现,高脂喂养ApoE-/-小鼠斑块中lincRNA-p21显著下调,且发现在平滑肌细胞和单核巨噬细胞中,lincRNA-p21可促进二者凋亡、抑制增殖[21];研究其机制显示,lincRNA-p21通过p53通路调控平滑肌细胞增殖,可直接与小鼠双微体2结合,抑制其对p53的降解作用,同时也促进p300乙酰化激活p53,上调p53的活性[21]。另一项关于p53通路的研究发现,采用ox-LDL处理人动脉血管平滑肌细胞后,MEG3的表达量下调,从而上调细胞周期相关蛋白表达,促进细胞增殖与迁移,抑制凋亡;此外,用黄芩苷处理后逆转了这些影响,并激活了p53信号通路且促进p53从胞质到胞核的表达与转运[22]。Bai等[23]研究发现,lncRNA MEG3也可通过竞争性结合miR-26a,进而影响Smad1表达,调节AS中血管平滑肌细胞的增殖/凋亡平衡。
Bell等[24]通过对人冠状动脉平滑肌细胞进行RNA测序发现了31个未被注释的lncRNA,包括血管细胞富集到的lncRNA,我们称为平滑肌和内皮细胞富集的迁移/分化相关的长链非编码RNA(smooth muscle and endothelial cell enriched migration/differentiation-associated long non-coding RNA,SENCR),敲低SENCR后发现,心肌素以及许多平滑肌收缩相关基因表达量降低,促迁移基因表达量上调,SENCR似乎可稳定平滑肌细胞的收缩表型。Zou等[25]研究发现,当上调叉头框转录因子O1(forkhead box O1,FOXO1)和瞬时受体电位阳离子通道蛋白6(transient receptor potential cation channel 6,TRPC6)表达时,SENCR表达量下调,从而促进db/db小鼠平滑肌细胞的增殖和迁移。
2.3 lncRNA对单核细胞/巨噬细胞及炎症反应的影响
普遍认为,AS的本质是脂质诱导的慢性炎症反应,其中ox-LDL表达升高是AS的主要风险因素之一,ox-LDL活化后内皮细胞粘附力增强,粘附单核细胞并迁移至内膜,分化成巨噬细胞,诱导AS病变发生。
Wang等[26]的研究表明,在人髓系白血病单核细胞(THP-1)中,敲低核富集转录体1(nuclear paraspeckle assembly transcript 1,NEAT1)显著抑制了白细胞介素(interleukin,IL)-6和-1β、肿瘤坏死因子α等蛋白的翻译水平;经生物信息学预测发现,miR-342-3p为NEAT1的下游靶标,过表达miR-342-3p可极大地抑制THP-1细胞中的炎症反应,提示我们可通过调节人巨噬细胞的miR-342-3p来阻遏NEAT1,进而控制炎症反应。Chen等[27]同样揭示了在Raw264.7细胞系中,敲低NEAT1通过竞争性结合miR-128,抑制了泡沫细胞形成,同时还抑制了活性氧和丙二醛的表达水平,提高了细胞中超氧化物歧化酶的活性。综上,NEAT1的促AS作用应引起人们的重视,以为治疗AS提供一种策略。
有研究者将健康人与AS患者相比,发现健康人的血液样本中的H19表达量较AS患者低;采用ox-LDL刺激巨噬细胞系Raw264.7,可检测到H19的表达上调,敲低H19后促炎因子(肿瘤坏死因子α、IL-1β)表达量下调,并上调了抗炎因子(IL-4、IL-10)的水平[28]。另有学者指出,在Raw264.7细胞系中,H19可以通过作为let-7a microRNA的竞争性内源RNA,诱导其下游基因IL-6的转录[29]。提示H19作为促AS因子,很有可能成为治疗AS的新靶点。
Hu等[30]研究发现,在THP-1巨噬细胞衍生的泡沫细胞中,lncRNA RP5-833A20.1可通过序列互补作用竞争性结合hsa-miR-382-5p,降低核因子IA的表达,进而减少IL-1β、IL-6、肿瘤坏死因子α等炎症细胞因子的循环。此外,MALAT1和MEG3也参与了ox-LDL诱导的巨噬细胞的炎症反应[31-32](图2)。
2.4 lncRNA对脂质代谢的影响
脂质代谢异常也是AS的重要危险因素之一,已报道的lncRNA也在AS脂质代谢中起关键作用。研究发现,在ApoE-/-小鼠中THP-1巨噬细胞衍生的泡沫细胞中,ox-LDL能够使lincRNA-DYNLRB2-2的表达水平显著升高,并通过胰高血糖素样肽1受体信号通路上调G蛋白偶联受体119(G protein-coupled receptor 119,GPR119)和三磷酸腺苷结合盒转运体A1(adenosine triphosphate binding cassette transporter A1,ABCA1)的表达,促进泡沫细胞中的胆固醇流出。另外也有研究显示,lincRNA-DYNLRB2-2还可通过下调巨噬细胞中Toll样受体2的表达,促进胆固醇外流[33]。同样,Li等[34]研究发现,在斑块组织和THP-1巨噬细胞衍生的泡沫细胞中,lncRNA细胞周期蛋白依赖性激酶抑制剂2B反义RNA1(cyclin-dependent kinase inhibitor 2B antisense RNA 1,CDKN2B-AS1)可与DNA甲基转移酶1(DNA methyltransferase 1,DNMT1)结合,进而增强解整合素金属蛋白酶10(a disintegrin and metalloprotease 10,ADAM10)启动子的甲基化,从而减少脂质的积累并促进胆固醇的外流。
另外,Cai等[35]研究表明,在血管平滑肌细胞中lncRNA ENST00000602558.1通过与p56结合来调节三磷酸腺苷结合盒转运体G1(adenosine triphosphate binding cassette transporter G1,ABCG1)的表达水平,在介导胆固醇从血管平滑肌细胞外流至高密度脂蛋白中起关键作用。此外,也有研究显示,lncRNA NEAT1可通过调节THP-1细胞中miR-342-3p的表达来阻断NEAT1,进而抑制细胞中脂质的摄取[26]。揭示lncRNA可能为治疗AS提供了一种有效的策略。
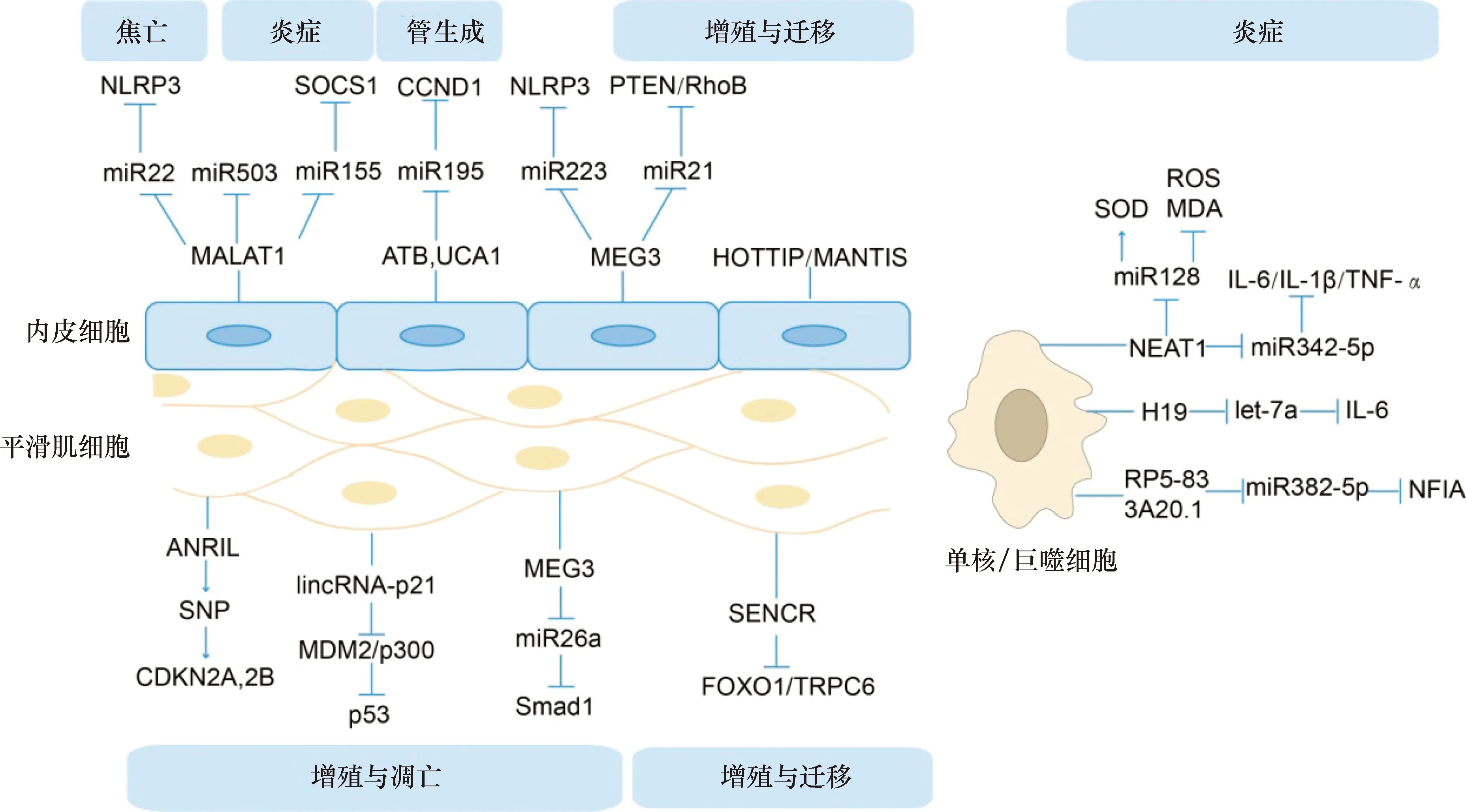
NLRP3:NOD样受体蛋白3;SOCS1:细胞因子信号转导抑制因子1;CCND1:周期蛋白D1;PTEN:第10号染色体缺失的磷酸酶及张力蛋白同源基因;RhoB:Ras同源物基因家族成员B;miR:微小RNA;MALAT1:肺腺癌转移相关转录本1;ATB:被肿瘤生长因子β活化的lncRNA;UCA1:尿路上皮癌胚抗原1;MEG3:母系表达基因3;HOTTIP:lncRNA HOXA末端转录本反义RNA;ANRIL:细胞周期激酶抑制因子4(INK4)基因座中反义非编码RNA;SNP:单核苷酸多态;CDKN2A,2B:细胞周期蛋白依赖性激酶抑制剂2A和2B;MDM2:小鼠双微体2;SENCER:平滑肌和内皮细胞富集的迁移/分化相关的长链非编码RNA;FOXO1: 叉头框转录因子O1;TRPC6:瞬时受体电位阳离子通道蛋白6;SOD:超氧化物歧化酶;ROS:活性氧;MDA:丙二醛;IL:白细胞介素;TNF-α:肿瘤坏死因子α;NEAT1:核富集转录体1;NFIA:核因子IA;与AS相关的lncRNA通路,焦亡、管生成表示该通路通过影响内皮细胞焦亡与微血管的生成进而影响AS的发生与发展
3 小结
人类大多数的基因都可转录为RNA,然而只有一小部分可翻译成蛋白质,从而发挥功能。从表面上来看,这些非编码RNA似乎没有功能,但实际上研究发现,非编码RNA在各个方面都调控着基因的表达。非编码RNA主要成员有lncRNA、miRNA、circRNA等,其中lncRNA与AS的关系逐渐成为近年研究热点。如文中MALAT1、ATB、UCA1、MEG3等lncRNA影响了内皮细胞的增殖与迁移、焦亡、炎症等功能;ANRIL、lincRNA-p21、SENCR等lncRNA调控平滑肌细胞的增殖、凋亡与迁移;lncRNA在巨噬细胞中的主要作用为引发炎症等。然而随着越来越多的lncRNA被发现以及lncRNA的靶点众多,人们对于AS相关lncRNA及其机制的研究还不全面,亟待人们去探索发现。
利益冲突:无
