Let-7f靶向抑制A20表达在血管内皮细胞炎症反应中的作用研究
2020-10-11侯江厚姚颖杰詹晓燕杨奕梅
侯江厚 姚颖杰 詹晓燕 杨奕梅
650031 昆明市妇幼保健院产科
动脉粥样硬化(atherosclerosis,AS)是一种慢性多因素导致的炎症性疾病,在世界范围内具有很高的发病率和致死率,其病理过程起始于血管内皮损伤,继而引起淋巴细胞浸润、血管平滑肌细胞增殖和泡沫细胞形成,最终导致动脉粥样斑块形成[1]。AS的危险因素包括高血压、高血脂、糖尿病、吸烟、高同型半胱氨酸和感染等,在各独立危险因素中脂代谢异常是首要因素,尤其是氧化低密度脂蛋白(oxidized low-density lipoprotein,ox-LDL)是AS的主要危险因子[2]。ox-LDL可以从多方面、多途径损伤血管内皮细胞,诱导血管内皮细胞凋亡,影响内皮细胞通透性、分泌调节及炎症反应并导致内皮细胞功能障碍[3-4]。
研究发现,微小RNA(microRNA,miRNA)在AS的发生发展过程中具有重要作用[5-7],其中let-7在血管内皮细胞和平滑肌细胞中大量存在,能够通过调控目标靶基因的表达引起血管内皮细胞凋亡和平滑肌细胞增殖、迁移[8-9]。同时,核因子κB(nuclear factor kappa-B,NF-κB)参与了AS发生过程中多种相关基因表达的调控[10-11]。NF-κB信号转导途径活化是ox-LDL作用于内皮细胞促使细胞间粘附分子1(intercellular adhesion molecule-1,ICAM-l)、肿瘤坏死因子α(tumor necrosis factor α,TNF-α)、白细胞介素6(interleukin 6,IL-6)等炎症细胞因子和细胞粘附分子表达的重要调控通路,是参与AS发病过程的重要分子机制之一[12]。近年来的研究发现,TNF-α诱导蛋白3(TNF-α induced protein 3,TNFAIP3),亦称锌指蛋白A20,能够通过其双重的泛素化酶活性,作用于IKK复合体信号通路上游的关键分子,如RIP1、TRAF6等,阻止IKK被磷酸化,抑制NF-κB的进一步活化,发挥反馈性调节作用,抑制炎症反应[13]。另有研究发现,let-7f通过靶向抑制A20表达,活化NF-κB信号通路,释放TNF、IL-1b等细胞因子,在结核杆菌感染巨噬细胞的免疫反应中发挥重要调控作用[14]。因此,我们推测,ox-LDL可能通过上调let-7f抑制其靶基因A20的表达,使IKK被磷酸化,并导致NF-κB通路活化,从而引起血管内皮细胞炎症反应。本研究拟选取let-7家族的重要成员let-7f作为研究对象,通过建立ox-LDL诱导血管内皮细胞炎症反应模型,观察let-7f在ox-LDL所致血管内皮细胞炎症反应过程中的变化规律,探讨let-7f调控血管内皮细胞炎症因子表达的分子机制。
1 材料与方法
1.1 实验材料
原代人脐静脉内皮细胞(human umbilical vein endothelial cells,HUVEC)、HEK293细胞购自美国Science Cell公司;胎牛血清(FBS)、RPMI1640培养基、0.25%胰蛋白酶购自美国GIBCO公司;ox-LDL购自协和医科大学基础医学研究所(MDA含量:22 nmol/L,4℃避光保存,2周适用);人ICAM-1 ELISA检测试剂盒购自美国RapidBio Lab公司;细胞核蛋白提取试剂盒购自上海碧云天公司;A20抗体、p-IKK抗体、NF-κB抗体、p-NF-κB抗体购自美国Santa Cruz公司,Lamin B1抗体、β-actin抗体、辣根过氧化物酶标记山羊抗兔IgG抗体购自武汉博士德公司;96孔酶标板购自美国Costar公司;总RNA提取试剂盒购自美国Qiagen公司,miRNA反转录试剂盒、点突变试剂盒、Dual LuciferaseReporter Assay System试剂盒购自美国Invitrogen公司,let-7f mimics、let-7f PCR 引物、U6引物、miRNA SYRB Green实时荧光定量试剂盒均购自美国Applied Biosystems公司。
1.2 实验方法
1.2.1 细胞培养和转染 冻存HUVEC复苏后,用含10%FBS、100 U/ml青霉素和100 g/L链霉素的DMEM接种于培养皿中,置于37℃、5%CO2、95%空气、饱和湿度培养箱中培养。细胞生长融合成致密单层,用0.25%的胰蛋白酶-EDTA消化,以1∶3传代,轻轻吹散后将细胞均匀接种于培养皿中,待细胞融合至50%,用Lipofectamine 2000试剂将let-7f mimics、miR-NC瞬时转染至HUVEC,6 h后更换新鲜培养基,继续培养48 h,收集细胞进行后续实验。
1.2.2 分组 实验分为正常对照组(未添加ox-LDL)、10 μg/ml ox-LDL组、20 μg/ml ox-LDL组、50 μg/ml ox-LDL组、100 μg/ml ox-LDL组和200 μg/ml ox-LDL组共 6组,细胞置于37℃、5%CO2、95%空气、饱和湿度培养箱中培养24 h后待用。
1.2.3 RNA的提取和实时荧光定量PCR 按试剂盒说明书提取各组HUVEC的总RNA,提取出的总RNA通过TaqMan miRNA反转录试剂盒合成单链cDNA,let-7f的表达水平采用TaqMan miRNA实时荧光定量PCR试剂盒检测,let-7f cDNA扩增引物购自Applied Biosystems,PCR条件:95℃ 5 min,95℃ 10 s,60℃ 30 s,72℃ 30 s,35个循环。Let-7f的相对表达量以U6作为内参,采用2-ΔΔCt方法计算,每个样品重复3次。
1.2.4 双抗体夹心ELISA方法检测细胞培养液ICAM-1含量 按试剂盒说明书进行测定。标准品用标本稀释液按一定比例稀释成系列标准液,将其与HUVEC培养液样品分别加入96孔酶标板内,并留出空白孔,封好后于37℃孵箱孵育90 min;经5次洗板,向空白孔外的其他反应孔加生物素化抗体工作液100 μl/孔,封板后37℃孵育60 min;再5次洗板,各孔与酶结合物工作液100 μl/孔37℃孵育30 min;洗板后加入显色剂A、B各50 μl/孔,37℃避光孵育15~25 min;最后加入终止液100 μl/孔,混匀后于5 min内测定OD450。标准品及样品的OD值系减去空白孔OD所得。
1.2.5 细胞核蛋白的制备 依据核蛋白提取试剂盒说明进行,将各组培养皿中的HUVEC用0.25%胰蛋白酶消化5 min,终止消化并吹打下来后,用冷PBS(1 mmol/L Na3VO4,5 mmol/L NaF)洗涤细胞2次;移入离心管管中,4℃离心300 g×5 min,弃上清;加入5 ml GENMED清理液,用移液管混匀细胞颗粒群,4℃离心300 g×5 min,弃上清;加入500 μl预冷的GENMED胞解液,混匀,移出细胞液到预冷的无菌Eppendorf管中,强力涡旋震荡15 s,放进冰槽里孵育15 min,其间强力涡旋震荡15 s一次;即刻4℃离心16 000 g×5 min,留取上清液制备胞浆总蛋白。沉淀加入500 μl预冷的GENMED清理液,4℃离心300 g×5 min,弃上清,重复两次;沉淀加入200 μl含有GENMED裂解液和GENMED活性液的GENMED裂解工作液,强力涡旋震荡15 s,放进冰槽里孵育60 min,其间每10 min强力涡旋震荡15 s一次;即刻4℃离心16 000 g×5 min,小心移取上清液到新的Eppendorf管中,分装后放进-70℃的冰箱里备用。
1.2.6 Western blot法检测细胞核中NF-κB含量的变化 采用BCA蛋白分析法测定提取好的HUVEC细胞核蛋白浓度,在各组样品中加入适量的SDS-PAGE缓冲液,80~100℃沸水浴5 min。将蛋白样品上样到SDS-PAGE胶加样孔,电泳电压100 V,30 min,溴酚蓝到达胶的底端附近停止电泳。采用Bio-Rad半干法转PVDF膜,电压25 V,60 min,转膜完毕后,PBST洗膜3次,5 min/次,5%脱脂奶粉封闭1 h后,PBST洗膜3次,5 min/次。NF-κB兔抗人单克隆抗体(1∶1 000),孵育过夜,PBST洗膜3次,5 min/次,HRP标记的羊抗兔IgG抗体(1∶10 000),孵育1 h后,PBST洗膜3次,5 min/次,显影。显影后的PVDF膜用0.2 mol/L NaOH振荡清洗后重新用Lamin B1兔抗人多克隆抗体检测,方法同上。
1.2.7 Western blot法检测细胞中A20、p-IKK、NF-κB和p-NF-κB的变化 收集HUVEC细胞并采用细胞裂解液裂解,BCA蛋白分析法测定细胞总蛋白浓度,一抗分别为A20抗体、p-IKK抗体、NF-κB抗体和p-NF-κB抗体(1∶1 000),内标为β-actin抗体,二抗为HRP标记的羊抗兔IgG抗体(1∶10 000),操作步骤同上。
1.2.8 双荧光素酶报告实验验证let-7f与A20的靶向关系 用Trizol提取细胞总RNA并逆转录为cDNA,PCR扩增A20基因3’-UTR片段,上游引物5’-ATACTAGTCCGGAAACAGGTGGGTCACCTC-3’,下游引物5’-ATACGCGTGTTGACTCTTGTGAAAAGTTACATT-3’,将A20 3’-UTR克隆至pmiReport载体中构建pmiReport-A20(WT)载体,利用点突变试剂盒突变pmiReport-A20(WT)上let-7f结合位点构建突变pmiReport-A20(mut)载体。将HEK293细胞以1×105/ml的密度接种于24孔板上,采用Lipofectamine 2000将报告载体分别与let-7f mimics、miR-NC共转染,转染24 h后,采用Dual Luciferase®Reporter Assay System试剂盒检测荧光素酶活性。
1.3 统计学方法
2 结果
2.1 ox-LDL对HUVEC细胞ICAM-1表达的影响
采用ELISA方法检测细胞培养液中ICAM-1含量,如图1所示,20 μg/ml ox-LDL作用24 h,可导致ICAM-1的含量较对照组显著升高[(9.71±0.42)ng/ml比(4.65±0.29)ng/ml],与对照组相比均有显著性差异(P<0.05),且随着ox-LDL作用剂量增加到100 μg/ml后,ICAM-1的含量逐渐增多,与对照组相比差异更为显著(P<0.01),提示ox-LDL作用浓度与ICAM-1的表达具有明显的剂量依赖性。
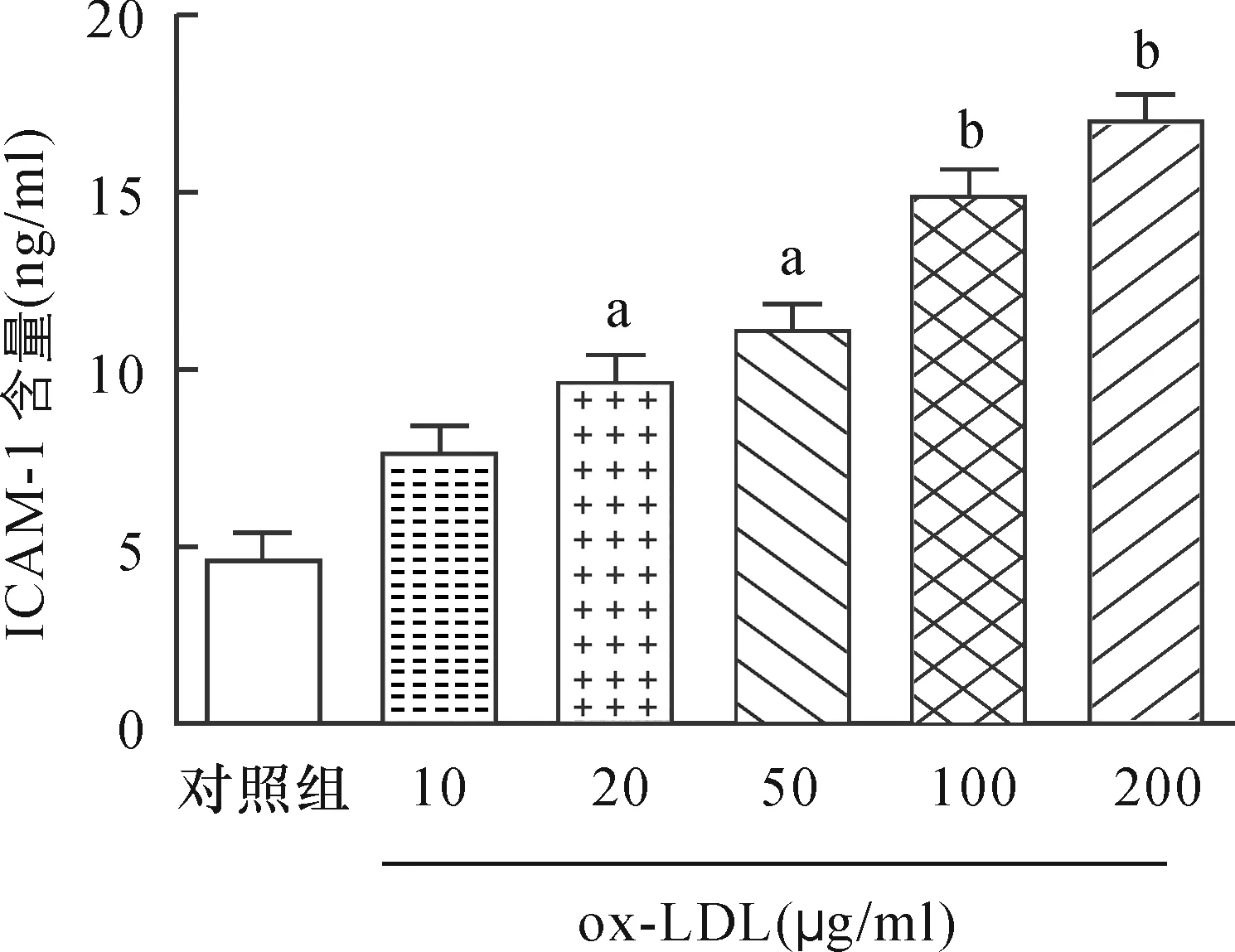
与对照组比,aP<0.05,bP<0.01(n=6)
2.2 ox-LDL对HUVEC细胞let-7f表达的影响
采用RT-qPCR方法检测HUVEC细胞中let-7f的表达,如图2所示,20 μg/ml ox-LDL作用24 h,可导致let-7f的相对表达量较对照组显著上调(0.20±0.02 比 0.12±0.01),与对照组相比有显著性差异(P<0.05),且随着ox-LDL作用剂量增加到100 μg/ml后,let-7f的表达逐渐增多,与对照组相比差异更为显著(P<0.01),提示ox-LDL作用浓度与let-7f的表达具有明显的剂量依赖性。

与对照组相比,aP<0.05,bP<0.01(n=6)
2.3 ox-LDL对HUVEC细胞核NF-κB蛋白含量的影响
采用Western blot检测HUVEC核内NF-κB蛋白的含量,如图3所示,10 μg/ml ox-LDL作用24 h,可导致HUVEC核内NF-κB蛋白增多,以不同剂量的ox-LDL(20、50、100、200 μg/ml)作用于HUVEC后,发现细胞核内NF-κB蛋白含量呈现逐渐增多的趋势,表明ox-LDL可导致HUVEC细胞的NF-κB向核内移位。
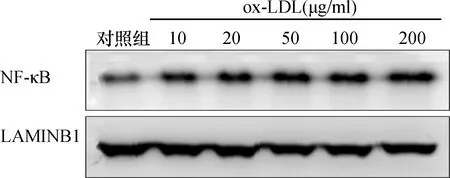
图3 不同剂量ox-LDL引起HUVEC核内NF-κB-P65蛋白含量的变化情况(n=3)
2.4 ox-LDL对HUVEC细胞A20表达及NF-κB通路的影响
采用100 μg/ml ox-LDL作用于HUVEC 24 h,Western blot检测细胞内A20、IKK、NF-κB和p-NF-κB的表达情况,如图4所示,ox-LDL可导致细胞内A20表达显著下调,同时IKK蛋白水平也明显降低,对NF-κB的表达无显著影响,但是NF-κB的磷酸化水平明显升高,表明ox-LDL可通过抑制HUVEC细胞A20的表达,引起IKK被磷酸化,导致NF-κB被磷酸化。
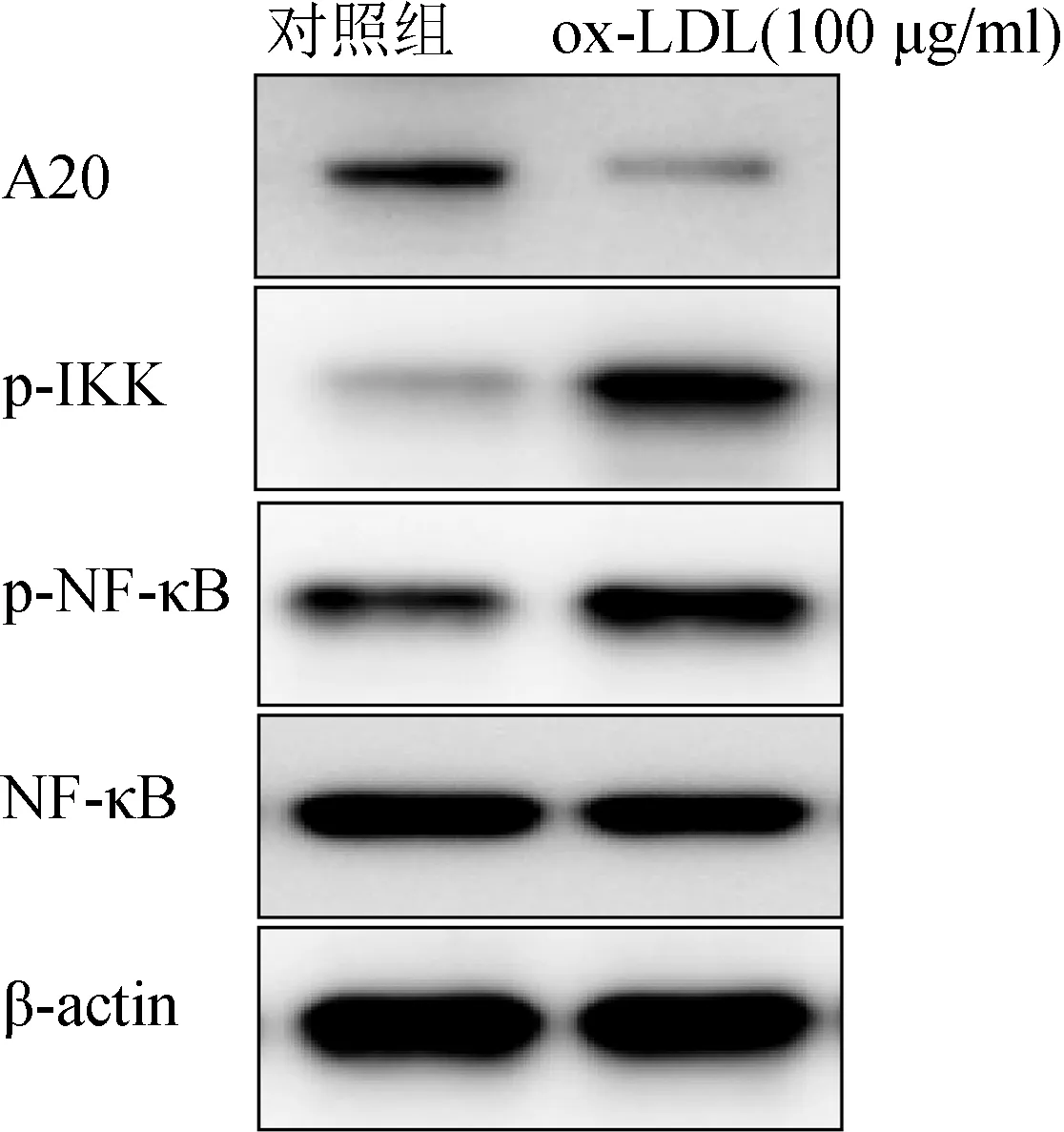
图4 ox-LDL作用于HUVEC细胞对A20及NF-κB通路相关蛋白的表达影响(n=3)
2.5 let-7f与A20基因3’-UTR靶向结合并抑制其表达
通过TargetScan数据库的搜索及预测,发现let-7f与A20具有靶向结合的序列,分组转染后通过双荧光素酶报告基因系统进行检测,发现在HEK293细胞中,pmiReport-A20(WT)载体与let-7f mimics共转染的细胞组相对荧光素酶活性较pmiReport-A20(WT)载体与miR-NC共转染的细胞组明显降低(P<0.05)。而pmiReport-A20(mut)载体与let-7f mimics共转染的细胞组相对荧光素酶活性较pmiReport-A20(mut)载体与miR-NC共转染的细胞组,差异无统计学意义。表明let-7f直接与A20基因3’-UTR靶向结合而发挥调节作用(图5A)。采用let-7f mimics、miR-NC分别转染HUVEC,Western blot检测细胞内A20的表达情况,结果显示,let-7f mimics细胞组A20的表达与对照组、miR-NC组相比明显降低,而miR-NC组与对照组相比无明显变化,表明let-7f能够通过靶向结合A20基因3’-UTR而抑制其表达(图5B)。
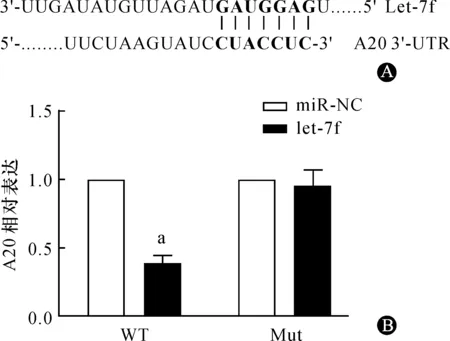
A:荧光素酶报告基因检测let-7f与A20基因3’-UTR的靶向结合;B:let-7f转染HUVEC细胞抑制A20的表达(n=3),与miR-NC组比较,aP<0.05(n=3)
3 讨论
Let-7家族的各miRNA是最早发现的一类miRNA,以let-7为起点,众多的miRNA相继被发现,目前已有数千种功能各异的miRNAs被证实,在人体的多种生理机能及病理过程中发挥着重要的作用[15]。目前研究表明,let-7家族成员与AS的发生发展具有密切关系[16]。ox-LDL可诱导血管内皮细胞凋亡过程中let-7c表达上调,let-7c靶向调节抗凋亡蛋白Bcl-xl的表达进而促进血管内皮细胞凋亡发生[8],提示let-7c是一种促AS因子。TLR4信号传导途径是调控致炎因子释放并参与冠心病发病过程的重要途径,有研究发现let-7i调控TLR4表达是冠心病发病的分子机制之一[17]。
对结核杆菌感染巨噬细胞的研究发现,let-7f能够通过活化NF-κB信号通路,促进TNF、IL-1b等细胞因子表达,诱导免疫炎症反应[14],提示let-7f可能通过调控炎症因子表达而参与AS起始过程。但是目前对let-7f在AS形成过程中的表达变化尚不清楚,let-7f参与AS形成的分子机制尚不明确。本研究结果显示,20 μg/ml ox-LDL作用于血管内皮细胞可引起ICAM-1表达明显升高;同时,let-7f的表达也明显增多;随着 ox-LDL作用剂量的增加,ICAM-1与 let-7f的表达均呈现逐渐增多的趋势,具有剂量效应关系,研究结果表明let-7f在ox-LDL致血管内皮细胞炎症反应中发挥重要作用。
NF-κB是哺乳动物细胞中最重要的核转录因子之一,其参与了炎症、细胞增殖、分化和凋亡等的调节。静息状态下,无活性的NF-κB以异源三聚体(P50、P65、IκB-α)形式存在于胞质中。但在许多因素诱导下,胞外刺激可通过多个信号传导途径激活蛋白激酶并使 IKK复合体被磷酸化,磷酸化的IKK复合体继而磷酸化降解IκB-α,使NF-κB二聚体(P50,P65)发生核易位,从而引起细胞因子、趋化因子、粘附分子和促凋亡基因等靶基因的表达[18],介导白细胞和血管内皮细胞的相互作用以及血管细胞的损伤。本研究中通过Western blot法检测血管内皮细胞核内NF-κB蛋白的表达水平,结果显示20 μg/ml ox-LDL作用于血管内皮细胞可引起NF-κB蛋白核内移位明显增多,随着ox-LDL作用剂量的增加呈现逐渐增多的趋势,与ox-LDL所致ICAM-1和 let-7f的表达变化规律一致,表明let-7f可通过调控NF-κB信号传导通路的活化介导ox-LDL引发的血管内皮细胞炎症反应。
已有研究发现,锌指蛋白A20能够阻止IKK被磷酸化,抑制NF-κB的活化,发挥抑制炎症反应作用[13]。我们的研究证实,let-7f能够与A20基因的3’-UTR靶向结合并抑制其表达,ox-LDL作用于血管内皮细胞能够明显抑制A20的表达,引起IKK被磷酸化,进一步使NF-κB磷酸化增多并向细胞核转移,NF-κB信号通路激活,从而诱导血管内皮细胞炎症因子的表达分泌,研究结果初步阐明了let-7f参与AS形成起始过程的分子机制。
综上所述,本研究发现ox-LDL诱导血管内皮细胞炎症反应过程中,let-7f表达规律与ICAM-1表达规律以及NF-κB向核内移位存在一致性,let-7f可通过靶向抑制A20基因的表达,促使IKK被磷酸化,并进一步激活NF-κB信号通路。通过控制let-7f的表达上调而抑制血管内皮细胞的炎症反应,可能为AS的防治提供新的靶点和方向。
利益冲突:无
