2019心电学研究新进展
2020-10-11夏雨余淼刘俊刘铮雷森贺嘉张浩陈尔佳方丕华
夏雨 余淼 刘俊 刘铮 雷森 贺嘉 张浩 陈尔佳 方丕华
100037 中国医学科学院 北京协和医学院 国家心血管病中心 阜外医院心律失常诊治中心(夏雨、余淼、刘俊、陈尔佳、方丕华);100020 首都医科大学附属北京朝阳医院心脏中心(刘铮);400016 重庆医科大学附属第一医院心内科(雷森);410011 长沙,中南大学湘雅二医院心内科(贺嘉);400013 重庆市人民医院心内科(张浩)
心电学是心血管病学的一个重要组成部分,心电学的研究涵盖了心脏病的许多领域,每年全球心电学领域都有大量的进展。我们通过系统检索过去一年全球顶尖的心血管病、心律失常和心电学相关杂志,筛选出心电学最密切相关的研究进展介绍给全国同仁,以促进心电学普及、发展和提高;提升疾病诊疗,改善患者预后;以期提高全民健康水平,助力实现全面小康。
1 直立倾斜试验中发生心房颤动:需长期随访
直立倾斜试验(head-up tilt test,HUT)是一种广泛应用于晕厥患者的有效评估工具。为了提高HUT的诊断率,常使用异丙肾上腺素(isoproterenol,ISO)进行激发。通常情况下,HUT检查时输注ISO耐受性良好,但可能增加快速心律失常的风险。其中,心房颤动(atrial fibrillation,AF)是常见的心律失常之一。Kim等[1]通过对6 780例[平均年龄(41.4±18.6)岁]接受HUT检查且既往无AF患者的研究发现,HUT检查过程中,AF的发生率为0.8%,发生AF患者的中位年龄为59岁。其中61.5%和28.9%的患者AF分别发生于ISO输注过程中和输注后的恢复期内,仅9.6%的患者在未输注ISO的情况下发生AF。该研究未观察到短期不良反应,且83%的患者48 h内自行转为窦性心律。在34.8个月的中位随访中,46%的患者出现AF复发,复发的患者中79.2%的患者进展为持续性或永久性AF。进一步分析发现,对于HUT过程中出现AF且持续时间大于1 h者,AF复发率更高、转化为持续性AF可能性更大且不良事件更多。
2 利用QRS电轴定位器质性室性心动过速——基于AHA的左室17节段模型
美国心脏协会(AHA)定义的左室17节段模型是心脏成像中使用的标准模型。基于此模型,Andreu等[2]提出了一种通过QRS电轴定位器质性左室室性心动过速(ventricular tachycardia,VT)的新流程。该流程法确定VT起源节段的2个步骤(图1):(1)首先确定肢体导联(正或负)中最高电压者,从而确定短轴切面节段。由于Ⅰ、Ⅱ或Ⅲ导联位于两组节段之间的边界,因此最高电压出现在其上时,需进一步分析其邻近的两个导联,邻近导联中电压较大者为其短轴切面所在节段;(2)再确定胸导联(V3/V4)的极性,从而确定长轴切面节段(一致性正向和负向分别表示基底和心尖起源;其他组合表示中间起源:V3-,V4+提示起源于中间间隔,V3+,V4-提示起源于中间左侧壁)。这一新流程可成功预测81.9%的VT出口,未能成功预测出口的VT中,77.8%的实际出口与预测出口相邻。游离壁靠下(无论靠心尖或心底)准确性最高,间隔中间部位准确性偏低。
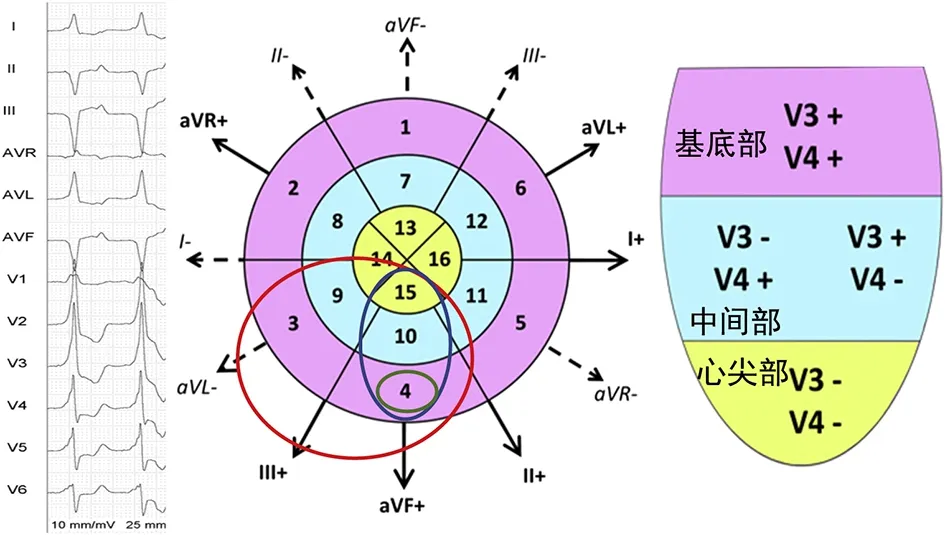
定位步骤:第1步:确定短轴切面所在节段:确定肢体导联(正或负)中最高电压者:Ⅲ-。由于Ⅲ-导联位于两组节段之间的边界,因此最高电压出现在其上时,需进一步分析其邻近的两个导联(aVF-和aVL+)(红色圆圈),邻近导联中电压较大者为aVF-。因此,短轴切面可能起源于节段4,10和15(蓝色圆圈);第2步:根据胸导联(V3/V4)的极性确定长轴切面所在节段:V3/V4为+/+,因此长轴切面上起源于基底部;第3步:结合短轴和长轴切面的起源节段,最终确定室速起源于节段4(绿色圆圈)
3 严重高钾血症的心电图表现
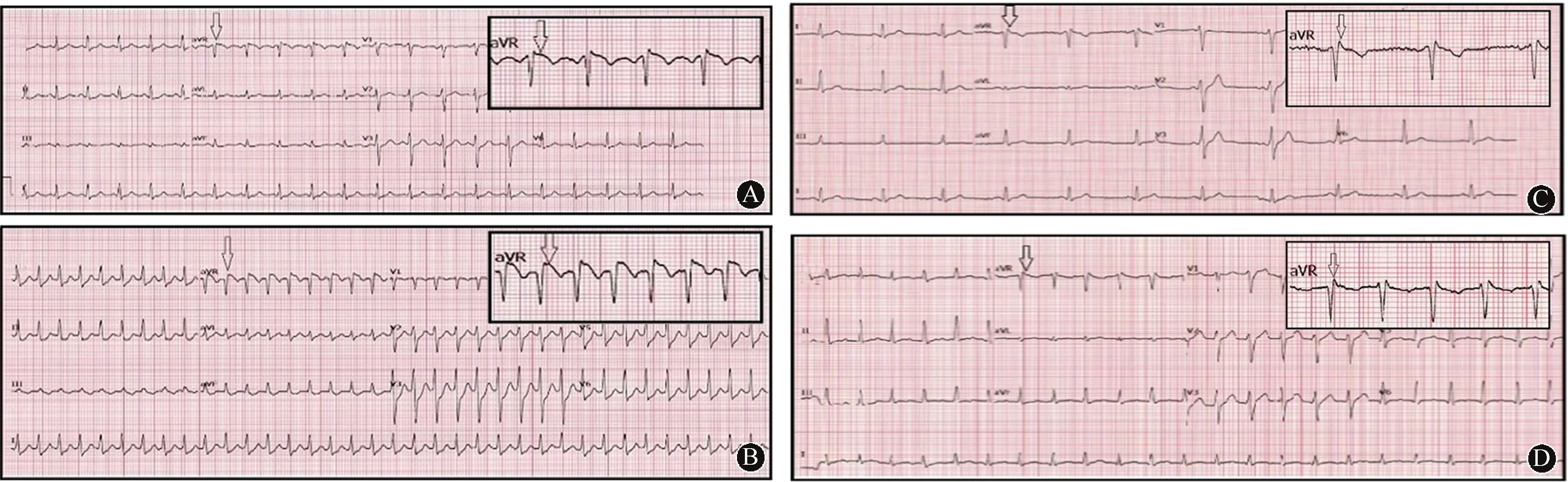
严重高钾血症可导致严重的心律失常、心脏骤停和(或)死亡,需要紧急干预。因其临床症状常与所伴发疾病相似,很容易被误认为是潜在疾病的简单恶化,从而耽误处理。在危重病患者中,心电图可作为鉴别潜在致命性高钾血症患者的最直接的诊断工具。以下心电图表现提示有可能出现严重的高钾血症,需要立即进行干预:(1)严重低血压伴有急性QRS增宽和电轴偏转(图2A、B);(2)低血压、休克伴V1、V2导联QRS波增宽及ST段抬高(图2A、B);(3)心电软件反复计算心率时的严重疾病(图2C、D);(4)存在宽QRS无脉电活动的急症患者(图2 C、D);(5)无法电转复的无脉的宽QRS心动过速(图2D);(6)双侧下肢麻痹或四肢轻瘫伴心电图明显异常[3]。
4 鉴别AVRT与AVNRT的新标准:联合aVR标准
2015年,美国心脏病学会/美国心脏协会/美国心律学会(ACC/AHA/HRS)成人室上性心动过速(supraventricular tachycardia,SVT)治疗指南将房室结折返性心动过速(atrioventricular nodal reentrant tachycardia,AVNRT)的经典心电图诊断标准(即V1导联中的伪r’波和下壁导联中的伪s波)纳入其中。然而,窦性心律时V1导联可能已存在r’波,因而AVNRT发生时通过判断有无r’波并不准确;并且,由于AVNRT发作时较紧急,进行心电图检查时通常未连接胸前导联。Demirtas等[4]提出,联合aVR标准来鉴别房室折返性心动过速(atrioventricular reentrant tachycardia,AVRT)与AVNRT。联合aVR标准被定义为:(1)窦性心律无r’波的患者在心动过速时aVR导联出现伪r’波(图3A、B),和(或)(2)r’波振幅较窦性心律下aVR导联r’波增加≥50%(图3C、D)。他们通过对480例经电生理检查确诊为AVNRT或AVRT的窄QRS的SVT患者研究发现,联合aVR标准诊断AVNRT的敏感度、特异度、阳性预测值和阴性预测值分别为84.1%、90.9%、96.9%和62.9%。

A:正常血钾的心电图;B:患者血钾明显升高,心电图出现PR延长、QRS波群增宽、电轴明显左偏和V1~V2导联中ST段抬高,与急性心肌梗死或Brugada综合征表型一致;C:患者出现心脏骤停,心电图表现为无脉电活动,具有明显宽大畸形的QRS波群,正弦波形态,电轴明显偏转,及心电软件重复计算心率;D:患者出现无脉宽心电波心动过速,反复电击及静脉注射胺碘酮均无效。除此之外,患者心电图存在电轴明显偏转,V1~V3导联ST段抬高,以及心电软件重复计算心率
5 维拉帕米敏感的特发性左束支心动过速的新认识
维拉帕米敏感的左束支单形室性心动过速(left fascicular ventricular tachycardia,LF-VT)最早约在40年前被描述。LF-VT是一种浦肯野纤维相关的,主要发生于心脏结构正常人群中的心律失常。左后分支室性心动过速(left posterior fascicular ventricular tachycardia,LPF-VT)是LF-VT中的最常见类型,其经常被误诊为SVT合并右束支传导阻滞和左前半分支阻滞,尤其是当出现夺获而未见融合波或房室分离时。近期,Michowitz等[5]报道了4条可能有助于鉴别LPF-VT的心电图标准(图4):(1)不典型V1形态(非rsR’,或R大于R’);(2)QRS宽度≤140 ms;(3)V6导联R/S比≤1;(4)aVR导联主波直立。其中,符合0~1条标准不支持VT,符合3~4条标准则支持VT的诊断。与后乳头肌VT的鉴别中,支持LPF-VT的诊断因素包括青年期初发和Ⅰ、aVL导联存在明确的Q波。LF-VT可以通过心房以及右室或左室刺激诱发。消融的靶点通常包括舒张期电位(P1)或最早的收缩期前电位(P2)。由于它是一个大折返环路,成功消融的靶点通常不止一个。然而,通常在间隔的中间到远端2/3处消融,以避免损坏左束支系统或房室结。此外,通过避免在具有明显浦肯野纤维网分支部位的远端消融,可增加消融成功的可能性。
6 心电图左心房异常预测心血管死亡率
心电图诊断左心房异常的临床应用因P波形态各异、经验性标准多且缺乏影像学“金标准”而受到限制。Ha等[6]首次对胸前导联(V1和V2导联)的P波形态进行分类,并确定与心血管死亡相关的形态。形态1:单个正向P波;形态2:单个负向P波;形态3:先正后负的复合P波(图5)。对于形态2和形态3,左心房异常定义为负向成分≤100 μV(图5)。P最大时限定义为:aVF、V1和V2导联中P波时限最大者(包括P和P’成分)。通过对接受心电图检查的20 827名年龄小于56岁的退伍军人回顾性分析发现,形态1、2和3的P波检出率在V1和V2导联中分别为29%比81%、4.6%比1.6%和64.5%比17.5%。形态2和3的负向成分≤100 μV与心血管死亡显著相关(校正HR=2.9~4.1,P<0.001)。总P波时限≥140 ms也与心血管死亡相关(校正HR=2.2,P<0.001)。
A为B中典型AVNRT经超速起搏转为窦性心律的体表心电图,B中aVR和V1导联可见伪r’波,其中aVR导联中伪r’波较V1导联更明显,而A中转为窦性心律后,aVR和V1导联均无伪r’波;C为D中典型AVNRT经超速起搏转为窦性心律的体表心电图,C中窦性心律时,aVR和V1导联中均可见伪r’波,D中AVNRT发作时,aVR和V1导联中伪r’波振幅升高50%,且aVR导联中伪r’波升高的振幅较V1导联更明显
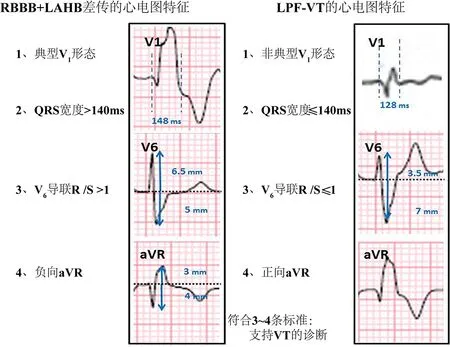
RBBB:右束支传导阻滞;LAHB:左前半分支阻滞;LPF-VT:左后分支室性心动过速
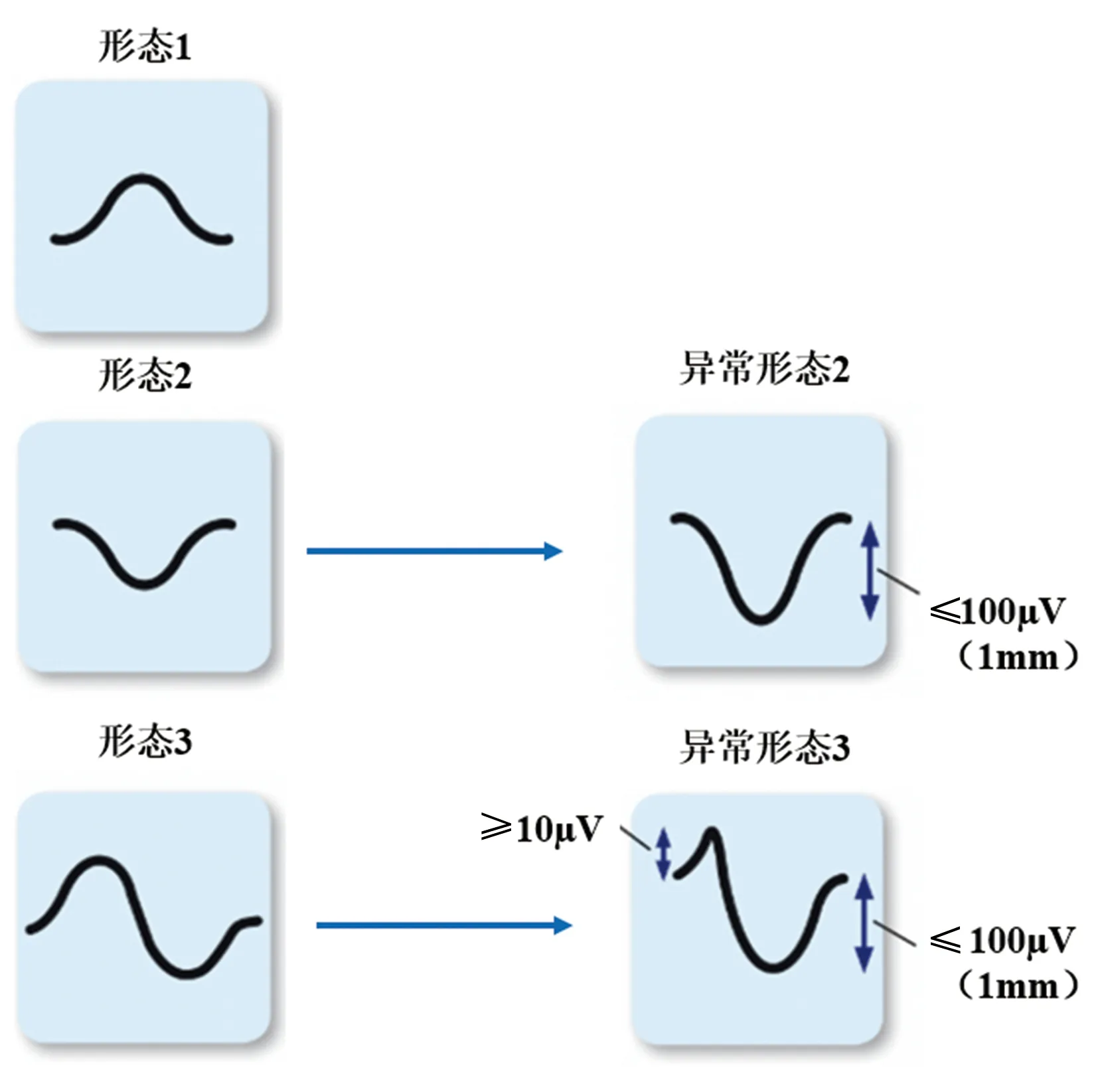
图5 V1和V2导联3种P波形态及左心房异常的P波形态[6]
7 碎裂QRS波用于预测肺栓塞临床恶化及死亡
心电图上碎裂QRS波(fragmented QRS complex,fQRS)常提示心肌缺血、瘢痕形成和纤维化引起的心肌激动的改变。既往研究发现,fQRS对急性肺栓塞(pulmonary embolism,PE)的预后具有潜在的预测价值。Qaddoura等[7]通过回顾2017年10月前的研究,最终纳入3项研究进行荟萃分析。发现fQRS可显著预测PE患者的住院死亡率(OR=2.92,95%CI:1.73~4.91,P<0.001)、心原性休克(OR=4.71,95%CI:1.61~13.70,P=0.005)和2年随访的全因死亡(OR=4.42,95%CI:2.57~7.60,P<0.001)。调整后的分析结果与以上结果基本一致。因此,研究者建议将fQRS与其他临床和心电图检查结果一并作为PE风险评分的一项指标。
8 V1~V2导联S-R差值用于流出道室性期前收缩的定位
目前,有不同的心电算法用于定位起源于流出道的室性心律失常。然而,它们的准确性和实用性仍有限,尤其是在V3导联移行的室性期前收缩。正确评估室性期前收缩起源于右室流出道(right ventricular outflow tract,RVOT)或左室流出道(left ventricular outflow tract,LVOT)可缩短标测消融时间、减少射线暴露和减少血管穿刺通路数量。Kaypakli等[8]提出,V1~V2导联S-R差值可用于准确区分流出道室性期前收缩的起源部位。V1~V2的S-R差值计算公式为:(V1S+V2S)-(V1R+V2R)(图6)。研究发现,LVOT来源室性期前收缩的V1~V2导联S-R差值明显低于RVOT来源的室性期前收缩。V1~V2导联S-R差值>1.635 mV诊断RVOT来源室性期前收缩的敏感度、特异度、阳性预测值和阴性预测值分别为95.1%、85.5%、86.5%和94.5%。

V1~V2的S-R差值计算公式为:(V1S+V2S)-(V1R+V2R),即(b+d)-(a+c)
9 Tp-e间期对致心律失常右室心肌病死亡率的预测作用
致心律失常右室心肌病(arrhythmogenic right ventricular cardiomyopathy,ARVC)是一种遗传性心肌病,以室性心律失常和特定的心室病理改变为特征。复极异常是ARVC患者心电图改变的常见原因,是导致危及生命的心律失常和死亡的重要因素。Cekirdekci等[9]研究发现,ARVC患者Tp-e间期、cTp-e间期、Tp-e/QT、Tp-e/QTc比值均明显高于健康人;并且,与存活者相比,ARVC死亡患者的Tp-e间期、cTp-e间期、Tp-e/QT比值、Tp-e/QTc比值均显著升高。多因素分析显示,右心室面积变化分数(OR=1.747,95%CI:1.012~3.018,P=0.045)、cTp-e间期水平(OR=1.166,95%CI:1.017~1.336,P=0.02)与全因死亡率相关。预测ARVC患者死亡参数的最佳截断值:Tp-e间期≥107 ms(敏感度为90%,特异度为88%),右心室面积变化分数<30%(敏感度为80%,特异度为88%)。
10 向量心电图用于预测心脏再同步化治疗的长期预后
虽然心脏再同步化治疗(CRT)已成为心力衰竭伴QRS增宽患者的既定治疗方法,但有相当比例的患者并未从中受益。既往研究发现,向量心电图可以预测植入CRT患者的左室重构和临床结局。Emerek等[10]通过分析705例CRT植入患者[平均年龄(66.66±11.5)岁]的向量心电图,比较了2种不同的心电向量测量方法(QRS面积和绝对QRS-T积分)和2种转换矩阵(Kors矩阵和Dower逆矩阵)的预测能力(图7),发现Kors向量心电图QRS面积计算法具有较好的CRT预后预测价值。QRS面积较小(<95μVs)的患者在整个队列(校正HR=1.65,95%CI:1.25~2.18,P<0.001)和LBBB亚组(校正HR=1.95,95%CI:1.38~2.76,P<0.001)中的心脏移植和左室辅助装置植入危险性增加。QRS面积与QRS<150 ms(未校正的HR=3.85,95%CI:2.02~7.37,P<0.001)和QRS≥150 ms(未校正的HR=1.76,95%CI:1.32~2.34,P<0.001)的患者的预后相关。
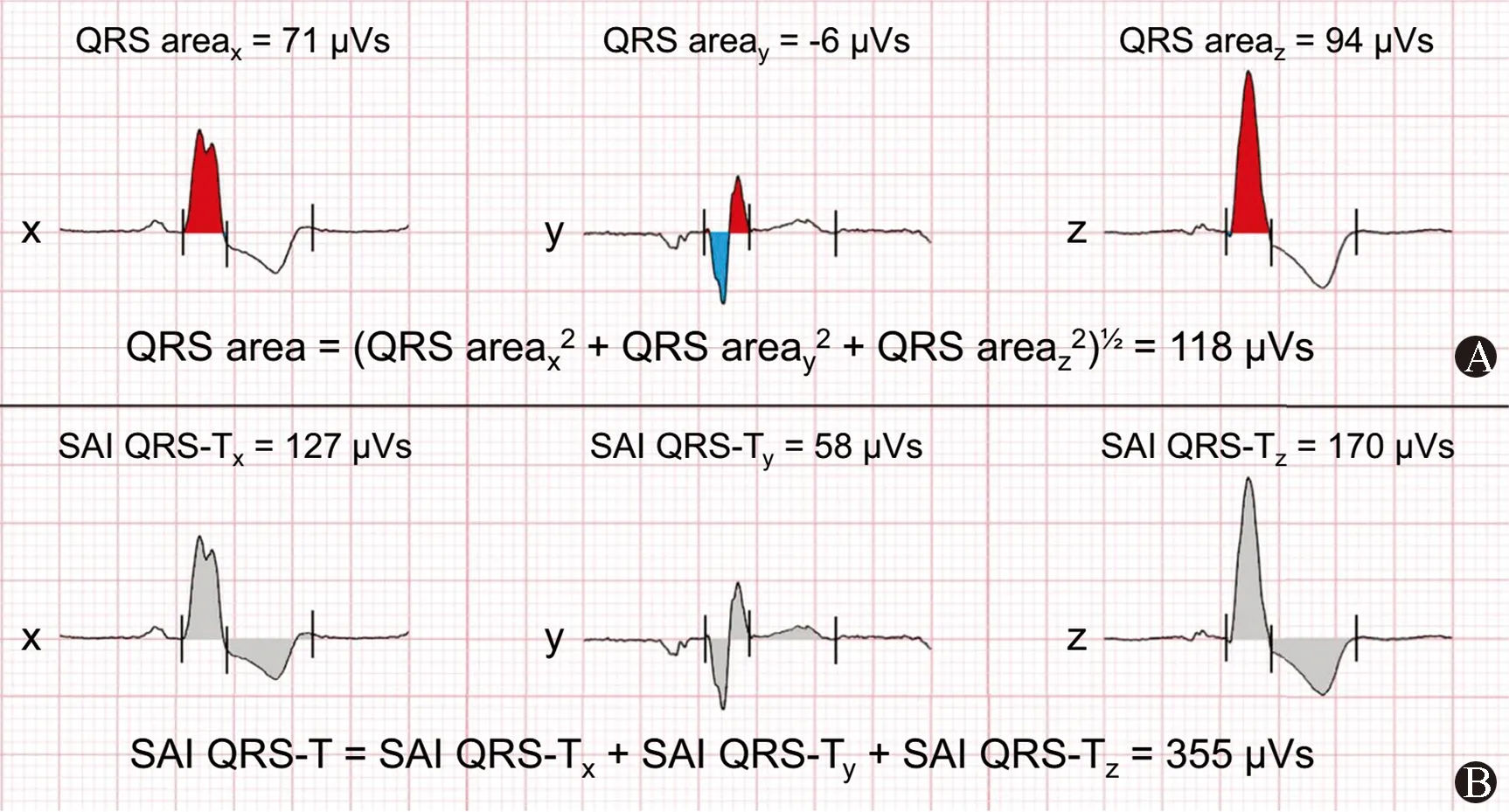
A:从QRS波群的起始点到终末,利用偏移量和基线之间的积分计算QRS面积;B:SAI QRS-T是正交导联QRS波和T波偏移量绝对面积的总和。垂直线标志着QRS波和T波偏移的起始和终末
11 小结
综上所述,过去一年心电学研究探讨了心电学指标在预测心血管疾病风险的新方向,探索了心电鉴别的新指标,并提出了对疾病与诊断方法的新认识。学习前沿研究进展在指导心电学学科发展,促进医者进步,改善患者诊疗效果,乃至惠及全民健康具有重要意义。
利益冲突:无
